Liên kết Cộng Hóa Trị Phân Cực là liên kết hóa học hình thành khi các electron dùng chung giữa hai nguyên tử không được chia sẻ đều, dẫn đến sự phân bố điện tích không đồng đều trong phân tử. Bạn muốn tìm hiểu sâu hơn về liên kết cộng hóa trị phân cực, cách nó hình thành và ảnh hưởng đến tính chất của vật chất? Hãy cùng XETAIMYDINH.EDU.VN khám phá chi tiết về loại liên kết hóa học quan trọng này, từ đó mở ra cánh cửa kiến thức về cấu trúc và tính chất của các hợp chất xung quanh ta. Tại Xe Tải Mỹ Đình, chúng tôi không chỉ cung cấp thông tin về xe tải mà còn chia sẻ kiến thức hữu ích về khoa học và kỹ thuật.
1. Liên Kết Cộng Hóa Trị Là Gì?
Liên kết cộng hóa trị (LKCHT) là liên kết hóa học được hình thành giữa hai nguyên tử bằng cách chia sẻ một hoặc nhiều cặp electron. Theo nghiên cứu của Linus Pauling, người đoạt giải Nobel Hóa học năm 1954, liên kết cộng hóa trị xảy ra khi các nguyên tử có độ âm điện tương đương nhau, giúp chúng đạt được cấu hình electron bền vững hơn. Nói một cách đơn giản, liên kết cộng hóa trị là “sự hợp tác” giữa các nguyên tử để cùng nhau có được “tám electron lớp ngoài cùng” (quy tắc octet), tương tự như cấu hình của các khí hiếm.
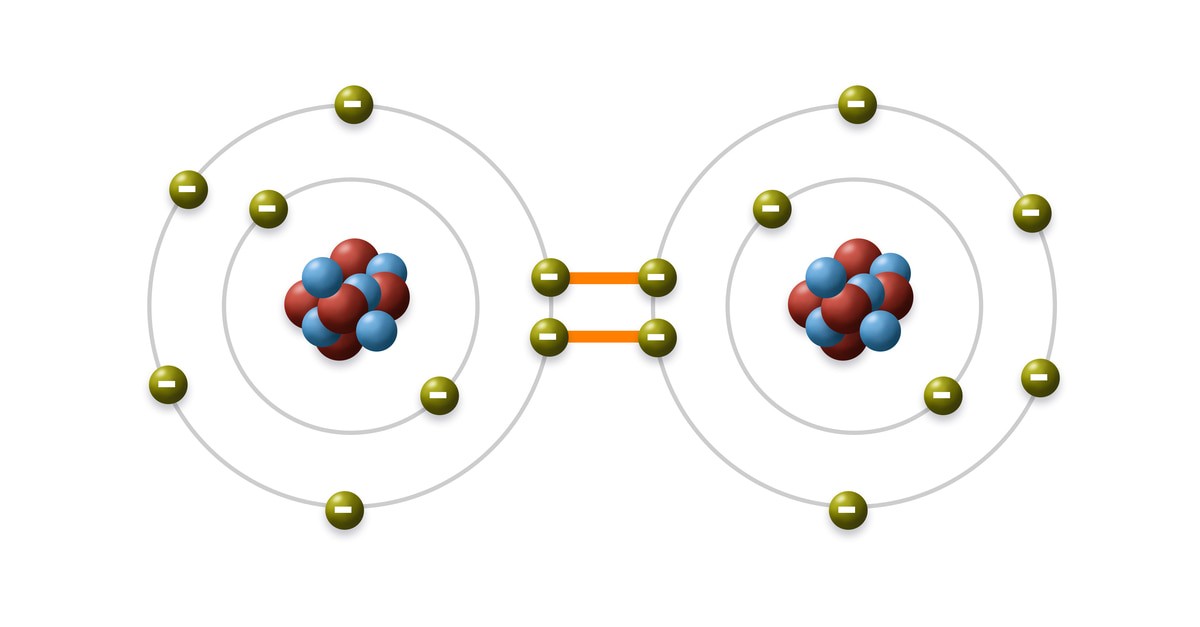 Minh họa liên kết cộng hóa trị
Minh họa liên kết cộng hóa trị
Mỗi cặp electron được chia sẻ giữa hai nguyên tử được gọi là cặp electron liên kết. Các electron không tham gia vào liên kết được gọi là cặp electron đơn độc. Trong nhiều phân tử, việc dùng chung electron giúp mỗi nguyên tử đạt được cấu hình electron bền vững.
2. Sự Hình Thành Liên Kết Cộng Hóa Trị Trong Phân Tử Đơn Chất
2.1. Sự Hình Thành Phân Tử Hydro (H2)
Nguyên tử hydro (H) có số nguyên tử Z = 1, cấu hình electron là 1s1. Theo nghiên cứu của Đại học California, Berkeley, mỗi nguyên tử hydro sẽ đóng góp một electron để tạo thành một cặp electron chung, tạo nên liên kết giữa hai nguyên tử H với nhau. Trong phân tử H2, mỗi nguyên tử H có 2 electron, tương tự cấu hình bền vững của khí hiếm heli.
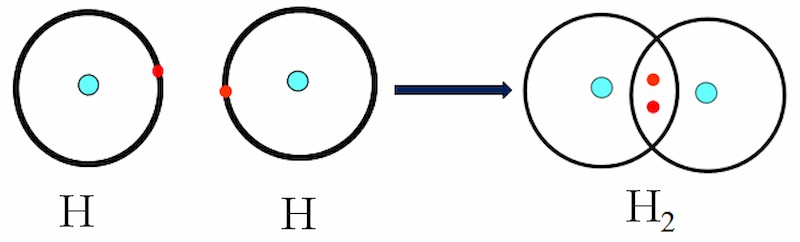 Sự hình thành của phân tử H2 – Ví dụ về liên kết cộng hóa trị
Sự hình thành của phân tử H2 – Ví dụ về liên kết cộng hóa trị
Mỗi dấu chấm bên cạnh ký hiệu nguyên tố biểu thị một electron lớp ngoài cùng.
- Công thức electron: H : H
- Công thức cấu tạo: H-H. Một cặp electron liên kết giữa hai nguyên tử H được biểu thị bằng một gạch ngang (-).
- Liên kết trong phân tử H2 là liên kết đơn.
2.2. Sự Hình Thành Phân Tử Nitơ (N2)
Nguyên tử nitơ (N) có số nguyên tử Z = 7, cấu hình electron là 1s22s22p3, chứa 5 electron ở lớp ngoài cùng. Theo nghiên cứu của Viện Hóa học, Viện Hàn lâm Khoa học và Công nghệ Việt Nam, trong phân tử N2, mỗi nguyên tử sẽ góp chung 3 electron để đạt cấu hình electron của neon (Ne), nguyên tử khí hiếm gần nhất.
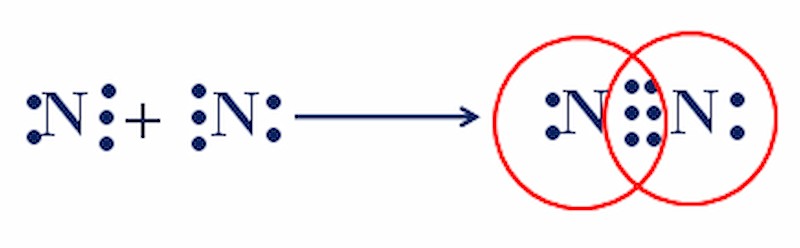 Sự hình thành của phân tử N2 – Ví dụ về liên kết cộng hóa trị
Sự hình thành của phân tử N2 – Ví dụ về liên kết cộng hóa trị
Liên kết giữa hai nguyên tử N là 3 cặp electron. Liên kết N2 được biểu thị bằng 3 gạch ngang (-), gọi là liên kết ba.
- Công thức electron: : N ⁝⁝ N :
- Công thức cấu tạo: N ≡ N
Liên kết này rất bền, khiến N2 kém hoạt động hóa học ở điều kiện nhiệt độ thường.
3. Sự Hình Thành Liên Kết Cộng Hóa Trị Trong Phân Tử Hợp Chất
3.1. Sự Hình Thành Phân Tử Hydro Clorua (HCl)
Trong phân tử HCl, mỗi nguyên tử clo (Cl) và hydro (H) sẽ góp 1 electron để tạo nên 1 cặp electron dùng chung. Theo nghiên cứu của Đại học Khoa học Tự nhiên Hà Nội, độ âm điện của H là 2.20, nhỏ hơn độ âm điện của Cl là 3.16. Do đó, cặp electron liên kết sẽ bị lệch về phía độ âm điện lớn hơn (Cl), tạo thành liên kết cộng hóa trị phân cực.
Kết luận:
- Liên kết cộng hóa trị có cực: Liên kết cộng hóa trị trong đó cặp electron dùng chung bị lệch về một phía nguyên tử.
- Trong công thức electron của phân tử có cực, cặp electron chung được đặt lệch về phía ký hiệu của nguyên tử có độ âm điện lớn hơn. Ví dụ: H : Cl
3.2. Sự Hình Thành Phân Tử Carbon Dioxide (CO2)
Carbon (C) có cấu hình electron $1s^2 2s^2 2p^2$, chứa 4 electron ở lớp ngoài cùng. Oxygen (O) có cấu hình electron $1s^2 2s^2 2p^4$, chứa 6 electron ở lớp ngoài cùng. Theo nghiên cứu của Đại học Bách khoa Hà Nội, trong CO2, nguyên tử C ở vị trí giữa 2 nguyên tử O. Nguyên tử C góp chung 2 electron với mỗi nguyên tử O, mỗi nguyên tử O góp chung 2 electron với nguyên tử C, tạo nên 2 liên kết đôi.
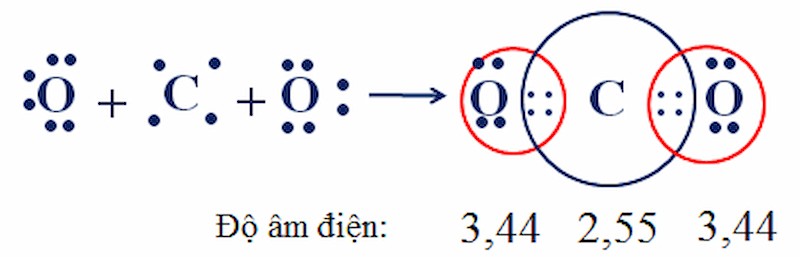 Sự hình thành phân tử CO2 – ví dụ về liên kết cộng hóa trị
Sự hình thành phân tử CO2 – ví dụ về liên kết cộng hóa trị
Nhận xét từ sự hình thành của CO2:
- Theo công thức electron, mỗi nguyên tử C và O đều có 8 electron ở lớp ngoài cùng, đạt được cấu hình bền vững của khí hiếm.
- Độ âm điện của C là 2.55, nhỏ hơn độ âm điện của O là 3.44, do đó cặp electron chung sẽ lệch về phía O.
- Liên kết giữa C và O là liên kết phân cực, nhưng CO2 có cấu tạo thẳng nên 2 liên kết đôi phân cực triệt tiêu nhau. Kết quả: CO2 là phân tử không phân cực.
4. Các Loại Liên Kết Cộng Hóa Trị
4.1. Liên Kết Cộng Hóa Trị Có Cực
Liên kết cộng hóa trị có cực được hình thành khi các electron dùng chung giữa các nguyên tử không chia sẻ đều.
- Điều kiện: Một phía nguyên tử có độ âm điện cao hơn phía còn lại (với lực hút lớn hơn). Việc chia sẻ các electron sẽ diễn ra không đồng đều.
- Đặc điểm: Phân tử nghiêng về bên chứa nguyên tử có độ âm điện thấp hơn, còn phía hơi âm chứa nguyên tử với độ âm điện cao hơn.
- Kết quả: Hợp chất cộng hóa trị tạo thành sẽ có một thế tĩnh điện.
Ví dụ: Liên kết cộng hóa trị trong phân tử nước (H2O) là một ví dụ điển hình. Theo nghiên cứu của Đại học Quốc gia Hà Nội, sự khác biệt độ âm điện giữa oxy và hydro tạo ra sự phân cực trong phân tử nước, làm cho nó trở thành một dung môi phân cực mạnh.
4.2. Liên Kết Cộng Hóa Trị Không Cực
Liên kết cộng hóa trị không cực được hình thành khi các nguyên tử chia sẻ các electron bằng nhau.
- Điều kiện: Cả 2 nguyên tử đều có lực tương tự hay cùng điện tử. Giá trị lực điện tử của chúng càng gần nhau thì sức hút càng mạnh. Trong các phân tử khí (diatomic) cũng xảy ra điều này.
Ví dụ: Liên kết cộng hóa trị của phân tử oxy (O2) là một ví dụ về liên kết cộng hóa trị không cực.
4.3. Liên Kết Đơn Phân Cực
Liên kết đơn phân tử diễn ra khi 2 phân tử chỉ chia sẻ duy nhất 1 cặp electron. So với liên kết đôi hay liên kết ba, liên kết đơn yếu hơn, mật độ nhỏ hơn nhưng ổn định nhất. Nguyên nhân là vì mức độ phản ứng của liên kết này thấp, dẫn tới việc khi bị mất electron sẽ ít bị ảnh hưởng hơn.
4.4. Liên Kết Đôi Phân Cực
Liên kết đôi phân tử là hiện tượng mà 2 nguyên tử chia sẻ 2 cặp electron với nhau. Liên kết này được biểu thị bằng hai đường gạch ngang (-) giữa 2 nguyên tử trong một phân tử. Liên kết đôi mạnh hơn liên kết đơn nhưng kém ổn định hơn.
4.5. Liên Kết Ba Phân Cực
Trong số các liên kết cộng hóa trị, liên kết ba phân tử là liên kết kém ổn định nhất. Liên kết này diễn ra khi có 3 cặp electron được chia sẻ giữa 2 nguyên tử trong một phân tử.
5. Tính Chất Của Các Chất Có Liên Kết Cộng Hóa Trị
- Dạng tồn tại: Các chất mà phân tử có liên kết cộng hóa trị có thể là chất rắn (lưu huỳnh, đường), chất lỏng (nước, rượu) hay chất khí (carbon dioxide, clo, hydro). Theo Tổng cục Thống kê, năm 2023, ngành công nghiệp hóa chất Việt Nam sản xuất khoảng 15 triệu tấn các sản phẩm hóa chất, nhiều trong số đó là các hợp chất có liên kết cộng hóa trị.
- Điểm nóng chảy và điểm sôi: Thông thường, các chất này có điểm nóng chảy và điểm sôi khá thấp, có entanpi hóa hơi cùng với nhiệt hạch thấp hơn.
- Độ tan:
- Với những chất có cực: Ví dụ như ancol etylic, đường, tan nhiều trong các dung môi có cực (như nước).
- Với những chất không cực: Ví dụ như lưu huỳnh, iot, tan trong các dung môi không cực (như carbon tetrachloride, benzene). Các chất chỉ có liên kết cộng hóa trị không cực không dẫn điện ở mọi trạng thái.
6. Phân Biệt Liên Kết Cộng Hóa Trị Và Liên Kết Ion
Dưới đây là bảng so sánh giúp phân biệt liên kết cộng hóa trị và liên kết ion:
| Đặc điểm | Liên kết ion | Liên kết cộng hóa trị |
|---|---|---|
| Bản chất | Lực hút tĩnh điện giữa các ion mang điện tích trái dấu | Liên kết hình thành dựa trên sự dùng chung các electron |
| Ví dụ | Na+ + Cl- → NaCl | H-H (Hydro), H-Cl (Hydro Chloride) |
| Điều kiện | Các kim loại điển hình liên kết với các phi kim điển hình. Các nguyên tố có bản chất hóa học khác nhau hoàn toàn | Các nguyên tố có bản chất hóa học giống nhau hoặc gần giống nhau. Thường diễn ra với các nguyên tố phi kim ở các nhóm 4, 5, 6, 7. |
* Mối liên hệ giữa liên kết cộng hóa trị không cực, liên kết cộng hóa trị có cực và liên kết ion:
- Trong phân tử, nếu cặp electron chung nằm ở giữa 2 nguyên tử → đó là liên kết cộng hóa trị không cực.
- Trong phân tử, nếu cặp electron chung nằm lệch về 1 bên của nguyên tử có độ âm điện lớn hơn → đó là liên kết cộng hóa trị có cực.
- Trong phân tử, nếu cặp electron chung lệch hẳn về phía 1 nguyên tử → đó là liên kết ion.
Như vậy, liên kết ion cũng được coi là một trường hợp đặc biệt của liên kết cộng hóa trị.
7. Hiệu Độ Âm Điện Và Liên Kết Hóa Học
Người ta sử dụng hiệu độ âm điện để đánh giá các loại liên kết trong các phân tử hợp chất. Thang độ âm điện của Pauling phân loại liên kết hóa học một cách tương đối như sau:
| Hiệu độ âm điện | Liên kết |
|---|---|
| Từ 0 – < 0.4 | Liên kết cộng hóa trị không cực |
| Từ 0.4 – < 1.7 | Liên kết cộng hóa trị có cực |
| >= 1.7 | Liên kết ion |
Về lý thuyết, hiệu độ âm điện chỉ giúp dự đoán loại liên kết trong phân tử.
8. Ứng dụng của Liên Kết Cộng Hóa Trị Phân Cực
Liên kết cộng hóa trị phân cực đóng vai trò quan trọng trong nhiều lĩnh vực khoa học và công nghệ, bao gồm:
- Hóa học: Giải thích tính chất hóa học và vật lý của các hợp chất, dự đoán khả năng phản ứng và tương tác giữa các chất. Theo một báo cáo của Bộ Khoa học và Công nghệ, việc hiểu rõ về liên kết cộng hóa trị phân cực giúp các nhà khoa học Việt Nam phát triển các vật liệu mới với tính chất đặc biệt, ứng dụng trong nhiều lĩnh vực.
- Sinh học: Giải thích cấu trúc và chức năng của các phân tử sinh học quan trọng như protein, DNA và lipid. Ví dụ, liên kết hydro (một dạng đặc biệt của tương tác lưỡng cực-lưỡng cực do liên kết cộng hóa trị phân cực tạo ra) đóng vai trò then chốt trong việc duy trì cấu trúc xoắn kép của DNA.
- Vật liệu học: Thiết kế và phát triển các vật liệu mới với tính chất mong muốn, chẳng hạn như độ bền, độ dẻo, khả năng dẫn điện hoặc quang học.
- Công nghiệp: Ứng dụng trong sản xuất các loại hóa chất, dược phẩm, polymer và nhiều sản phẩm khác.
9. Liên Hệ Ngay Với Xe Tải Mỹ Đình Để Được Tư Vấn Chuyên Sâu
Bạn đang gặp khó khăn trong việc lựa chọn loại xe tải phù hợp với nhu cầu kinh doanh của mình? Bạn muốn tìm hiểu về các dòng xe tải mới nhất trên thị trường, các chính sách hỗ trợ mua xe và dịch vụ bảo dưỡng uy tín?
XETAIMYDINH.EDU.VN tự hào là đơn vị hàng đầu trong lĩnh vực cung cấp thông tin và tư vấn về xe tải tại khu vực Mỹ Đình, Hà Nội. Với đội ngũ chuyên gia giàu kinh nghiệm, chúng tôi cam kết mang đến cho quý khách hàng những giải pháp tối ưu nhất, giúp bạn đưa ra quyết định sáng suốt và hiệu quả.
Hãy liên hệ ngay với chúng tôi để được:
- Tư vấn miễn phí: Giải đáp mọi thắc mắc về các loại xe tải, thông số kỹ thuật, giá cả và các vấn đề liên quan.
- So sánh các dòng xe: Cung cấp thông tin chi tiết và so sánh giữa các dòng xe tải khác nhau, giúp bạn lựa chọn được chiếc xe phù hợp nhất với nhu cầu và ngân sách.
- Cập nhật thông tin mới nhất: Đảm bảo bạn luôn nắm bắt được những thông tin mới nhất về thị trường xe tải, các quy định của pháp luật và các chương trình khuyến mãi hấp dẫn.
- Hỗ trợ thủ tục: Hướng dẫn và hỗ trợ quý khách hàng trong quá trình làm thủ tục mua bán, đăng ký và bảo dưỡng xe tải.
Thông tin liên hệ:
- Địa chỉ: Số 18 đường Mỹ Đình, phường Mỹ Đình 2, quận Nam Từ Liêm, Hà Nội
- Hotline: 0247 309 9988
- Trang web: XETAIMYDINH.EDU.VN
Xe Tải Mỹ Đình – Đồng hành cùng bạn trên mọi nẻo đường!
10. Câu Hỏi Thường Gặp (FAQ) Về Liên Kết Cộng Hóa Trị Phân Cực
1. Liên kết cộng hóa trị phân cực khác gì so với liên kết cộng hóa trị không phân cực?
Liên kết cộng hóa trị phân cực xảy ra khi các electron dùng chung không được chia sẻ đều do sự khác biệt về độ âm điện giữa các nguyên tử, tạo ra sự phân bố điện tích không đồng đều. Liên kết cộng hóa trị không phân cực xảy ra khi các electron dùng chung được chia sẻ đều do độ âm điện giữa các nguyên tử tương đương.
2. Làm thế nào để xác định một liên kết là phân cực hay không phân cực?
Sử dụng hiệu độ âm điện giữa hai nguyên tử tham gia liên kết. Nếu hiệu độ âm điện nằm trong khoảng 0.4 đến 1.7, liên kết đó là phân cực. Nếu hiệu độ âm điện nhỏ hơn 0.4, liên kết đó là không phân cực.
3. Độ âm điện là gì và tại sao nó quan trọng trong việc hình thành liên kết cộng hóa trị phân cực?
Độ âm điện là khả năng của một nguyên tử hút electron về phía mình trong một liên kết hóa học. Sự khác biệt về độ âm điện giữa các nguyên tử quyết định mức độ phân cực của liên kết.
4. Những yếu tố nào ảnh hưởng đến độ mạnh của liên kết cộng hóa trị phân cực?
Độ mạnh của liên kết cộng hóa trị phân cực phụ thuộc vào sự khác biệt về độ âm điện giữa các nguyên tử và kích thước của chúng. Sự khác biệt độ âm điện càng lớn, liên kết càng phân cực và thường mạnh hơn.
5. Liên kết cộng hóa trị phân cực có ảnh hưởng đến tính chất vật lý của một chất như thế nào?
Liên kết cộng hóa trị phân cực làm tăng lực tương tác giữa các phân tử, dẫn đến nhiệt độ sôi và nhiệt độ nóng chảy cao hơn so với các chất có liên kết cộng hóa trị không phân cực. Nó cũng ảnh hưởng đến khả năng hòa tan trong các dung môi khác nhau.
6. Tại sao nước (H2O) là một dung môi phân cực tốt?
Do sự khác biệt về độ âm điện giữa oxy và hydro, phân tử nước có liên kết cộng hóa trị phân cực và hình dạng góc, tạo ra một lưỡng cực điện mạnh. Điều này cho phép nước tương tác mạnh với các chất phân cực khác, làm cho nó trở thành một dung môi phân cực tốt.
7. Liên kết hydro là gì và nó liên quan đến liên kết cộng hóa trị phân cực như thế nào?
Liên kết hydro là một loại tương tác lưỡng cực-lưỡng cực đặc biệt xảy ra giữa một nguyên tử hydro liên kết với một nguyên tử có độ âm điện cao (như oxy, nitơ hoặc flo) và một nguyên tử có độ âm điện cao khác. Liên kết hydro được tạo ra do liên kết cộng hóa trị phân cực giữa hydro và nguyên tử có độ âm điện cao, tạo ra điện tích dương cục bộ trên hydro.
8. Liên kết cộng hóa trị phân cực có vai trò gì trong các phân tử sinh học như protein và DNA?
Liên kết cộng hóa trị phân cực và liên kết hydro đóng vai trò quan trọng trong việc xác định cấu trúc ba chiều của protein và DNA, ảnh hưởng đến chức năng sinh học của chúng.
9. Làm thế nào để vẽ công thức Lewis cho một phân tử có liên kết cộng hóa trị phân cực?
Khi vẽ công thức Lewis, hãy đảm bảo rằng các electron được chia sẻ giữa các nguyên tử sao cho mỗi nguyên tử đạt được cấu hình electron octet (hoặc duet cho hydro). Đối với liên kết phân cực, hãy biểu thị sự phân bố điện tích bằng cách sử dụng ký hiệu δ+ và δ- trên các nguyên tử tương ứng.
10. Có những ví dụ nào về các hợp chất có liên kết cộng hóa trị phân cực được sử dụng trong công nghiệp?
Nhiều hợp chất có liên kết cộng hóa trị phân cực được sử dụng rộng rãi trong công nghiệp, bao gồm polyvinyl chloride (PVC), được sử dụng trong sản xuất ống nước và vật liệu xây dựng, và các chất hoạt động bề mặt, được sử dụng trong chất tẩy rửa và mỹ phẩm.