Cho Từ Từ Hcl Vào Na2co3 sẽ tạo ra hiện tượng sủi bọt khí không màu, không mùi. Hiện tượng này xảy ra do phản ứng hóa học tạo thành khí CO2. Xe Tải Mỹ Đình sẽ giúp bạn hiểu rõ hơn về phản ứng này, cùng những ứng dụng và lưu ý quan trọng liên quan. Hãy cùng khám phá chi tiết để nắm vững kiến thức hóa học thú vị này nhé!
1. Phản Ứng Hóa Học Khi Cho Từ Từ HCl Vào Na2CO3 Diễn Ra Như Thế Nào?
Khi nhỏ từ từ dung dịch axit clohydric (HCl) vào dung dịch natri cacbonat (Na2CO3), sẽ xảy ra phản ứng hóa học tạo thành natri clorua (NaCl), nước (H2O) và khí cacbon đioxit (CO2).
Phương trình phản ứng tổng quát như sau:
Na2CO3(dung dịch) + 2HCl(dung dịch) → 2NaCl(dung dịch) + H2O(lỏng) + CO2(khí)
1.1. Cơ Chế Phản Ứng Chi Tiết
Phản ứng này thực tế diễn ra qua hai giai đoạn:
-
Giai đoạn 1: Đầu tiên, HCl phản ứng với Na2CO3 tạo thành natri bicacbonat (NaHCO3) và natri clorua (NaCl).
Na2CO3(dung dịch) + HCl(dung dịch) → NaHCO3(dung dịch) + NaCl(dung dịch)
-
Giai đoạn 2: Sau đó, NaHCO3 tiếp tục phản ứng với HCl tạo thành NaCl, H2O và CO2.
NaHCO3(dung dịch) + HCl(dung dịch) → NaCl(dung dịch) + H2O(lỏng) + CO2(khí)
1.2. Vì Sao Phản Ứng Xảy Ra Theo Hai Giai Đoạn?
Phản ứng xảy ra theo hai giai đoạn do tính bazơ của Na2CO3 mạnh hơn NaHCO3. HCl sẽ ưu tiên phản ứng với chất có tính bazơ mạnh hơn trước. Khi HCl được thêm từ từ, nó sẽ trung hòa Na2CO3 trước, sau đó mới trung hòa NaHCO3 nếu còn dư.
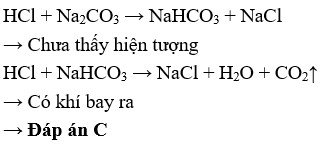 Hiện Tượng Sủi Bọt Khí CO2 Khi Cho HCl Vào Na2CO3
Hiện Tượng Sủi Bọt Khí CO2 Khi Cho HCl Vào Na2CO3
2. Hiện Tượng Quan Sát Được Khi Cho Từ Từ HCl Vào Na2CO3 Là Gì?
Hiện tượng rõ ràng nhất khi cho từ từ HCl vào Na2CO3 là sự sủi bọt khí. Khí này là CO2, không màu, không mùi và không duy trì sự cháy.
2.1. Giải Thích Chi Tiết Hiện Tượng
- Sủi bọt khí: Khi HCl phản ứng với Na2CO3 và NaHCO3, khí CO2 được giải phóng. Các bọt khí này thoát ra khỏi dung dịch, tạo nên hiện tượng sủi bọt.
- Không màu, không mùi: CO2 là một khí không màu và không mùi, do đó bọt khí thoát ra không có màu và không gây ra mùi đặc biệt.
- Không duy trì sự cháy: CO2 không phải là chất duy trì sự cháy, vì vậy nếu đưa que diêm đang cháy vào ống nghiệm chứa khí CO2, que diêm sẽ tắt.
2.2. So Sánh Với Các Phản Ứng Khác
Để so sánh, nếu cho từ từ Na2CO3 vào HCl, hiện tượng sủi bọt cũng xảy ra, nhưng có thể không mãnh liệt bằng do nồng độ HCl tại chỗ cao hơn. Điều này dẫn đến tốc độ phản ứng nhanh hơn ngay từ đầu.
3. Ứng Dụng Của Phản Ứng Giữa HCl Và Na2CO3 Trong Thực Tế Là Gì?
Phản ứng giữa HCl và Na2CO3 có nhiều ứng dụng quan trọng trong các lĩnh vực khác nhau.
3.1. Trong Phòng Thí Nghiệm
- Điều chế khí CO2: Phản ứng này là một phương pháp đơn giản và hiệu quả để điều chế khí CO2 trong phòng thí nghiệm. CO2 được sử dụng trong nhiều thí nghiệm hóa học và sinh học.
- Chuẩn độ: Phản ứng này có thể được sử dụng trong chuẩn độ axit-bazơ để xác định nồng độ của dung dịch HCl hoặc Na2CO3.
3.2. Trong Công Nghiệp
- Sản xuất hóa chất: CO2 thu được từ phản ứng này có thể được sử dụng làm nguyên liệu để sản xuất các hóa chất khác, chẳng hạn như urê và metanol.
- Xử lý nước: Na2CO3 được sử dụng để trung hòa axit trong nước thải công nghiệp, và HCl được sử dụng để điều chỉnh độ pH của nước.
3.3. Trong Đời Sống Hàng Ngày
- Làm sạch: Na2CO3 (soda ash) được sử dụng trong các sản phẩm làm sạch gia dụng, và HCl (axit muriatic) được sử dụng để làm sạch bề mặt kim loại và loại bỏ cặn bám.
- Nấu ăn: Na2CO3 (baking soda) được sử dụng trong nấu ăn để làm bánh nở, và HCl có thể được sử dụng trong một số quy trình chế biến thực phẩm.
4. Những Lưu Ý Quan Trọng Khi Thực Hiện Phản Ứng Giữa HCl Và Na2CO3 Là Gì?
Khi thực hiện phản ứng giữa HCl và Na2CO3, cần lưu ý một số điểm quan trọng để đảm bảo an toàn và hiệu quả.
4.1. An Toàn
- Sử dụng đồ bảo hộ: Luôn đeo kính bảo hộ và găng tay khi làm việc với axit HCl và dung dịch Na2CO3 để tránh tiếp xúc trực tiếp với da và mắt.
- Thông gió tốt: Thực hiện phản ứng trong khu vực có thông gió tốt để tránh hít phải khí CO2 quá nhiều.
- Xử lý hóa chất cẩn thận: Tránh làm đổ hóa chất và luôn tuân thủ các quy tắc an toàn hóa chất trong phòng thí nghiệm.
4.2. Hiệu Quả
- Nhỏ từ từ HCl: Để kiểm soát phản ứng và tránh tạo bọt quá nhiều, nên nhỏ từ từ HCl vào dung dịch Na2CO3.
- Khuấy đều: Khuấy đều dung dịch trong quá trình phản ứng để đảm bảo các chất phản ứng tiếp xúc tốt với nhau.
- Nồng độ thích hợp: Sử dụng nồng độ HCl và Na2CO3 phù hợp để đạt hiệu quả tốt nhất.
4.3. Môi Trường
- Xử lý chất thải: Xử lý chất thải sau phản ứng theo quy định của phòng thí nghiệm hoặc cơ sở xử lý chất thải để bảo vệ môi trường.
- Giảm thiểu lượng hóa chất: Sử dụng lượng hóa chất vừa đủ để thực hiện phản ứng, tránh lãng phí và giảm thiểu tác động đến môi trường.
5. Điều Gì Sẽ Xảy Ra Nếu Thay Đổi Nồng Độ Hoặc Thể Tích Của HCl Và Na2CO3?
Thay đổi nồng độ hoặc thể tích của HCl và Na2CO3 sẽ ảnh hưởng đến tốc độ phản ứng và lượng khí CO2 tạo thành.
5.1. Ảnh Hưởng Của Nồng Độ
- Nồng độ HCl: Nếu nồng độ HCl tăng, tốc độ phản ứng sẽ tăng và lượng khí CO2 tạo thành trong một đơn vị thời gian cũng tăng. Tuy nhiên, nếu nồng độ quá cao, phản ứng có thể xảy ra quá nhanh, gây khó kiểm soát và tạo bọt quá nhiều.
- Nồng độ Na2CO3: Tương tự, nếu nồng độ Na2CO3 tăng, tốc độ phản ứng cũng tăng. Tuy nhiên, cần lưu ý rằng nồng độ Na2CO3 quá cao có thể làm giảm độ tan của CO2 trong dung dịch, dẫn đến việc CO2 thoát ra nhanh hơn và gây khó khăn trong việc thu khí.
5.2. Ảnh Hưởng Của Thể Tích
- Thể tích HCl: Nếu tăng thể tích HCl, lượng khí CO2 tạo thành sẽ tăng tương ứng, miễn là Na2CO3 vẫn còn đủ để phản ứng. Nếu thể tích HCl vượt quá lượng cần thiết để phản ứng hết với Na2CO3, lượng HCl dư sẽ làm giảm độ pH của dung dịch.
- Thể tích Na2CO3: Nếu tăng thể tích Na2CO3, lượng khí CO2 có thể tạo thành cũng tăng, miễn là HCl vẫn còn đủ để phản ứng. Tuy nhiên, nếu thể tích Na2CO3 quá lớn so với HCl, phản ứng có thể xảy ra chậm hơn do nồng độ HCl tại chỗ thấp hơn.
5.3. Tối Ưu Hóa Điều Kiện Phản Ứng
Để tối ưu hóa phản ứng, cần điều chỉnh nồng độ và thể tích của HCl và Na2CO3 sao cho phù hợp với mục đích thí nghiệm hoặc ứng dụng cụ thể. Thường thì, nên sử dụng nồng độ vừa phải và nhỏ từ từ HCl vào Na2CO3 để kiểm soát tốc độ phản ứng và thu được lượng khí CO2 tối ưu.
6. Phản Ứng Giữa HCl Và Na2CO3 Có Tuân Theo Định Luật Bảo Toàn Khối Lượng Không?
Phản ứng giữa HCl và Na2CO3 tuân theo định luật bảo toàn khối lượng. Điều này có nghĩa là tổng khối lượng của các chất phản ứng (HCl và Na2CO3) bằng tổng khối lượng của các sản phẩm (NaCl, H2O và CO2).
6.1. Định Luật Bảo Toàn Khối Lượng
Định luật bảo toàn khối lượng là một trong những định luật cơ bản của hóa học, phát biểu rằng khối lượng của một hệ kín không thay đổi theo thời gian, ngay cả khi có các biến đổi hóa học xảy ra bên trong hệ.
6.2. Chứng Minh Định Luật Bảo Toàn Khối Lượng Trong Phản Ứng Này
Để chứng minh định luật bảo toàn khối lượng trong phản ứng giữa HCl và Na2CO3, ta có thể thực hiện thí nghiệm sau:
- Chuẩn bị: Cân chính xác một lượng dung dịch HCl và một lượng dung dịch Na2CO3.
- Thực hiện phản ứng: Trộn hai dung dịch lại với nhau trong một bình kín.
- Cân lại: Sau khi phản ứng kết thúc, cân lại bình và các chất bên trong.
- So sánh: So sánh tổng khối lượng của HCl và Na2CO3 trước phản ứng với tổng khối lượng của bình và các chất sau phản ứng.
Kết quả thí nghiệm sẽ cho thấy rằng tổng khối lượng trước và sau phản ứng là như nhau, chứng minh định luật bảo toàn khối lượng.
6.3. Ý Nghĩa Của Định Luật Bảo Toàn Khối Lượng
Định luật bảo toàn khối lượng có ý nghĩa quan trọng trong việc tính toán và dự đoán kết quả của các phản ứng hóa học. Nó cho phép chúng ta xác định lượng chất cần thiết để phản ứng và lượng sản phẩm tạo thành, giúp tối ưu hóa các quy trình hóa học và đảm bảo hiệu quả kinh tế.
7. Làm Thế Nào Để Thu Khí CO2 Sinh Ra Từ Phản Ứng Giữa HCl Và Na2CO3?
Khí CO2 sinh ra từ phản ứng giữa HCl và Na2CO3 có thể được thu bằng nhiều phương pháp khác nhau, tùy thuộc vào mục đích sử dụng và điều kiện thí nghiệm.
7.1. Phương Pháp Đẩy Nước
Phương pháp đẩy nước là một phương pháp đơn giản và phổ biến để thu khí CO2 trong phòng thí nghiệm.
- Chuẩn bị: Chuẩn bị một bình tam giác chứa dung dịch Na2CO3, một ống nghiệm chứa dung dịch HCl, một ống dẫn khí, một chậu nước và một ống thu khí.
- Thực hiện phản ứng: Nhỏ từ từ HCl vào Na2CO3, khí CO2 sinh ra sẽ theo ống dẫn khí vào ống thu khí đã được úp ngược trong chậu nước.
- Thu khí: Khí CO2 sẽ đẩy nước ra khỏi ống thu khí, và ta thu được khí CO2 trong ống.
7.2. Phương Pháp Đẩy Không Khí
Phương pháp đẩy không khí được sử dụng để thu khí CO2 khi không muốn khí CO2 bị lẫn hơi nước.
- Chuẩn bị: Chuẩn bị một bình tam giác chứa dung dịch Na2CO3, một ống nghiệm chứa dung dịch HCl, một ống dẫn khí và một bình thu khí khô.
- Thực hiện phản ứng: Nhỏ từ từ HCl vào Na2CO3, khí CO2 sinh ra sẽ theo ống dẫn khí vào bình thu khí.
- Thu khí: Vì CO2 nặng hơn không khí, nó sẽ đẩy không khí ra khỏi bình từ phía trên, và ta thu được khí CO2 trong bình.
7.3. Sử Dụng Thiết Bị Chuyên Dụng
Trong công nghiệp, khí CO2 thường được thu bằng các thiết bị chuyên dụng, chẳng hạn như tháp hấp thụ hoặc màng lọc khí. Các thiết bị này cho phép thu khí CO2 với độ tinh khiết cao và hiệu suất lớn.
8. Phản Ứng Giữa HCl Và Na2CO3 Có Tạo Ra Nhiệt Không?
Phản ứng giữa HCl và Na2CO3 là một phản ứng tỏa nhiệt, có nghĩa là nó giải phóng nhiệt ra môi trường xung quanh.
8.1. Phản Ứng Tỏa Nhiệt Là Gì?
Phản ứng tỏa nhiệt là phản ứng hóa học giải phóng năng lượng dưới dạng nhiệt. Trong phản ứng tỏa nhiệt, năng lượng liên kết của các sản phẩm thấp hơn năng lượng liên kết của các chất phản ứng, và sự chênh lệch năng lượng này được giải phóng ra dưới dạng nhiệt.
8.2. Đo Nhiệt Lượng Của Phản Ứng
Để xác định nhiệt lượng tỏa ra trong phản ứng giữa HCl và Na2CO3, ta có thể sử dụng một nhiệt lượng kế.
- Chuẩn bị: Chuẩn bị một nhiệt lượng kế, dung dịch HCl và dung dịch Na2CO3.
- Thực hiện phản ứng: Cho dung dịch HCl vào nhiệt lượng kế chứa dung dịch Na2CO3 và đo sự thay đổi nhiệt độ của dung dịch.
- Tính toán: Sử dụng công thức Q = mcΔT để tính nhiệt lượng tỏa ra, trong đó Q là nhiệt lượng, m là khối lượng của dung dịch, c là nhiệt dung riêng của dung dịch và ΔT là độ thay đổi nhiệt độ.
8.3. Ứng Dụng Của Phản Ứng Tỏa Nhiệt
Phản ứng tỏa nhiệt được ứng dụng trong nhiều lĩnh vực, chẳng hạn như sản xuất điện, sưởi ấm và làm mát. Trong công nghiệp, phản ứng tỏa nhiệt được sử dụng để cung cấp năng lượng cho các quy trình sản xuất khác.
9. Điều Gì Xảy Ra Nếu Cho Từ Từ Na2CO3 Vào HCl?
Nếu cho từ từ Na2CO3 vào HCl, hiện tượng sủi bọt khí vẫn xảy ra, nhưng có một số khác biệt so với việc cho từ từ HCl vào Na2CO3.
9.1. Tốc Độ Phản Ứng
Khi cho từ từ Na2CO3 vào HCl, nồng độ HCl tại chỗ cao hơn so với khi cho từ từ HCl vào Na2CO3. Điều này dẫn đến tốc độ phản ứng nhanh hơn ngay từ đầu, và có thể gây ra hiện tượng sủi bọt mạnh hơn.
9.2. Thứ Tự Phản Ứng
Khi Na2CO3 được thêm từ từ vào HCl, phản ứng xảy ra gần như đồng thời, tạo ra cả NaHCO3 và CO2 cùng một lúc. Điều này khác với khi cho từ từ HCl vào Na2CO3, khi HCl ưu tiên phản ứng với Na2CO3 trước khi phản ứng với NaHCO3.
9.3. Kiểm Soát Phản Ứng
Việc cho từ từ Na2CO3 vào HCl có thể khó kiểm soát hơn so với việc cho từ từ HCl vào Na2CO3, do tốc độ phản ứng nhanh hơn và nguy cơ tạo bọt quá nhiều cao hơn.
9.4. Ứng Dụng
Trong một số ứng dụng, việc cho từ từ Na2CO3 vào HCl có thể được ưu tiên hơn để tạo ra một lượng lớn khí CO2 trong thời gian ngắn. Tuy nhiên, cần cẩn thận để kiểm soát phản ứng và tránh gây nguy hiểm.
10. Tại Sao Cần Nhỏ Từ Từ HCl Vào Na2CO3 Thay Vì Đổ Nhanh?
Việc nhỏ từ từ HCl vào Na2CO3 thay vì đổ nhanh có nhiều lợi ích quan trọng, bao gồm kiểm soát phản ứng, tránh tạo bọt quá nhiều và đảm bảo an toàn.
10.1. Kiểm Soát Phản Ứng
Khi nhỏ từ từ HCl, ta có thể kiểm soát tốc độ phản ứng và lượng khí CO2 tạo thành. Điều này giúp tránh phản ứng xảy ra quá nhanh, có thể gây tràn dung dịch hoặc tạo ra các sản phẩm phụ không mong muốn.
10.2. Tránh Tạo Bọt Quá Nhiều
Phản ứng giữa HCl và Na2CO3 tạo ra khí CO2, gây ra hiện tượng sủi bọt. Nếu đổ nhanh HCl, lượng khí CO2 tạo ra lớn và nhanh chóng, có thể gây tràn bọt ra khỏi bình phản ứng. Việc nhỏ từ từ HCl giúp kiểm soát lượng khí CO2 tạo ra, giảm thiểu nguy cơ tràn bọt.
10.3. Đảm Bảo An Toàn
Việc nhỏ từ từ HCl giúp đảm bảo an toàn cho người thực hiện thí nghiệm. Phản ứng xảy ra từ từ giúp tránh các tai nạn như tràn hóa chất, bắn hóa chất vào mắt hoặc da.
10.4. Thu Khí CO2 Hiệu Quả
Khi nhỏ từ từ HCl, khí CO2 tạo ra đều đặn và dễ dàng thu gom hơn. Điều này đặc biệt quan trọng nếu ta muốn thu khí CO2 để sử dụng trong các thí nghiệm hoặc ứng dụng khác.
10.5. Tối Ưu Hóa Hiệu Suất Phản Ứng
Việc nhỏ từ từ HCl giúp các chất phản ứng tiếp xúc tốt với nhau, tạo điều kiện cho phản ứng xảy ra hoàn toàn và tối ưu hóa hiệu suất phản ứng.
Phản ứng giữa HCl và Na2CO3 là một phản ứng hóa học thú vị và có nhiều ứng dụng quan trọng trong các lĩnh vực khác nhau. Việc hiểu rõ cơ chế phản ứng, hiện tượng quan sát được, các yếu tố ảnh hưởng và các lưu ý quan trọng sẽ giúp chúng ta thực hiện phản ứng một cách an toàn, hiệu quả và thành công.
Bạn đang tìm kiếm thông tin chi tiết và đáng tin cậy về xe tải ở Mỹ Đình? Hãy truy cập ngay XETAIMYDINH.EDU.VN để được tư vấn và giải đáp mọi thắc mắc! Xe Tải Mỹ Đình luôn sẵn sàng đồng hành cùng bạn trên mọi nẻo đường.
FAQ Về Phản Ứng Giữa HCl Và Na2CO3
1. Phản ứng giữa HCl và Na2CO3 là phản ứng gì?
Phản ứng giữa HCl và Na2CO3 là phản ứng trung hòa, trong đó axit HCl phản ứng với bazơ Na2CO3 tạo thành muối NaCl, nước và khí CO2.
2. Hiện tượng gì xảy ra khi cho HCl vào Na2CO3?
Hiện tượng quan sát được là sủi bọt khí không màu, không mùi.
3. Khí thoát ra trong phản ứng là khí gì?
Khí thoát ra là khí CO2 (cacbon đioxit).
4. Phương trình hóa học của phản ứng là gì?
Na2CO3(dung dịch) + 2HCl(dung dịch) → 2NaCl(dung dịch) + H2O(lỏng) + CO2(khí)
5. Tại sao cần nhỏ từ từ HCl vào Na2CO3?
Để kiểm soát phản ứng, tránh tạo bọt quá nhiều và đảm bảo an toàn.
6. Phản ứng này có tỏa nhiệt không?
Có, phản ứng giữa HCl và Na2CO3 là phản ứng tỏa nhiệt.
7. Phản ứng này có tuân theo định luật bảo toàn khối lượng không?
Có, phản ứng tuân theo định luật bảo toàn khối lượng.
8. Làm thế nào để thu khí CO2 từ phản ứng này?
Có thể thu khí CO2 bằng phương pháp đẩy nước hoặc đẩy không khí.
9. Ứng dụng của phản ứng này trong thực tế là gì?
Điều chế khí CO2 trong phòng thí nghiệm, sản xuất hóa chất, xử lý nước và làm sạch.
10. Điều gì xảy ra nếu thay đổi nồng độ HCl hoặc Na2CO3?
Thay đổi nồng độ sẽ ảnh hưởng đến tốc độ phản ứng và lượng khí CO2 tạo thành. Nồng độ cao hơn làm tăng tốc độ phản ứng, nhưng cần kiểm soát để tránh nguy hiểm.