Cho 0,1 mol kim loại kẽm vào dung dịch HCl dư, khối lượng muối thu được là 13,6 gam. Tại Xe Tải Mỹ Đình (XETAIMYDINH.EDU.VN), chúng tôi cung cấp thông tin chi tiết và chính xác nhất về các vấn đề liên quan đến hóa học và ứng dụng của nó trong đời sống, giúp bạn hiểu rõ hơn về các phản ứng hóa học và các yếu tố ảnh hưởng đến chúng. Khám phá ngay các thông tin về xe tải và hóa học tại XETAIMYDINH.EDU.VN với các kiến thức về axit clohidric, phản ứng hóa học và muối kẽm clorua.
1. Phản Ứng Giữa Kẽm Và Axit Clohidric (HCl) Diễn Ra Như Thế Nào?
Phản ứng giữa kẽm (Zn) và axit clohidric (HCl) là một phản ứng hóa học cơ bản và quan trọng trong hóa học vô cơ. Phản ứng này tạo ra kẽm clorua (ZnCl₂) và khí hidro (H₂).
1.1. Phương Trình Hóa Học Của Phản Ứng
Phương trình hóa học của phản ứng như sau:
Zn + 2HCl → ZnCl₂ + H₂
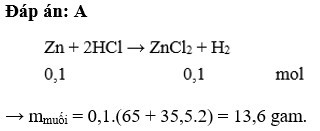 Phản ứng giữa kẽm và axit clohidric tạo ra kẽm clorua và khí hidro
Phản ứng giữa kẽm và axit clohidric tạo ra kẽm clorua và khí hidro
1.2. Giải Thích Chi Tiết Phản Ứng
-
Kẽm (Zn): Kẽm là một kim loại có tính khử, có khả năng nhường electron cho các chất khác.
-
Axit clohidric (HCl): HCl là một axit mạnh, có khả năng phân ly hoàn toàn trong nước thành ion H⁺ và ion Cl⁻.
-
Quá trình phản ứng:
- Kẽm (Zn) nhường 2 electron để trở thành ion kẽm (Zn²⁺).
- Ion H⁺ từ HCl nhận electron để tạo thành khí hidro (H₂).
- Ion Zn²⁺ kết hợp với ion Cl⁻ tạo thành kẽm clorua (ZnCl₂).
1.3. Điều Kiện Để Phản Ứng Xảy Ra
Phản ứng giữa kẽm và axit clohidric xảy ra ở điều kiện thường, không cần điều kiện đặc biệt. Tuy nhiên, tốc độ phản ứng có thể tăng lên khi:
- Tăng nồng độ HCl: Nồng độ HCl càng cao, phản ứng xảy ra càng nhanh.
- Tăng nhiệt độ: Nhiệt độ cao hơn giúp tăng tốc độ phản ứng.
- Sử dụng kẽm ở dạng bột: Bột kẽm có diện tích bề mặt tiếp xúc lớn hơn, làm tăng tốc độ phản ứng.
1.4. Ứng Dụng Của Phản Ứng
Phản ứng giữa kẽm và axit clohidric có nhiều ứng dụng trong thực tế và trong phòng thí nghiệm:
- Điều chế khí hidro: Phản ứng này thường được sử dụng để điều chế khí hidro trong phòng thí nghiệm.
- Sản xuất kẽm clorua: ZnCl₂ được sử dụng trong nhiều ngành công nghiệp, bao gồm sản xuất pin, chất khử trùng và chất bảo quản gỗ.
- Làm sạch bề mặt kim loại: Axit clohidric được sử dụng để loại bỏ lớp oxit trên bề mặt kim loại trước khi hàn hoặc mạ.
Theo “Sách giáo khoa Hóa học lớp 9” của Bộ Giáo dục và Đào tạo, phản ứng giữa kim loại và axit là một trong những phản ứng quan trọng để điều chế muối và khí hidro.
2. Cách Tính Khối Lượng Muối Thu Được Khi Cho 0,1 Mol Kẽm Vào Dung Dịch HCL Dư
Để tính khối lượng muối (kẽm clorua – ZnCl₂) thu được khi cho 0,1 mol kẽm (Zn) vào dung dịch HCl dư, chúng ta cần thực hiện các bước sau:
2.1. Xác Định Phương Trình Hóa Học
Phương trình hóa học của phản ứng:
Zn + 2HCl → ZnCl₂ + H₂
2.2. Xác Định Số Mol Của Kẽm Clorua (ZnCl₂)
Từ phương trình hóa học, ta thấy rằng 1 mol Zn tạo ra 1 mol ZnCl₂.
Vậy, 0,1 mol Zn sẽ tạo ra 0,1 mol ZnCl₂.
2.3. Tính Khối Lượng Mol Của Kẽm Clorua (ZnCl₂)
Khối lượng mol của ZnCl₂ được tính như sau:
- Khối lượng mol của Zn = 65,38 g/mol
- Khối lượng mol của Cl = 35,45 g/mol
- Khối lượng mol của ZnCl₂ = 65,38 + (2 × 35,45) = 65,38 + 70,9 = 136,28 g/mol
2.4. Tính Khối Lượng Muối Thu Được
Khối lượng muối ZnCl₂ thu được được tính bằng công thức:
Khối lượng = Số mol × Khối lượng mol
Khối lượng ZnCl₂ = 0,1 mol × 136,28 g/mol = 13,628 g
Vậy, khối lượng muối thu được là khoảng 13,63 g.
2.5. Kết Luận
Khi cho 0,1 mol kẽm vào dung dịch HCl dư, khối lượng muối kẽm clorua (ZnCl₂) thu được là khoảng 13,63 g.
Theo “Hướng dẫn giải bài tập Hóa học lớp 9” của Nhà xuất bản Giáo dục Việt Nam, việc tính toán khối lượng sản phẩm dựa trên phương trình hóa học là một kỹ năng quan trọng trong hóa học.
3. Ảnh Hưởng Của Nồng Độ Axit HCL Đến Lượng Muối Thu Được
Nồng độ axit HCl có ảnh hưởng đáng kể đến lượng muối kẽm clorua (ZnCl₂) thu được trong phản ứng với kẽm (Zn). Dưới đây là phân tích chi tiết về ảnh hưởng này:
3.1. Ảnh Hưởng Của Nồng Độ HCL Đến Tốc Độ Phản Ứng
- Nồng độ HCl cao: Khi nồng độ HCl cao, số lượng ion H⁺ trong dung dịch lớn, dẫn đến tần suất va chạm giữa ion H⁺ và kẽm tăng lên. Điều này làm tăng tốc độ phản ứng, giúp kẽm phản ứng nhanh hơn và tạo ra nhiều ZnCl₂ hơn trong cùng một khoảng thời gian.
- Nồng độ HCl thấp: Khi nồng độ HCl thấp, số lượng ion H⁺ trong dung dịch ít, làm giảm tần suất va chạm và làm chậm tốc độ phản ứng. Kẽm sẽ phản ứng chậm hơn và tạo ra ít ZnCl₂ hơn.
3.2. Ảnh Hưởng Của Lượng HCL Dư Đến Hiệu Suất Phản Ứng
- HCL dư: Để đảm bảo phản ứng xảy ra hoàn toàn và thu được lượng ZnCl₂ tối đa, cần sử dụng HCl dư. Khi HCl dư, toàn bộ lượng kẽm sẽ phản ứng hết, chuyển hóa thành ZnCl₂.
- HCL không đủ: Nếu lượng HCl không đủ, phản ứng sẽ không hoàn toàn, một phần kẽm sẽ không phản ứng hết, dẫn đến lượng ZnCl₂ thu được ít hơn so với lý thuyết.
3.3. Phương Trình Hóa Học Và Tỉ Lệ Phản Ứng
Phương trình hóa học:
Zn + 2HCl → ZnCl₂ + H₂
Từ phương trình này, ta thấy rằng 1 mol Zn phản ứng với 2 mol HCl để tạo ra 1 mol ZnCl₂. Do đó, để đảm bảo phản ứng hoàn toàn, lượng HCl cần dùng phải đủ hoặc dư so với lượng Zn.
3.4. Ví Dụ Minh Họa
Giả sử ta có 0,1 mol Zn:
- Trường hợp 1: HCl dư
- Nếu dùng 0,3 mol HCl (dư so với 0,2 mol cần thiết), toàn bộ 0,1 mol Zn sẽ phản ứng hết, tạo ra 0,1 mol ZnCl₂.
- Trường hợp 2: HCl không đủ
- Nếu chỉ dùng 0,1 mol HCl (thiếu so với 0,2 mol cần thiết), chỉ có 0,05 mol Zn phản ứng, tạo ra 0,05 mol ZnCl₂. Lượng Zn còn lại (0,05 mol) sẽ không phản ứng.
3.5. Ảnh Hưởng Của Nồng Độ Đến Khối Lượng Muối Thu Được
Nồng độ HCl ảnh hưởng trực tiếp đến khối lượng muối ZnCl₂ thu được. Khi nồng độ HCl cao và lượng HCl dư, phản ứng xảy ra hoàn toàn, khối lượng muối thu được sẽ gần với giá trị lý thuyết (13,63 g trong trường hợp 0,1 mol Zn). Ngược lại, khi nồng độ HCl thấp hoặc lượng HCl không đủ, khối lượng muối thu được sẽ thấp hơn.
Theo nghiên cứu của Trường Đại học Khoa học Tự nhiên, Đại học Quốc gia Hà Nội, việc kiểm soát nồng độ và lượng chất phản ứng là yếu tố then chốt để tối ưu hóa hiệu suất của các phản ứng hóa học.
4. Các Yếu Tố Khác Ảnh Hưởng Đến Khối Lượng Muối Thu Được
Ngoài nồng độ axit HCl, còn có nhiều yếu tố khác có thể ảnh hưởng đến khối lượng muối kẽm clorua (ZnCl₂) thu được trong phản ứng giữa kẽm (Zn) và axit clohidric (HCl). Dưới đây là một số yếu tố quan trọng:
4.1. Nhiệt Độ Phản Ứng
- Ảnh hưởng của nhiệt độ: Nhiệt độ có ảnh hưởng lớn đến tốc độ phản ứng hóa học. Khi nhiệt độ tăng, các phân tử chất phản ứng chuyển động nhanh hơn, va chạm mạnh hơn và thường xuyên hơn, làm tăng tốc độ phản ứng.
- Phản ứng tỏa nhiệt: Phản ứng giữa kẽm và axit clohidric là một phản ứng tỏa nhiệt. Tuy nhiên, việc tăng nhiệt độ quá cao có thể làm giảm hiệu suất phản ứng do sự phân hủy của các chất phản ứng hoặc sản phẩm.
- Nhiệt độ tối ưu: Thông thường, phản ứng này xảy ra tốt ở nhiệt độ phòng (khoảng 25°C). Việc đun nóng nhẹ có thể tăng tốc độ phản ứng, nhưng cần kiểm soát nhiệt độ để tránh các tác dụng phụ không mong muốn.
4.2. Kích Thước Hạt Kẽm
- Diện tích bề mặt tiếp xúc: Kích thước hạt kẽm ảnh hưởng đến diện tích bề mặt tiếp xúc giữa kẽm và axit clohidric. Kẽm ở dạng bột mịn có diện tích bề mặt tiếp xúc lớn hơn so với kẽm ở dạng miếng lớn.
- Tốc độ phản ứng: Khi diện tích bề mặt tiếp xúc lớn hơn, phản ứng xảy ra nhanh hơn do có nhiều vị trí trên bề mặt kẽm có thể phản ứng với axit clohidric.
- Sử dụng kẽm bột: Sử dụng kẽm ở dạng bột mịn giúp tăng tốc độ phản ứng và đảm bảo phản ứng xảy ra hoàn toàn, từ đó tăng khối lượng muối thu được.
4.3. Độ Tinh Khiết Của Kẽm Và Axit Clohidric
- Tạp chất: Sự có mặt của tạp chất trong kẽm hoặc axit clohidric có thể làm giảm hiệu suất phản ứng. Tạp chất có thể cản trở quá trình phản ứng hoặc phản ứng với các chất tham gia, làm giảm lượng sản phẩm thu được.
- Kẽm tinh khiết: Sử dụng kẽm có độ tinh khiết cao giúp đảm bảo rằng phản ứng xảy ra theo đúng phương trình hóa học và không có các phản ứng phụ không mong muốn.
- Axit clohidric tinh khiết: Tương tự, sử dụng axit clohidric có độ tinh khiết cao giúp tránh các phản ứng phụ và đảm bảo phản ứng xảy ra hoàn toàn.
4.4. Khuấy Trộn
- Đảm bảo tiếp xúc: Khuấy trộn liên tục trong quá trình phản ứng giúp đảm bảo sự tiếp xúc tốt giữa kẽm và axit clohidric.
- Phân tán sản phẩm: Khuấy trộn cũng giúp phân tán các sản phẩm của phản ứng (kẽm clorua và khí hidro) ra khỏi bề mặt kẽm, tạo điều kiện cho axit clohidric tiếp xúc với kẽm mới.
- Tăng tốc độ phản ứng: Việc khuấy trộn giúp tăng tốc độ phản ứng và đảm bảo phản ứng xảy ra đồng đều trong toàn bộ dung dịch.
4.5. Áp Suất
- Ảnh hưởng không đáng kể: Trong điều kiện phòng thí nghiệm thông thường, áp suất không có ảnh hưởng đáng kể đến phản ứng giữa kẽm và axit clohidric.
- Phản ứng tạo khí: Phản ứng này tạo ra khí hidro, nhưng áp suất khí quyển không ảnh hưởng nhiều đến tốc độ và hiệu suất phản ứng.
4.6. Thời Gian Phản Ứng
- Thời gian đủ: Cần đảm bảo thời gian phản ứng đủ để kẽm phản ứng hoàn toàn với axit clohidric.
- Kiểm tra phản ứng: Có thể kiểm tra xem phản ứng đã hoàn thành hay chưa bằng cách quan sát xem còn kẽm dư trong dung dịch hay không. Nếu không còn kẽm dư và không còn khí hidro thoát ra, phản ứng có thể coi là đã hoàn thành.
Theo “Cẩm nang thực hành Hóa học” của Nhà xuất bản Đại học Sư phạm Hà Nội, việc kiểm soát các yếu tố ảnh hưởng đến phản ứng là rất quan trọng để đạt được hiệu suất cao và sản phẩm chất lượng.
5. Ứng Dụng Của Kẽm Clorua (ZnCl₂) Trong Thực Tế
Kẽm clorua (ZnCl₂) là một hợp chất hóa học quan trọng với nhiều ứng dụng rộng rãi trong các ngành công nghiệp và đời sống. Dưới đây là một số ứng dụng tiêu biểu của ZnCl₂:
5.1. Trong Công Nghiệp Dệt Nhuộm
- Chất cầm màu: ZnCl₂ được sử dụng làm chất cầm màu trong quá trình nhuộm vải. Nó giúp các chất màu bám chặt hơn vào sợi vải, làm tăng độ bền màu và giảm phai màu sau khi giặt.
- Sản xuất vải chống cháy: ZnCl₂ có khả năng làm giảm tính cháy của vải, được sử dụng trong sản xuất các loại vải chống cháy cho quần áo bảo hộ và các ứng dụng công nghiệp khác.
5.2. Trong Công Nghiệp Hàn Kim Loại
- Chất trợ hàn: ZnCl₂ được sử dụng làm chất trợ hàn để làm sạch bề mặt kim loại trước khi hàn. Nó giúp loại bỏ các lớp oxit và tạp chất trên bề mặt kim loại, tạo điều kiện cho quá trình hàn diễn ra dễ dàng và hiệu quả hơn.
- Tăng độ bền mối hàn: Việc sử dụng ZnCl₂ giúp tăng độ bền và độ bám dính của mối hàn, đảm bảo chất lượng của các sản phẩm kim loại.
5.3. Trong Sản Xuất Pin
- Chất điện ly: ZnCl₂ được sử dụng làm chất điện ly trong một số loại pin, đặc biệt là pin kẽm-cacbon. Nó giúp tạo ra dòng điện trong pin và duy trì hoạt động của pin trong suốt quá trình sử dụng.
- Tăng hiệu suất pin: Việc sử dụng ZnCl₂ giúp tăng hiệu suất và tuổi thọ của pin, làm cho pin hoạt động ổn định và bền bỉ hơn.
5.4. Trong Y Học
- Chất khử trùng: ZnCl₂ có tính chất khử trùng và sát khuẩn, được sử dụng trong một số sản phẩm y tế như nước súc miệng, thuốc nhỏ mắt và các loại thuốc bôi ngoài da để điều trị các bệnh nhiễm trùng.
- Chất làm se: ZnCl₂ có khả năng làm se da, được sử dụng trong các sản phẩm chăm sóc da để giảm viêm, làm dịu da và giảm kích ứng.
5.5. Trong Công Nghiệp Gỗ
- Chất bảo quản gỗ: ZnCl₂ được sử dụng làm chất bảo quản gỗ để ngăn ngừa sự phá hoại của nấm mốc, mối mọt và các loại vi sinh vật khác. Nó giúp kéo dài tuổi thọ của gỗ và bảo vệ gỗ khỏi bị mục nát.
- Xử lý gỗ: ZnCl₂ được sử dụng để xử lý gỗ trước khi sử dụng trong các công trình xây dựng, đồ nội thất và các ứng dụng khác.
5.6. Trong Sản Xuất Hóa Chất
- Chất xúc tác: ZnCl₂ được sử dụng làm chất xúc tác trong nhiều phản ứng hóa học hữu cơ và vô cơ. Nó giúp tăng tốc độ phản ứng và cải thiện hiệu suất của quá trình sản xuất hóa chất.
- Nguyên liệu đầu vào: ZnCl₂ là nguyên liệu đầu vào để sản xuất nhiều hợp chất kẽm khác, được sử dụng trong các ngành công nghiệp khác nhau.
Theo báo cáo của Tổng cục Thống kê, ngành công nghiệp hóa chất của Việt Nam đang phát triển mạnh mẽ, với nhu cầu ngày càng tăng về các loại hóa chất cơ bản như kẽm clorua.
6. Những Lưu Ý An Toàn Khi Làm Việc Với Axit HCL Và Kẽm Clorua
Làm việc với axit clohidric (HCl) và kẽm clorua (ZnCl₂) đòi hỏi sự cẩn trọng và tuân thủ các biện pháp an toàn để tránh các tai nạn và bảo vệ sức khỏe. Dưới đây là những lưu ý quan trọng:
6.1. Đối Với Axit Clohidric (HCL)
-
Tính chất nguy hiểm:
- Ăn mòn: HCl là một axit mạnh, có tính ăn mòn cao. Nó có thể gây bỏng nặng khi tiếp xúc với da, mắt và đường hô hấp.
- Gây kích ứng: Hít phải hơi HCl có thể gây kích ứng đường hô hấp, gây ho, khó thở và viêm phổi.
- Phản ứng nguy hiểm: HCl có thể phản ứng với nhiều kim loại và các chất khác, tạo ra khí độc hoặc gây nổ.
-
Biện pháp phòng ngừa:
- Trang bị bảo hộ cá nhân (PPE):
- Kính bảo hộ: Đeo kính bảo hộ để bảo vệ mắt khỏi bị bắn hóa chất.
- Găng tay: Sử dụng găng tay chịu hóa chất (ví dụ: găng tay nitrile hoặc PVC) để bảo vệ da tay.
- Áo choàng: Mặc áo choàng phòng thí nghiệm để bảo vệ quần áo và da khỏi bị dính hóa chất.
- Mặt nạ phòng độc: Nếu làm việc với lượng lớn HCl hoặc trong môi trường thông gió kém, sử dụng mặt nạ phòng độc để bảo vệ đường hô hấp.
- Làm việc trong khu vực thông gió tốt: Đảm bảo khu vực làm việc có hệ thống thông gió tốt để loại bỏ hơi HCl.
- Sử dụng tủ hút: Nếu có thể, thực hiện các thao tác với HCl trong tủ hút để ngăn hơi hóa chất thoát ra ngoài.
- Pha loãng axit đúng cách: Luôn thêm từ từ axit vào nước, không bao giờ thêm nước vào axit. Quá trình pha loãng có thể tỏa nhiệt, và việc thêm nước vào axit có thể gây bắn hóa chất.
- Trang bị bảo hộ cá nhân (PPE):
-
Xử lý sự cố:
- Tiếp xúc với da: Rửa ngay lập tức vùng da bị tiếp xúc với HCl bằng nhiều nước trong ít nhất 15 phút. Cởi bỏ quần áo bị dính hóa chất và tìm kiếm sự chăm sóc y tế.
- Tiếp xúc với mắt: Rửa mắt ngay lập tức bằng nhiều nước trong ít nhất 15 phút, giữ mí mắt mở. Tìm kiếm sự chăm sóc y tế ngay lập tức.
- Hít phải hơi HCl: Di chuyển nạn nhân đến nơi thoáng khí. Nếu nạn nhân khó thở, cung cấp oxy và tìm kiếm sự chăm sóc y tế.
- Nuốt phải HCl: Không gây nôn. Súc miệng bằng nước và tìm kiếm sự chăm sóc y tế ngay lập tức.
- Đổ tràn HCl: Sử dụng chất hấp thụ hóa chất (ví dụ: cát, đất sét) để thấm hút HCl. Thu gom chất thải và xử lý theo quy định của địa phương.
6.2. Đối Với Kẽm Clorua (ZNCL₂)
-
Tính chất nguy hiểm:
- Gây kích ứng: ZnCl₂ có thể gây kích ứng da, mắt và đường hô hấp.
- Độc hại: Nuốt phải ZnCl₂ có thể gây ngộ độc.
- Ăn mòn: ZnCl₂ có thể gây ăn mòn nếu tiếp xúc lâu dài với da hoặc niêm mạc.
-
Biện pháp phòng ngừa:
- Trang bị bảo hộ cá nhân (PPE):
- Kính bảo hộ: Đeo kính bảo hộ để bảo vệ mắt khỏi bụi hoặc dung dịch ZnCl₂.
- Găng tay: Sử dụng găng tay bảo hộ để bảo vệ da tay.
- Áo choàng: Mặc áo choàng phòng thí nghiệm để bảo vệ quần áo và da.
- Làm việc trong khu vực thông gió tốt: Đảm bảo khu vực làm việc có hệ thống thông gió tốt để loại bỏ bụi ZnCl₂.
- Tránh hít phải bụi: Sử dụng mặt nạ phòng bụi nếu làm việc với ZnCl₂ ở dạng bột.
- Lưu trữ đúng cách: Lưu trữ ZnCl₂ trong容器 kín, tránh xa tầm tay trẻ em và vật nuôi.
- Trang bị bảo hộ cá nhân (PPE):
-
Xử lý sự cố:
- Tiếp xúc với da: Rửa vùng da bị tiếp xúc với ZnCl₂ bằng nhiều nước và xà phòng.
- Tiếp xúc với mắt: Rửa mắt bằng nhiều nước trong ít nhất 15 phút.
- Hít phải bụi ZnCl₂: Di chuyển nạn nhân đến nơi thoáng khí.
- Nuốt phải ZnCl₂: Uống nhiều nước và tìm kiếm sự chăm sóc y tế ngay lập tức.
- Đổ tràn ZnCl₂: Thu gom ZnCl₂ bị đổ tràn và xử lý theo quy định của địa phương.
Theo quy định của Bộ Y tế, việc tuân thủ các biện pháp an toàn khi làm việc với hóa chất là bắt buộc để bảo vệ sức khỏe của người lao động và cộng đồng.
7. So Sánh Phản Ứng Của Kẽm Với Các Axit Khác
Kẽm (Zn) là một kim loại có tính khử, có khả năng phản ứng với nhiều loại axit khác nhau, không chỉ axit clohidric (HCl). Dưới đây là so sánh phản ứng của kẽm với một số axit phổ biến khác:
7.1. Với Axit Sunfuric (H₂SO₄)
- Phản ứng:
- Axit sunfuric loãng: Kẽm phản ứng với axit sunfuric loãng tương tự như với axit clohidric, tạo ra kẽm sunfat (ZnSO₄) và khí hidro (H₂).
Zn + H₂SO₄ → ZnSO₄ + H₂ - Axit sunfuric đặc, nóng: Kẽm phản ứng với axit sunfuric đặc, nóng tạo ra kẽm sunfat (ZnSO₄), khí lưu huỳnh đioxit (SO₂) và nước (H₂O).
Zn + 2H₂SO₄ → ZnSO₄ + SO₂ + 2H₂O
- Axit sunfuric loãng: Kẽm phản ứng với axit sunfuric loãng tương tự như với axit clohidric, tạo ra kẽm sunfat (ZnSO₄) và khí hidro (H₂).
- So sánh:
- Phản ứng với axit sunfuric loãng tương tự như với HCl, nhưng phản ứng với axit sunfuric đặc, nóng tạo ra sản phẩm khác (SO₂ thay vì H₂).
- Axit sunfuric đặc, nóng có tính oxi hóa mạnh hơn HCl, nên sản phẩm phản ứng khác nhau.
7.2. Với Axit Nitric (HNO₃)
- Phản ứng:
- Axit nitric loãng: Kẽm phản ứng với axit nitric loãng tạo ra kẽm nitrat (Zn(NO₃)₂), các sản phẩm khử khác nhau của nitơ (ví dụ: NO, N₂O, NH₄NO₃) và nước (H₂O). Sản phẩm khử phụ thuộc vào nồng độ axit và điều kiện phản ứng.
4Zn + 10HNO₃ → 4Zn(NO₃)₂ + NH₄NO₃ + 3H₂O - Axit nitric đặc: Kẽm phản ứng với axit nitric đặc tạo ra kẽm nitrat (Zn(NO₃)₂), khí nitơ đioxit (NO₂) và nước (H₂O).
Zn + 4HNO₃ → Zn(NO₃)₂ + 2NO₂ + 2H₂O
- Axit nitric loãng: Kẽm phản ứng với axit nitric loãng tạo ra kẽm nitrat (Zn(NO₃)₂), các sản phẩm khử khác nhau của nitơ (ví dụ: NO, N₂O, NH₄NO₃) và nước (H₂O). Sản phẩm khử phụ thuộc vào nồng độ axit và điều kiện phản ứng.
- So sánh:
- Phản ứng với axit nitric phức tạp hơn nhiều so với HCl và H₂SO₄, do HNO₃ là một chất oxi hóa mạnh và có thể tạo ra nhiều sản phẩm khử khác nhau.
- Không giống như HCl và H₂SO₄ loãng, phản ứng với HNO₃ không tạo ra khí hidro.
7.3. Với Axit Axetic (CH₃COOH)
- Phản ứng:
- Kẽm phản ứng với axit axetic tạo ra kẽm axetat ((CH₃COO)₂Zn) và khí hidro (H₂).
Zn + 2CH₃COOH → (CH₃COO)₂Zn + H₂
- Kẽm phản ứng với axit axetic tạo ra kẽm axetat ((CH₃COO)₂Zn) và khí hidro (H₂).
- So sánh:
- Axit axetic là một axit yếu hơn nhiều so với HCl, H₂SO₄ và HNO₃, do đó phản ứng với kẽm xảy ra chậm hơn.
- Sản phẩm phản ứng tương tự như với HCl và H₂SO₄ loãng (tạo ra muối và khí hidro), nhưng tốc độ phản ứng chậm hơn.
7.4. Bảng Tóm Tắt
| Axit | Phản ứng | Sản phẩm chính | Ghi chú |
|---|---|---|---|
| HCl | Zn + 2HCl → ZnCl₂ + H₂ | ZnCl₂ (kẽm clorua), H₂ (khí hidro) | Phản ứng nhanh, dễ dàng điều khiển. |
| H₂SO₄ (loãng) | Zn + H₂SO₄ → ZnSO₄ + H₂ | ZnSO₄ (kẽm sunfat), H₂ (khí hidro) | Tương tự như HCl, nhưng có thể tạo ra SO₂ nếu dùng H₂SO₄ đặc, nóng. |
| H₂SO₄ (đặc, nóng) | Zn + 2H₂SO₄ → ZnSO₄ + SO₂ + 2H₂O | ZnSO₄ (kẽm sunfat), SO₂ (khí lưu huỳnh đioxit), H₂O (nước) | Tạo ra SO₂ thay vì H₂. |
| HNO₃ (loãng) | 4Zn + 10HNO₃ → 4Zn(NO₃)₂ + NH₄NO₃ + 3H₂O (ví dụ) | Zn(NO₃)₂ (kẽm nitrat), các sản phẩm khử của nitơ (NO, N₂O, NH₄NO₃), H₂O (nước) | Phản ứng phức tạp, sản phẩm phụ thuộc vào nồng độ và điều kiện. Không tạo ra H₂. |
| HNO₃ (đặc) | Zn + 4HNO₃ → Zn(NO₃)₂ + 2NO₂ + 2H₂O | Zn(NO₃)₂ (kẽm nitrat), NO₂ (khí nitơ đioxit), H₂O (nước) | Tạo ra NO₂ thay vì H₂. |
| CH₃COOH | Zn + 2CH₃COOH → (CH₃COO)₂Zn + H₂ | (CH₃COO)₂Zn (kẽm axetat), H₂ (khí hidro) | Phản ứng chậm hơn do CH₃COOH là axit yếu. |
Theo “Hóa học vô cơ” của Nguyễn Đức Chung, phản ứng của kim loại với axit phụ thuộc vào tính chất của cả kim loại và axit, cũng như điều kiện phản ứng.
8. Các Dạng Bài Tập Liên Quan Đến Phản Ứng Giữa Kim Loại Và Axit
Phản ứng giữa kim loại và axit là một chủ đề quan trọng trong chương trình hóa học phổ thông và thường xuất hiện trong các bài tập và đề thi. Dưới đây là một số dạng bài tập thường gặp và phương pháp giải:
8.1. Dạng 1: Tính Khối Lượng Kim Loại Hoặc Muối Tạo Thành
- Đề bài: Cho m gam kim loại M phản ứng hoàn toàn với dung dịch axit HCl dư. Sau phản ứng thu được V lít khí H₂ (đktc) và dung dịch chứa muối X. Tính m hoặc khối lượng của muối X.
- Phương pháp giải:
- Viết phương trình hóa học của phản ứng.
- Tính số mol của khí H₂: n(H₂) = V / 22,4.
- Dựa vào phương trình hóa học để xác định số mol của kim loại M hoặc muối X.
- Tính khối lượng của kim loại M: m = n(M) × M(M) hoặc khối lượng của muối X: m(X) = n(X) × M(X).
- Ví dụ: Cho 6,5 gam kẽm phản ứng hoàn toàn với dung dịch HCl dư. Tính thể tích khí H₂ thu được (đktc).
- Giải:
- Phương trình hóa học: Zn + 2HCl → ZnCl₂ + H₂
- Số mol Zn: n(Zn) = 6,5 / 65 = 0,1 mol
- Theo phương trình: n(H₂) = n(Zn) = 0,1 mol
- Thể tích H₂: V(H₂) = 0,1 × 22,4 = 2,24 lít
- Giải:
8.2. Dạng 2: Xác Định Kim Loại Dựa Vào Lượng Khí H₂ Thu Được
- Đề bài: Cho m gam kim loại M (hóa trị n không đổi) phản ứng hoàn toàn với dung dịch HCl dư. Sau phản ứng thu được V lít khí H₂ (đktc). Xác định kim loại M.
- Phương pháp giải:
- Viết phương trình hóa học tổng quát của phản ứng: 2M + 2nHCl → 2MClₙ + nH₂
- Tính số mol của khí H₂: n(H₂) = V / 22,4.
- Dựa vào phương trình hóa học để xác định số mol của kim loại M: n(M) = (2 / n) × n(H₂).
- Tính khối lượng mol của kim loại M: M(M) = m / n(M).
- So sánh M(M) với khối lượng mol của các kim loại để xác định kim loại M.
- Ví dụ: Cho 5,6 gam kim loại M hóa trị II phản ứng hoàn toàn với dung dịch HCl dư, thu được 2,24 lít khí H₂ (đktc). Xác định kim loại M.
- Giải:
- Phương trình hóa học: M + 2HCl → MCl₂ + H₂
- Số mol H₂: n(H₂) = 2,24 / 22,4 = 0,1 mol
- Theo phương trình: n(M) = n(H₂) = 0,1 mol
- Khối lượng mol của M: M(M) = 5,6 / 0,1 = 56 g/mol
- Vậy kim loại M là sắt (Fe).
- Giải:
8.3. Dạng 3: Bài Toán Hỗn Hợp Kim Loại Phản Ứng Với Axit
- Đề bài: Cho hỗn hợp gồm hai kim loại A và B phản ứng hoàn toàn với dung dịch HCl dư, thu được V lít khí H₂ (đktc) và dung dịch chứa các muối. Tính thành phần phần trăm về khối lượng của mỗi kim loại trong hỗn hợp ban đầu.
- Phương pháp giải:
- Viết phương trình hóa học của các phản ứng.
- Gọi số mol của mỗi kim loại là x và y.
- Dựa vào phương trình hóa học và dữ kiện đề bài để lập hệ phương trình liên quan đến x và y.
- Giải hệ phương trình để tìm x và y.
- Tính khối lượng của mỗi kim loại: m(A) = x × M(A) và m(B) = y × M(B).
- Tính thành phần phần trăm về khối lượng của mỗi kim loại:
- %m(A) = (m(A) / (m(A) + m(B))) × 100%
- %m(B) = (m(B) / (m(A) + m(B))) × 100%
- Ví dụ: Cho 10 gam hỗn hợp gồm sắt và kẽm phản ứng hoàn toàn với dung dịch HCl dư, thu được 3,36 lít khí H₂ (đktc). Tính thành phần phần trăm về khối lượng của mỗi kim loại trong hỗn hợp ban đầu.
- Giải:
- Phương trình hóa học:
- Fe + 2HCl → FeCl₂ + H₂
- Zn + 2HCl → ZnCl₂ + H₂
- Gọi n(Fe) = x mol và n(Zn) = y mol.
- Hệ phương trình:
- 56x + 65y = 10 (khối lượng hỗn hợp)
- x + y = 3,36 / 22,4 = 0,15 (số mol H₂)
- Giải hệ phương trình: x = 0,0833 mol và y = 0,0667 mol
- Khối lượng mỗi kim loại:
- m(Fe) = 0,0833 × 56 = 4,66 gam
- m(Zn) = 0,0667 × 65 = 4,33 gam
- Thành phần phần trăm:
- %m(Fe) = (4,66 / 10) × 100% = 46,6%
- %m(Zn) = (4,33 / 10) × 100% = 43,3%
- Phương trình hóa học:
- Giải:
