Bạn đang tìm hiểu về các phản ứng hóa học liên quan đến sắt (Fe) và muốn biết chất nào không thể oxi hóa Fe thành Fe3+? Hãy cùng Xe Tải Mỹ Đình (XETAIMYDINH.EDU.VN) khám phá câu trả lời chi tiết và những kiến thức hữu ích liên quan đến vấn đề này. Chúng tôi sẽ cung cấp thông tin đầy đủ, dễ hiểu và được tối ưu hóa cho SEO, giúp bạn nắm vững kiến thức và đạt kết quả cao trong học tập và công việc.
Chất nào sau đây không thể oxi hóa được Fe thành Fe3+? Đó là các chất có tính oxi hóa yếu hơn ion Fe3+. Để hiểu rõ hơn, chúng ta cần xem xét dãy điện hóa của kim loại và các yếu tố ảnh hưởng đến khả năng oxi hóa của một chất.
1. Dãy Điện Hóa Kim Loại và Khả Năng Oxi Hóa – Khử
1.1. Dãy Điện Hóa Kim Loại Là Gì?
Dãy điện hóa kim loại là một dãy các cặp oxi hóa – khử được sắp xếp theo chiều tăng dần tính oxi hóa của ion kim loại và giảm dần tính khử của kim loại. Dãy này giúp ta dự đoán khả năng phản ứng giữa các chất, so sánh tính oxi hóa – khử và xác định chiều của phản ứng.
1.2. Ý Nghĩa Của Dãy Điện Hóa
Dãy điện hóa kim loại mang lại nhiều thông tin quan trọng:
- So sánh tính oxi hóa – khử: Ion kim loại có tính oxi hóa càng mạnh thì kim loại tương ứng có tính khử càng yếu và ngược lại.
- Xác định chiều phản ứng oxi hóa – khử: Phản ứng xảy ra giữa hai cặp oxi hóa – khử tuân theo quy tắc alpha. Chất khử mạnh hơn sẽ tác dụng với chất oxi hóa mạnh hơn để tạo thành chất oxi hóa yếu hơn và chất khử yếu hơn.
- Dự đoán phản ứng: Cho phép dự đoán các phản ứng có thể xảy ra giữa kim loại và dung dịch muối, axit hoặc nước.
1.3. Dãy Điện Hóa Kim Loại Đầy Đủ
Dưới đây là dãy điện hóa kim loại đầy đủ, sắp xếp theo chiều tăng tính oxi hóa:
K+ / K – Na+ / Na – Mg2+ / Mg – Al3+ / Al – Zn2+ / Zn – Fe2+ / Fe – Ni2+ / Ni – Sn2+ / Sn – Pb2+ / Pb – H+ / H2 – Cu2+ / Cu – Fe3+ / Fe2+ – Ag+ / Ag – Au3+ / Au
 day-dien-hoa-kim-loai
day-dien-hoa-kim-loai
Bảng dãy điện hóa đầy đủ của kim loại, minh họa sự biến đổi tính chất oxi hóa và khử
2. Tính Chất Hóa Học Của Sắt (Fe)
2.1. Cấu Hình Electron và Số Oxi Hóa
Sắt (Fe) có cấu hình electron là [Ar] 3d6 4s2. Nó có hai số oxi hóa phổ biến là +2 (Fe2+) và +3 (Fe3+). Trong đó, Fe3+ có tính oxi hóa mạnh hơn Fe2+.
2.2. Phản Ứng Với Phi Kim
Sắt có thể phản ứng với nhiều phi kim như oxi, clo, lưu huỳnh để tạo thành các oxit và muối tương ứng.
- Với oxi: 3Fe + 2O2 → Fe3O4 (oxit sắt từ)
- Với clo: 2Fe + 3Cl2 → 2FeCl3 (sắt(III) clorua)
- Với lưu huỳnh: Fe + S → FeS (sắt(II) sunfua)
2.3. Phản Ứng Với Axit
Sắt phản ứng với axit loãng (HCl, H2SO4) tạo thành muối sắt(II) và giải phóng khí hidro. Với axit đặc nóng (H2SO4 đặc, HNO3 đặc), sắt bị oxi hóa lên mức +3 và tạo ra các sản phẩm khử khác như SO2 hoặc NO2.
- Với HCl: Fe + 2HCl → FeCl2 + H2
- Với H2SO4 loãng: Fe + H2SO4 → FeSO4 + H2
- Với H2SO4 đặc, nóng: 2Fe + 6H2SO4 → Fe2(SO4)3 + 3SO2 + 6H2O
- Với HNO3 đặc, nóng: Fe + 6HNO3 → Fe(NO3)3 + 3NO2 + 3H2O
2.4. Phản Ứng Với Muối
Sắt có thể phản ứng với dung dịch muối của các kim loại yếu hơn để tạo thành muối sắt(II) và kim loại mới.
- Với CuSO4: Fe + CuSO4 → FeSO4 + Cu
 phan-ung-cua-sat-voi-muoi
phan-ung-cua-sat-voi-muoi
Phản ứng giữa sắt và dung dịch muối đồng sunfat tạo thành muối sắt và kim loại đồng
3. Các Chất Có Khả Năng Oxi Hóa Fe Thành Fe3+
Để oxi hóa Fe thành Fe3+, chất oxi hóa cần có tính oxi hóa mạnh hơn cặp Fe3+/Fe. Dưới đây là một số chất có khả năng này:
- Clo (Cl2): Là một chất oxi hóa mạnh, có thể oxi hóa Fe lên Fe3+.
- Brom (Br2): Tương tự như clo, brom cũng có khả năng oxi hóa Fe lên Fe3+.
- Axit nitric đặc (HNO3 đặc): HNO3 đặc có tính oxi hóa rất mạnh, có thể oxi hóa Fe lên Fe3+.
- Kali pemanganat (KMnO4): Trong môi trường axit, KMnO4 là một chất oxi hóa mạnh, có thể oxi hóa Fe lên Fe3+.
- Kali dicromat (K2Cr2O7): Tương tự như KMnO4, K2Cr2O7 trong môi trường axit cũng có khả năng oxi hóa Fe lên Fe3+.
4. Chất Nào Sau Đây Không Thể Oxi Hóa Được Fe Thành Fe3+?
Các chất không thể oxi hóa Fe thành Fe3+ thường là những chất có tính oxi hóa yếu hơn cặp Fe3+/Fe. Ví dụ:
- Ion Fe2+: Vì Fe2+ là sản phẩm trung gian giữa Fe và Fe3+, nó không thể oxi hóa Fe lên Fe3+.
- Cu2+: Ion Cu2+ có tính oxi hóa yếu hơn Fe3+, do đó không thể oxi hóa Fe lên Fe3+. Thay vào đó, nó chỉ có thể oxi hóa Fe lên Fe2+.
- H+ (trong axit loãng): Axit loãng chỉ có khả năng oxi hóa Fe lên Fe2+, không đủ mạnh để oxi hóa lên Fe3+.
- Kim loại đứng sau Fe trong dãy điện hóa: Các kim loại như Cu, Ag, Au không thể oxi hóa Fe thành Fe3+ vì chúng có tính khử yếu hơn.
5. Các Yếu Tố Ảnh Hưởng Đến Khả Năng Oxi Hóa
5.1. Thế Điện Cực Chuẩn (E0)
Thế điện cực chuẩn là thước đo khả năng oxi hóa – khử của một cặp oxi hóa – khử trong điều kiện tiêu chuẩn. Chất có thế điện cực chuẩn càng cao thì tính oxi hóa càng mạnh.
5.2. Nồng Độ
Nồng độ của các chất phản ứng cũng ảnh hưởng đến khả năng oxi hóa. Nồng độ chất oxi hóa càng cao thì khả năng oxi hóa càng mạnh.
5.3. Nhiệt Độ
Nhiệt độ có thể ảnh hưởng đến tốc độ phản ứng và cân bằng hóa học, từ đó ảnh hưởng đến khả năng oxi hóa.
5.4. Môi Trường
Môi trường phản ứng (axit, bazơ, trung tính) có thể ảnh hưởng đến tính oxi hóa của các chất. Ví dụ, KMnO4 và K2Cr2O7 chỉ có tính oxi hóa mạnh trong môi trường axit.
6. Ứng Dụng Của Dãy Điện Hóa Trong Thực Tế
Dãy điện hóa kim loại có nhiều ứng dụng quan trọng trong thực tế:
- Điều chế kim loại: Dùng để lựa chọn phương pháp điều chế kim loại phù hợp (điện phân, nhiệt luyện, thủy luyện).
- Bảo vệ kim loại khỏi ăn mòn: Dùng để lựa chọn kim loại bảo vệ hoặc phương pháp bảo vệ phù hợp.
- Sản xuất pin điện hóa: Dùng để lựa chọn các cặp oxi hóa – khử phù hợp để tạo ra pin có hiệu điện thế cao.
- Xử lý nước thải: Dùng để loại bỏ các ion kim loại nặng độc hại khỏi nước thải.
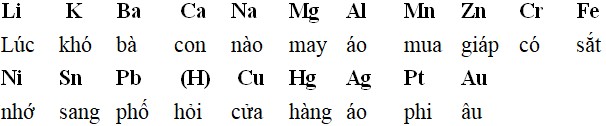 ung-dung-day-dien-hoa
ung-dung-day-dien-hoa
Minh họa ứng dụng của dãy điện hóa trong việc điều chế kim loại và bảo vệ kim loại khỏi ăn mòn
7. Bài Tập Vận Dụng
Để củng cố kiến thức, chúng ta cùng làm một số bài tập vận dụng:
Bài tập 1: Cho các chất sau: Fe, Cu, dung dịch HCl, dung dịch HNO3 đặc, nguội. Chất nào có thể oxi hóa Fe thành Fe3+?
Lời giải:
- Dung dịch HNO3 đặc, nguội có thể oxi hóa Fe thành Fe3+ (Fe bị thụ động hóa trong HNO3 đặc, nguội, nhưng nếu đun nóng thì phản ứng vẫn xảy ra).
Bài tập 2: Cho các cặp oxi hóa – khử sau: Fe2+/Fe, Ag+/Ag, Cu2+/Cu, Fe3+/Fe2+. Sắp xếp các cặp theo chiều tăng dần tính oxi hóa.
Lời giải:
- Fe2+/Fe < Cu2+/Cu < Fe3+/Fe2+ < Ag+/Ag
Bài tập 3: Cho phản ứng: Fe + X → Fe2+ + Y. Hỏi X và Y có thể là những chất nào?
Lời giải:
- X có thể là CuSO4, H2SO4 loãng, HCl.
- Y có thể là Cu, H2.
8. FAQ – Các Câu Hỏi Thường Gặp
8.1. Tại sao ion Fe3+ có tính oxi hóa mạnh hơn Fe2+?
Ion Fe3+ có cấu hình electron bền vững hơn (3d5) so với Fe2+ (3d6), do đó nó dễ dàng nhận thêm electron để trở thành Fe2+, thể hiện tính oxi hóa mạnh hơn.
8.2. Kim loại nào có tính khử mạnh nhất trong dãy điện hóa?
Kim loại có tính khử mạnh nhất là Kali (K).
8.3. Axit nào có thể oxi hóa Fe lên mức oxi hóa cao nhất?
Axit nitric đặc (HNO3 đặc) và axit sunfuric đặc, nóng (H2SO4 đặc, nóng) có thể oxi hóa Fe lên mức oxi hóa cao nhất (+3).
8.4. Tại sao Fe bị thụ động hóa trong HNO3 đặc, nguội?
Khi Fe tiếp xúc với HNO3 đặc, nguội, trên bề mặt kim loại hình thành một lớp oxit mỏng, bền vững, ngăn cản phản ứng tiếp tục xảy ra.
8.5. Làm thế nào để bảo vệ kim loại Fe khỏi bị ăn mòn?
Có nhiều phương pháp bảo vệ Fe khỏi bị ăn mòn, bao gồm:
- Sơn, mạ: Phủ lên bề mặt kim loại một lớp bảo vệ.
- Dùng kim loại bảo vệ: Ghép Fe với một kim loại có tính khử mạnh hơn (ví dụ: Zn).
- Sử dụng chất ức chế ăn mòn: Thêm vào môi trường các chất làm chậm quá trình ăn mòn.
8.6. Thế nào là ăn mòn điện hóa?
Ăn mòn điện hóa là quá trình ăn mòn kim loại xảy ra khi có sự hình thành các pin điện hóa trên bề mặt kim loại.
8.7. Quá trình điện phân là gì?
Điện phân là quá trình dùng dòng điện một chiều để gây ra các phản ứng oxi hóa – khử không tự xảy ra trong dung dịch chất điện ly hoặc chất điện ly nóng chảy.
8.8. Ứng dụng của quá trình điện phân trong công nghiệp là gì?
Quá trình điện phân được ứng dụng rộng rãi trong công nghiệp để:
- Điều chế kim loại (Al, Na, K, Mg, Ca…).
- Tinh chế kim loại (Cu, Ag, Au…).
- Mạ điện.
- Điều chế các hóa chất (Cl2, H2, NaOH…).
8.9. Các yếu tố nào ảnh hưởng đến tốc độ ăn mòn kim loại?
Các yếu tố ảnh hưởng đến tốc độ ăn mòn kim loại bao gồm:
- Thành phần kim loại.
- Môi trường ăn mòn (nhiệt độ, độ ẩm, độ pH, nồng độ các chất ăn mòn).
- Tác động cơ học.
8.10. Làm thế nào để xác định tính oxi hóa – khử của một chất?
Để xác định tính oxi hóa – khử của một chất, ta cần dựa vào:
- Thế điện cực chuẩn.
- Vị trí của chất trong dãy điện hóa.
- Khả năng nhường hoặc nhận electron của chất.
9. Kết Luận
Hiểu rõ về dãy điện hóa kim loại và tính chất hóa học của sắt (Fe) là rất quan trọng để xác định chất nào có thể hoặc không thể oxi hóa Fe thành Fe3+. Các yếu tố như thế điện cực chuẩn, nồng độ, nhiệt độ và môi trường cũng ảnh hưởng đến khả năng oxi hóa của một chất. Hy vọng bài viết này của Xe Tải Mỹ Đình (XETAIMYDINH.EDU.VN) đã cung cấp cho bạn những kiến thức hữu ích và giúp bạn tự tin hơn trong việc giải quyết các bài tập và ứng dụng thực tế liên quan đến hóa học.
Bạn đang tìm kiếm thông tin chi tiết và đáng tin cậy về xe tải ở Mỹ Đình? Bạn muốn được tư vấn lựa chọn xe phù hợp với nhu cầu và ngân sách của mình? Hãy truy cập ngay XETAIMYDINH.EDU.VN để khám phá thế giới xe tải đa dạng và nhận được sự hỗ trợ tận tình từ đội ngũ chuyên gia của chúng tôi.
Liên hệ ngay với Xe Tải Mỹ Đình:
- Địa chỉ: Số 18 đường Mỹ Đình, phường Mỹ Đình 2, quận Nam Từ Liêm, Hà Nội
- Hotline: 0247 309 9988
- Trang web: XETAIMYDINH.EDU.VN
Chúng tôi luôn sẵn lòng lắng nghe và giải đáp mọi thắc mắc của bạn về xe tải ở Mỹ Đình.