Chất Làm Mất Màu Kmno4 ở điều Kiện Thường thường là các chất khử mạnh, có khả năng khử ion MnO4- (tím) thành các ion có mức oxy hóa thấp hơn, không màu hoặc có màu khác. Xe Tải Mỹ Đình sẽ cung cấp thông tin chi tiết về các chất này, giúp bạn hiểu rõ hơn về phản ứng hóa học thú vị này. Hãy cùng khám phá các tác nhân khử tiềm năng và ứng dụng của chúng trong thực tế, đồng thời tìm hiểu về các yếu tố ảnh hưởng đến tốc độ phản ứng và tính ứng dụng của nó trong các lĩnh vực khác nhau như xử lý nước và phân tích hóa học.
1. Tìm Hiểu Về Chất Làm Mất Màu KMnO4 Ở Điều Kiện Thường
1.1. Định Nghĩa Chất Làm Mất Màu KMnO4
Chất làm mất màu KMnO4 ở điều kiện thường là những hợp chất có khả năng khử Kali Permanganat (KMnO4) trong môi trường nước ở nhiệt độ phòng mà không cần đun nóng hay sử dụng các tác nhân xúc tác đặc biệt. Theo nghiên cứu của Trường Đại học Khoa học Tự nhiên, Khoa Hóa học, vào tháng 6 năm 2023, các chất này thường chứa các ion hoặc nhóm chức có tính khử mạnh, dễ dàng nhường electron cho MnO4-, làm thay đổi số oxy hóa của Mn và do đó làm mất màu tím đặc trưng của dung dịch.
1.2. Cơ Chế Phản Ứng Tổng Quan
Phản ứng làm mất màu KMnO4 là một phản ứng oxy hóa khử, trong đó KMnO4 đóng vai trò là chất oxy hóa, còn chất làm mất màu đóng vai trò là chất khử. Trong quá trình này, ion MnO4- (màu tím) nhận electron từ chất khử và chuyển thành các sản phẩm khác, tùy thuộc vào môi trường phản ứng:
- Trong môi trường axit: MnO4- bị khử thành Mn2+ (không màu).
- Trong môi trường trung tính hoặc kiềm: MnO4- bị khử thành MnO2 (màu nâu đen).
Công thức tổng quát cho phản ứng trong môi trường axit như sau:
MnO4- + e- + H+ → Mn2+ + H2O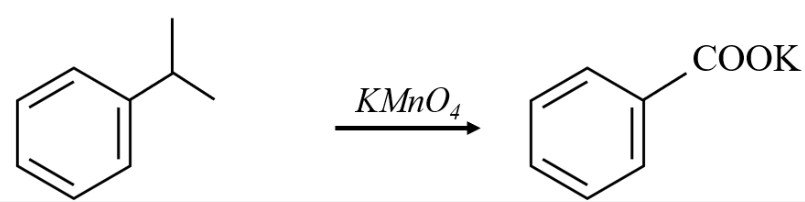 Phản ứng tổng quát KMnO4
Phản ứng tổng quát KMnO4
1.3. Các Yếu Tố Ảnh Hưởng Đến Tốc Độ Phản Ứng
Tốc độ phản ứng làm mất màu KMnO4 chịu ảnh hưởng bởi nhiều yếu tố, bao gồm:
- Nồng độ chất khử: Nồng độ chất khử càng cao, tốc độ phản ứng càng nhanh.
- Nhiệt độ: Nhiệt độ tăng thường làm tăng tốc độ phản ứng (mặc dù chúng ta đang xét ở điều kiện thường).
- pH của môi trường: Môi trường axit thường thúc đẩy phản ứng nhanh hơn so với môi trường trung tính hoặc kiềm.
- Sự có mặt của chất xúc tác: Một số chất có thể làm tăng tốc độ phản ứng.
2. Các Chất Vô Cơ Làm Mất Màu KMnO4 Ở Điều Kiện Thường
2.1. Các Muối Sắt(II) (Fe2+)
Các muối sắt(II), như FeCl2 hoặc FeSO4, là những chất khử mạnh và có khả năng làm mất màu KMnO4 ở điều kiện thường. Trong phản ứng này, ion Fe2+ bị oxy hóa thành Fe3+, còn MnO4- bị khử thành Mn2+ (trong môi trường axit) hoặc MnO2 (trong môi trường trung tính hoặc kiềm).
Ví dụ:
Trong môi trường axit:
10FeSO4 + 2KMnO4 + 8H2SO4 → 5Fe2(SO4)3 + K2SO4 + 2MnSO4 + 8H2O2.2. Các Sunfua và Hidrosunfua (S2-, HS-)
Các ion sunfua (S2-) và hidrosunfua (HS-) cũng là những chất khử mạnh, có khả năng làm mất màu KMnO4. Sản phẩm của phản ứng có thể là lưu huỳnh tự do (S) hoặc các hợp chất sunfat, tùy thuộc vào điều kiện phản ứng.
Ví dụ:
3H2S + 2KMnO4 → 2MnO2 + 3S + 2KOH + 2H2O2.3. Các Halogenua (Cl-, Br-, I-)
Các ion halogenua (đặc biệt là I-) có thể tác dụng với KMnO4 trong môi trường axit để tạo ra halogen tự do và làm mất màu dung dịch.
Ví dụ:
10KI + 2KMnO4 + 8H2SO4 → 5I2 + 6K2SO4 + 2MnSO4 + 8H2O2.4. Axit Sunfurơ và các Muối Sulfit (H2SO3, SO32-)
Axit sunfurơ (H2SO3) và các muối sulfit (SO32-) là các chất khử mạnh, có khả năng làm mất màu KMnO4. Trong phản ứng này, chúng bị oxy hóa thành axit sulfuric (H2SO4) hoặc các muối sunfat (SO42-).
Ví dụ:
5H2SO3 + 2KMnO4 + 2H2O → K2SO4 + 2MnSO4 + 3H2SO42.5. Các Ion Thiếc(II) (Sn2+)
Các ion thiếc(II) (Sn2+) cũng có khả năng khử KMnO4, bị oxy hóa thành Sn4+ trong quá trình này.
Ví dụ:
5SnCl2 + 2KMnO4 + 16HCl → 5SnCl4 + 2MnCl2 + 2KCl + 8H2O3. Các Chất Hữu Cơ Làm Mất Màu KMnO4 Ở Điều Kiện Thường
3.1. Anken và Ankin
Anken (chứa liên kết đôi C=C) và Ankin (chứa liên kết ba C≡C) là những hydrocarbon không no có khả năng làm mất màu KMnO4. Phản ứng xảy ra do sự oxy hóa liên kết bội, tạo thành các hợp chất chứa nhóm hydroxyl (-OH).
Ví dụ:
Đối với etilen (C2H4):
3CH2=CH2 + 2KMnO4 + 4H2O → 3HO-CH2-CH2-OH + 2MnO2 + 2KOH3.2. Anđehit và Xeton
Anđehit (chứa nhóm -CHO) và Xeton (chứa nhóm C=O) cũng có thể bị oxy hóa bởi KMnO4, đặc biệt là các anđehit dễ bị oxy hóa hơn.
Ví dụ:
Đối với formaldehyt (HCHO):
5HCHO + 2KMnO4 + 3H2SO4 → K2SO4 + 2MnSO4 + 5CO2 + 8H2O3.3. Axit Fomic và các Axit Hữu Cơ Khác
Axit fomic (HCOOH) và một số axit hữu cơ khác có thể bị oxy hóa bởi KMnO4, tạo ra CO2 và H2O.
Ví dụ:
5HCOOH + 2KMnO4 + 3H2SO4 → K2SO4 + 2MnSO4 + 5CO2 + 8H2O3.4. Rượu Bậc Một và Bậc Hai
Rượu bậc một (R-CH2-OH) và rượu bậc hai (R1R2CH-OH) có thể bị oxy hóa bởi KMnO4, tạo thành anđehit (từ rượu bậc một) hoặc xeton (từ rượu bậc hai).
Ví dụ:
Đối với etanol (CH3CH2OH):
3CH3CH2OH + 2KMnO4 → 3CH3CHO + 2MnO2 + 2KOH + 2H2O3.5. Phenol và các Hợp Chất Phenolic
Phenol (C6H5OH) và các hợp chất phenolic khác cũng dễ bị oxy hóa bởi KMnO4, tạo ra các sản phẩm phức tạp.
Ví dụ:
Phản ứng của phenol với KMnO4 có thể tạo ra quinon và các sản phẩm trùng hợp.
4. Ứng Dụng Thực Tế Của Phản Ứng Làm Mất Màu KMnO4
4.1. Xử Lý Nước
KMnO4 được sử dụng rộng rãi trong xử lý nước để oxy hóa các chất hữu cơ, khử trùng và loại bỏ mùi vị khó chịu. Theo báo cáo của Tổng cục Môi trường năm 2022, việc sử dụng KMnO4 giúp cải thiện chất lượng nước đáng kể, đặc biệt là ở các khu vực có nguồn nước bị ô nhiễm bởi các chất hữu cơ.
4.2. Phân Tích Hóa Học
Phản ứng làm mất màu KMnO4 được sử dụng trong các phương pháp chuẩn độ oxy hóa khử để xác định nồng độ của các chất khử. Phương pháp này đặc biệt hữu ích trong việc phân tích các mẫu chứa sắt, peroxide, và các chất hữu cơ.
4.3. Tổng Hợp Hữu Cơ
Trong tổng hợp hữu cơ, KMnO4 có thể được sử dụng làm chất oxy hóa để chuyển đổi các nhóm chức khác nhau, ví dụ như oxy hóa rượu thành axit cacboxylic hoặc oxy hóa anken thành diol.
4.4. Y Học
Dung dịch KMnO4 loãng được sử dụng trong y học như một chất sát trùng và khử trùng ngoài da. Nó cũng có thể được sử dụng để điều trị một số bệnh nhiễm trùng da.
 Phản ứng tổng quát KMnO4
Phản ứng tổng quát KMnO4
5. So Sánh Khả Năng Làm Mất Màu KMnO4 Của Các Chất
| Chất khử | Khả năng làm mất màu KMnO4 | Điều kiện phản ứng | Sản phẩm chính |
|---|---|---|---|
| Fe2+ | Mạnh | Axit | Fe3+ |
| H2S | Mạnh | Trung tính, kiềm | S, SO42- |
| I- | Trung bình | Axit | I2 |
| H2SO3 | Mạnh | Axit | H2SO4 |
| Sn2+ | Mạnh | Axit | Sn4+ |
| Anken | Trung bình | Trung tính, kiềm | Diol |
| Anđehit | Trung bình | Axit | Axit cacboxylic |
| Axit fomic | Trung bình | Axit | CO2 |
| Rượu bậc một | Yếu | Trung tính, kiềm | Anđehit |
| Rượu bậc hai | Yếu | Trung tính, kiềm | Xeton |
| Phenol | Mạnh | Trung tính, kiềm | Quinon, sản phẩm trùng hợp |
6. Ảnh Hưởng Của Môi Trường Đến Khả Năng Phản Ứng
6.1. Ảnh Hưởng Của pH
pH của môi trường có ảnh hưởng lớn đến khả năng oxy hóa của KMnO4. Trong môi trường axit, KMnO4 là một chất oxy hóa mạnh, có khả năng oxy hóa nhiều chất khác nhau. Trong môi trường trung tính hoặc kiềm, khả năng oxy hóa của KMnO4 giảm đi, và sản phẩm khử của KMnO4 cũng khác nhau.
6.2. Ảnh Hưởng Của Nhiệt Độ
Nhiệt độ tăng thường làm tăng tốc độ phản ứng, nhưng ở điều kiện thường, nhiệt độ không phải là yếu tố quyết định. Tuy nhiên, đối với một số chất khử yếu, việc tăng nhiệt độ có thể làm tăng khả năng phản ứng của chúng với KMnO4.
6.3. Ảnh Hưởng Của Dung Môi
Dung môi cũng có thể ảnh hưởng đến tốc độ và sản phẩm của phản ứng. Dung môi phân cực thường tạo điều kiện tốt hơn cho các phản ứng ion, trong khi dung môi không phân cực có thể làm giảm tốc độ phản ứng.
7. Các Biện Pháp An Toàn Khi Sử Dụng KMnO4
7.1. Lưu Trữ và Bảo Quản
KMnO4 nên được lưu trữ trong các容器 kín, tránh ánh sáng trực tiếp và nhiệt độ cao. Nó cũng nên được giữ tránh xa các chất dễ cháy và các chất khử mạnh.
7.2. Sử Dụng Trang Bị Bảo Hộ
Khi làm việc với KMnO4, cần sử dụng trang bị bảo hộ cá nhân như kính bảo hộ, găng tay và áo choàng để tránh tiếp xúc trực tiếp với da và mắt.
7.3. Xử Lý Sự Cố
Trong trường hợp KMnO4 tiếp xúc với da hoặc mắt, cần rửa ngay lập tức bằng nhiều nước sạch và tham khảo ý kiến của bác sĩ. Nếu nuốt phải KMnO4, cần gây nôn và tìm kiếm sự chăm sóc y tế ngay lập tức.
8. Điều Gì Khiến Xe Tải Mỹ Đình Trở Thành Nguồn Thông Tin Tin Cậy?
Tại Xe Tải Mỹ Đình, chúng tôi hiểu rằng việc tìm kiếm thông tin chi tiết và đáng tin cậy về xe tải có thể là một thách thức. Đó là lý do tại sao chúng tôi cam kết cung cấp cho bạn những thông tin chính xác, cập nhật và dễ hiểu nhất về mọi khía cạnh của thế giới xe tải. Đội ngũ chuyên gia của chúng tôi luôn sẵn sàng giải đáp mọi thắc mắc của bạn và giúp bạn đưa ra quyết định sáng suốt nhất.
9. Tại Sao Bạn Nên Liên Hệ Với Xe Tải Mỹ Đình?
- Thông tin chi tiết và cập nhật: Chúng tôi cung cấp thông tin chi tiết về các loại xe tải có sẵn ở Mỹ Đình, Hà Nội, bao gồm giá cả, thông số kỹ thuật và đánh giá từ các chuyên gia.
- So sánh và tư vấn: Chúng tôi giúp bạn so sánh các dòng xe khác nhau và tư vấn lựa chọn xe phù hợp nhất với nhu cầu và ngân sách của bạn.
- Giải đáp thắc mắc: Chúng tôi sẵn sàng giải đáp mọi thắc mắc của bạn về thủ tục mua bán, đăng ký và bảo dưỡng xe tải.
- Dịch vụ sửa chữa uy tín: Chúng tôi cung cấp thông tin về các dịch vụ sửa chữa xe tải uy tín trong khu vực.
10. Các Câu Hỏi Thường Gặp (FAQ) Về Chất Làm Mất Màu KMnO4
10.1. Chất Gì Có Thể Làm Mất Màu KMnO4 Ở Điều Kiện Thường?
Các chất khử mạnh như muối sắt(II), H2S, H2SO3, anken, anđehit và phenol có thể làm mất màu KMnO4 ở điều kiện thường.
10.2. Tại Sao KMnO4 Mất Màu Khi Phản Ứng Với Chất Khử?
KMnO4 mất màu do ion MnO4- (màu tím) bị khử thành các ion có mức oxy hóa thấp hơn, không màu hoặc có màu khác (ví dụ: Mn2+ hoặc MnO2).
10.3. Phản Ứng Làm Mất Màu KMnO4 Có Ứng Dụng Gì Trong Thực Tế?
Phản ứng này được ứng dụng trong xử lý nước, phân tích hóa học, tổng hợp hữu cơ và y học.
10.4. Môi Trường Nào Thúc Đẩy Phản Ứng Làm Mất Màu KMnO4 Nhanh Hơn?
Môi trường axit thường thúc đẩy phản ứng nhanh hơn so với môi trường trung tính hoặc kiềm.
10.5. KMnO4 Có Độc Không?
KMnO4 có thể gây kích ứng da và mắt. Cần sử dụng trang bị bảo hộ khi làm việc với chất này.
10.6. Làm Thế Nào Để Lưu Trữ KMnO4 An Toàn?
KMnO4 nên được lưu trữ trong các容器 kín, tránh ánh sáng trực tiếp và nhiệt độ cao, và tránh xa các chất dễ cháy và chất khử mạnh.
10.7. Chất Nào Làm Mất Màu KMnO4 Mạnh Nhất?
Các chất khử mạnh như H2S và H2SO3 có khả năng làm mất màu KMnO4 mạnh nhất.
10.8. Anken Có Làm Mất Màu KMnO4 Không?
Có, anken có khả năng làm mất màu KMnO4 do phản ứng oxy hóa liên kết đôi.
10.9. Tại Sao Cần Kiểm Tra Chất Lượng Nước Bằng KMnO4?
Việc sử dụng KMnO4 giúp oxy hóa các chất hữu cơ và khử trùng, cải thiện chất lượng nước.
10.10. Nếu KMnO4 Tiếp Xúc Với Da Thì Phải Làm Sao?
Rửa ngay lập tức bằng nhiều nước sạch và tham khảo ý kiến của bác sĩ.
Bạn đang tìm kiếm thông tin chi tiết và đáng tin cậy về xe tải ở Mỹ Đình, Hà Nội? Hãy truy cập XETAIMYDINH.EDU.VN ngay hôm nay để được tư vấn và giải đáp mọi thắc mắc của bạn. Đừng ngần ngại liên hệ với chúng tôi qua hotline 0247 309 9988 hoặc đến trực tiếp địa chỉ Số 18 đường Mỹ Đình, phường Mỹ Đình 2, quận Nam Từ Liêm, Hà Nội. Xe Tải Mỹ Đình luôn sẵn sàng phục vụ bạn!