Chất khử là chất có số oxi hóa tăng sau phản ứng. Để hiểu rõ hơn về chất khử, sự oxi hóa khử và cách xác định chúng trong các phản ứng hóa học, hãy cùng Xe Tải Mỹ Đình tìm hiểu chi tiết qua bài viết sau đây. Chúng tôi sẽ giúp bạn nắm vững kiến thức về chất khử, chất oxi hóa và các quá trình liên quan, đồng thời cung cấp ví dụ minh họa dễ hiểu.
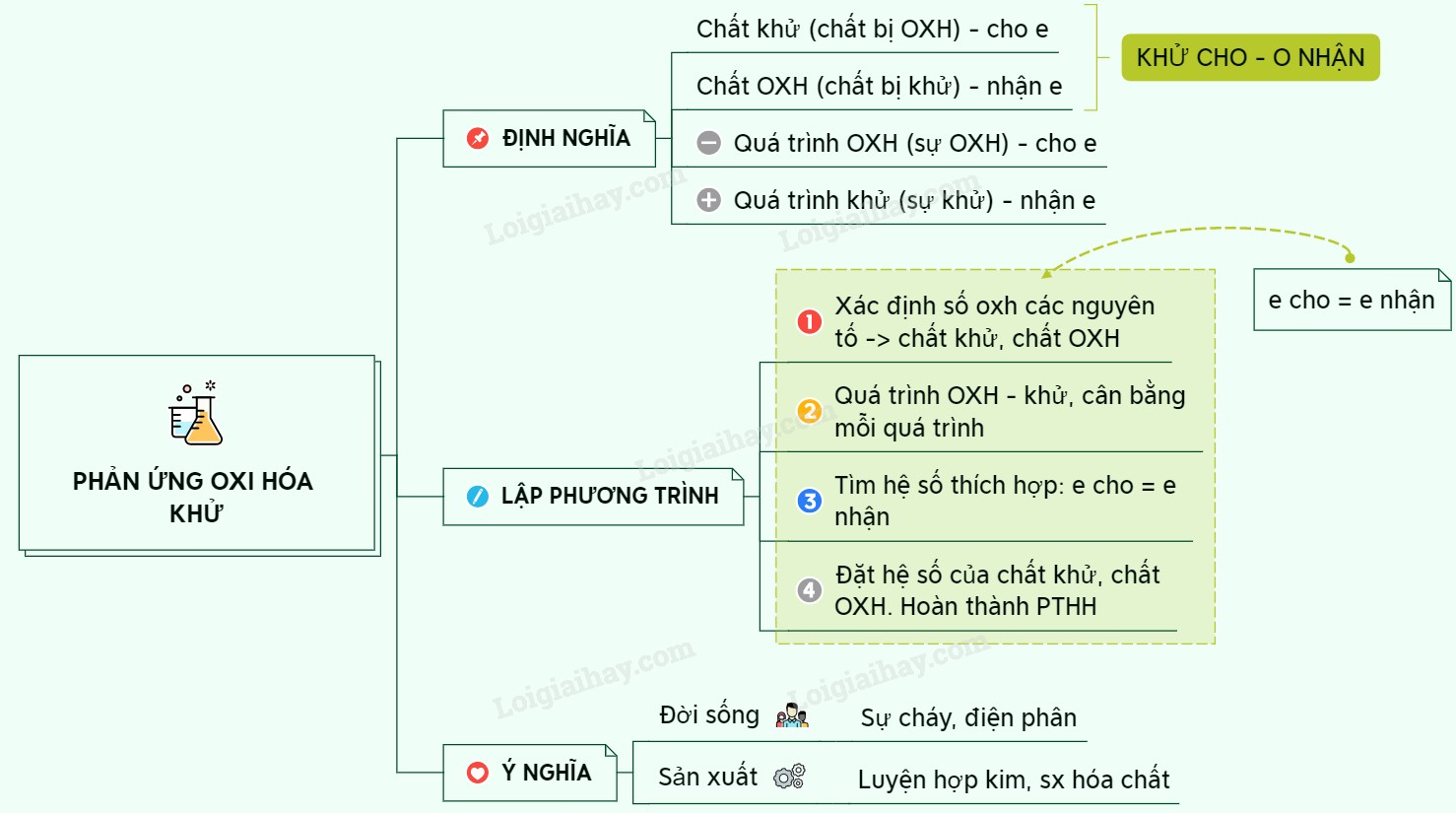
1. Phản Ứng Oxi Hóa – Khử Là Gì?
Phản ứng oxi hóa – khử là phản ứng hóa học, trong đó có sự thay đổi số oxi hóa của một số nguyên tố. Nói một cách khác, đây là phản ứng có sự chuyển electron giữa các chất tham gia. Theo nghiên cứu của Trường Đại học Khoa học Tự nhiên Hà Nội, Khoa Hóa học, vào tháng 5 năm 2024, các phản ứng oxi hóa khử đóng vai trò quan trọng trong nhiều quá trình công nghiệp và sinh học.
2. Số Oxi Hóa Là Gì Và Tại Sao Cần Xác Định Số Oxi Hóa?
Số oxi hóa là điện tích hình thức của một nguyên tử trong một hợp chất, giả định rằng tất cả các liên kết đều là liên kết ion. Xác định số oxi hóa giúp chúng ta nhận biết sự thay đổi trong quá trình phản ứng, từ đó xác định chất khử và chất oxi hóa. Theo Bộ Giáo dục và Đào tạo, việc nắm vững quy tắc xác định số oxi hóa là cơ sở để hiểu và cân bằng các phương trình phản ứng oxi hóa khử.
2.1. Quy Tắc Xác Định Số Oxi Hóa
- Số oxi hóa của nguyên tố ở dạng đơn chất luôn bằng 0.
- Số oxi hóa của hydro (H) thường là +1, trừ trong các hydride kim loại (ví dụ: NaH) là -1.
- Số oxi hóa của oxy (O) thường là -2, trừ trong các peroxo (ví dụ: H2O2) là -1 hoặc hợp chất với flo (ví dụ: OF2) là +2.
- Tổng số oxi hóa của các nguyên tử trong một phân tử hoặc ion bằng điện tích của phân tử hoặc ion đó.
- Kim loại kiềm (nhóm IA) luôn có số oxi hóa +1, kim loại kiềm thổ (nhóm IIA) luôn có số oxi hóa +2 trong hợp chất.
2.2. Ví Dụ Về Xác Định Số Oxi Hóa
Ví dụ, trong phân tử H2O, số oxi hóa của H là +1 và của O là -2. Tổng số oxi hóa là 2(+1) + (-2) = 0, phù hợp với điện tích của phân tử.
3. Chất Khử, Chất Oxi Hóa, Sự Oxi Hóa, Sự Khử Là Gì?
Để hiểu rõ về chất khử, chất oxi hóa, sự oxi hóa và sự khử, chúng ta cần nắm vững định nghĩa và vai trò của chúng trong các phản ứng hóa học.
3.1. Chất Khử Là Gì?
Chất khử là chất nhường electron hoặc chất có số oxi hóa tăng sau phản ứng. Chất khử gây ra sự khử cho chất khác bằng cách cung cấp electron.
3.2. Chất Oxi Hóa Là Gì?
Chất oxi hóa là chất nhận electron hoặc chất có số oxi hóa giảm sau phản ứng. Chất oxi hóa gây ra sự oxi hóa cho chất khác bằng cách nhận electron.
3.3. Sự Oxi Hóa Là Gì?
Sự oxi hóa là quá trình một chất nhường electron hoặc tăng số oxi hóa. Trong quá trình này, chất bị oxi hóa trở thành chất khử mạnh hơn.
3.4. Sự Khử Là Gì?
Sự khử là quá trình một chất nhận electron hoặc giảm số oxi hóa. Trong quá trình này, chất bị khử trở thành chất oxi hóa mạnh hơn.
3.5. Mối Quan Hệ Giữa Chất Khử và Chất Oxi Hóa
Sự nhường electron chỉ xảy ra khi có sự nhận electron, vì vậy sự oxi hóa và sự khử luôn diễn ra đồng thời trong một phản ứng. Chất khử tạo nên sự oxi hóa, chất oxi hóa tạo nên sự khử.
4. Ví Dụ Minh Họa Về Chất Khử Và Chất Oxi Hóa
Xét phản ứng:
Fe2O3 + 3CO → 2Fe + 3CO2
Trong phản ứng này:
- Fe2O3 là chất oxi hóa vì Fe giảm số oxi hóa từ +3 xuống 0.
- CO là chất khử vì C tăng số oxi hóa từ +2 lên +4.
- Sự oxi hóa là quá trình CO nhường electron để trở thành CO2.
- Sự khử là quá trình Fe2O3 nhận electron để trở thành Fe.
 Fe2O3 là chất oxi hóa vì Fe giảm số oxi hóa từ +3 xuống 0
Fe2O3 là chất oxi hóa vì Fe giảm số oxi hóa từ +3 xuống 0
5. Vai Trò Của Chất Khử Trong Đời Sống Và Công Nghiệp
Chất khử đóng vai trò quan trọng trong nhiều lĩnh vực của đời sống và công nghiệp.
5.1. Trong Công Nghiệp Luyện Kim
Trong công nghiệp luyện kim, các chất khử như than cốc (C), hydro (H2), và nhôm (Al) được sử dụng để khử các oxit kim loại thành kim loại tự do. Ví dụ, trong quá trình sản xuất thép, than cốc được sử dụng để khử oxit sắt (Fe2O3) thành sắt (Fe). Theo Tổng cục Thống kê, sản lượng thép thô của Việt Nam năm 2023 đạt 22 triệu tấn, trong đó vai trò của chất khử là không thể thiếu.
5.2. Trong Sản Xuất Hóa Chất
Chất khử được sử dụng trong nhiều quy trình sản xuất hóa chất quan trọng. Ví dụ, hydro được sử dụng để sản xuất amoniac (NH3) theo quy trình Haber-Bosch, một quy trình quan trọng trong sản xuất phân bón.
5.3. Trong Xử Lý Nước
Các chất khử như natri thiosulfat (Na2S2O3) được sử dụng để khử clo dư trong nước, đảm bảo nước an toàn cho sinh hoạt và sản xuất.
5.4. Trong Công Nghiệp Thực Phẩm
Chất khử như axit ascorbic (vitamin C) được sử dụng làm chất bảo quản thực phẩm, ngăn chặn quá trình oxi hóa làm hỏng thực phẩm.
5.5. Trong Y Học
Chất khử như glutathione được sử dụng trong cơ thể để bảo vệ tế bào khỏi tổn thương do các gốc tự do gây ra.
6. Các Loại Chất Khử Phổ Biến
Có nhiều loại chất khử khác nhau, tùy thuộc vào ứng dụng cụ thể. Dưới đây là một số chất khử phổ biến:
6.1. Hydro (H2)
Hydro là một chất khử mạnh, được sử dụng rộng rãi trong công nghiệp hóa chất và luyện kim. Hydro có khả năng khử nhiều oxit kim loại thành kim loại tự do.
6.2. Than Cốc (C)
Than cốc là một chất khử phổ biến trong công nghiệp luyện kim, đặc biệt là trong sản xuất thép. Than cốc có giá thành rẻ và dễ kiếm, làm cho nó trở thành một lựa chọn kinh tế.
6.3. Nhôm (Al)
Nhôm là một chất khử mạnh, được sử dụng trong quá trình nhiệt nhôm để khử các oxit kim loại khó khử như Cr2O3.
6.4. Các Kim Loại Kiềm Và Kiềm Thổ
Các kim loại kiềm (như Na, K) và kim loại kiềm thổ (như Mg, Ca) là các chất khử mạnh, được sử dụng trong các phản ứng đặc biệt cần tính khử cao.
6.5. Các Hợp Chất Chứa Ion Kim Loại Ở Trạng Thái Oxi Hóa Thấp
Các hợp chất như FeSO4, SnCl2, và Na2S2O3 cũng là các chất khử, được sử dụng trong nhiều ứng dụng khác nhau.
7. Cách Lập Phương Trình Phản Ứng Oxi Hóa – Khử
Để lập phương trình phản ứng oxi hóa – khử, chúng ta có thể sử dụng phương pháp thăng bằng electron. Phương pháp này bao gồm các bước sau:
7.1. Bước 1: Xác Định Số Oxi Hóa Của Các Nguyên Tố
Xác định số oxi hóa của tất cả các nguyên tố trong phản ứng để nhận biết các nguyên tố có số oxi hóa thay đổi.
7.2. Bước 2: Viết Quá Trình Oxi Hóa Và Quá Trình Khử
Viết riêng các quá trình oxi hóa và khử, cân bằng số lượng nguyên tử và điện tích trong mỗi quá trình.
7.3. Bước 3: Cân Bằng Số Electron Nhường Và Nhận
Tìm bội số chung nhỏ nhất của số electron nhường và nhận, sau đó nhân các quá trình với các hệ số thích hợp để số electron nhường bằng số electron nhận.
7.4. Bước 4: Cộng Các Quá Trình Và Rút Gọn
Cộng các quá trình oxi hóa và khử đã cân bằng, sau đó rút gọn để được phương trình phản ứng hoàn chỉnh.
7.5. Bước 5: Kiểm Tra Và Hoàn Thiện
Kiểm tra lại phương trình để đảm bảo số lượng nguyên tử của mỗi nguyên tố và điện tích ở hai vế bằng nhau.
8. Các Yếu Tố Ảnh Hưởng Đến Khả Năng Khử Của Một Chất
Khả năng khử của một chất phụ thuộc vào nhiều yếu tố, bao gồm:
8.1. Điện Âm
Các nguyên tố có điện âm thấp thường có khả năng khử mạnh hơn, vì chúng dễ dàng nhường electron.
8.2. Năng Lượng Ion Hóa
Các nguyên tố có năng lượng ion hóa thấp thường có khả năng khử mạnh hơn, vì chúng dễ dàng mất electron.
8.3. Cấu Hình Electron
Cấu hình electron của nguyên tử cũng ảnh hưởng đến khả năng khử. Các nguyên tử có xu hướng đạt cấu hình electron bền vững bằng cách nhường electron thường là các chất khử mạnh.
8.4. Môi Trường Phản Ứng
Môi trường phản ứng (pH, dung môi, nhiệt độ) cũng có thể ảnh hưởng đến khả năng khử của một chất.
9. Ứng Dụng Thực Tế Của Phản Ứng Oxi Hóa – Khử Trong Đời Sống
Phản ứng oxi hóa – khử có rất nhiều ứng dụng quan trọng trong đời sống hàng ngày.
9.1. Trong Pin Và Ắc Quy
Pin và ắc quy hoạt động dựa trên các phản ứng oxi hóa – khử để tạo ra dòng điện. Ví dụ, trong pin lithium-ion, lithium bị oxi hóa để tạo ra electron, electron này di chuyển qua mạch ngoài để thực hiện công, sau đó trở lại để khử một chất khác.
9.2. Trong Quá Trình Hô Hấp
Quá trình hô hấp của con người và động vật là một chuỗi các phản ứng oxi hóa – khử phức tạp, trong đó glucose bị oxi hóa để tạo ra năng lượng, CO2 và H2O.
9.3. Trong Quá Trình Quang Hợp
Quá trình quang hợp của cây xanh là một phản ứng oxi hóa – khử, trong đó CO2 và H2O được khử để tạo ra glucose và O2.
9.4. Trong Chống Ăn Mòn Kim Loại
Các phản ứng oxi hóa – khử được sử dụng để bảo vệ kim loại khỏi bị ăn mòn. Ví dụ, mạ kẽm (galvanizing) là quá trình phủ một lớp kẽm lên bề mặt sắt thép để bảo vệ chúng khỏi bị oxi hóa.
9.5. Trong Phân Tích Hóa Học
Các phản ứng oxi hóa – khử được sử dụng trong nhiều phương pháp phân tích hóa học để xác định nồng độ của các chất. Ví dụ, chuẩn độ oxi hóa – khử (redox titration) là một phương pháp phổ biến để xác định nồng độ của các chất oxi hóa hoặc chất khử trong dung dịch.
10. Các Câu Hỏi Thường Gặp Về Chất Khử (FAQ)
Dưới đây là một số câu hỏi thường gặp về chất khử, cùng với câu trả lời chi tiết để giúp bạn hiểu rõ hơn về chủ đề này.
10.1. Chất khử có phải luôn là kim loại không?
Không, chất khử không nhất thiết phải là kim loại. Nhiều phi kim và hợp chất cũng có thể là chất khử. Ví dụ, hydro (H2) và than cốc (C) là các chất khử phi kim phổ biến.
10.2. Làm thế nào để nhận biết một chất là chất khử?
Để nhận biết một chất là chất khử, bạn cần xác định số oxi hóa của các nguyên tố trong chất đó trước và sau phản ứng. Nếu số oxi hóa của một nguyên tố tăng lên, chất đó là chất khử.
10.3. Tại sao chất khử lại nhường electron?
Chất khử nhường electron để đạt được cấu hình electron bền vững hơn. Quá trình nhường electron giúp chất khử trở nên ổn định hơn về mặt năng lượng.
10.4. Chất oxi hóa và chất khử có thể tồn tại độc lập không?
Không, chất oxi hóa và chất khử không thể tồn tại độc lập trong một phản ứng. Sự oxi hóa và sự khử luôn diễn ra đồng thời, vì electron phải được chuyển từ chất khử sang chất oxi hóa.
10.5. Chất khử mạnh có nguy hiểm không?
Một số chất khử mạnh có thể gây nguy hiểm vì chúng có thể phản ứng mạnh với các chất khác, gây cháy nổ hoặc tạo ra các sản phẩm độc hại.
10.6. Chất khử có ứng dụng trong y học không?
Có, chất khử có nhiều ứng dụng trong y học. Ví dụ, các chất chống oxi hóa như vitamin C và glutathione được sử dụng để bảo vệ tế bào khỏi tổn thương do các gốc tự do gây ra.
10.7. Làm thế nào để bảo quản chất khử an toàn?
Để bảo quản chất khử an toàn, bạn cần tuân thủ các quy tắc sau:
- Lưu trữ chất khử trong các容器 kín, tránh tiếp xúc với không khí và ánh sáng.
- Để chất khử xa các chất oxi hóa mạnh và các chất dễ cháy nổ.
- Đọc kỹ hướng dẫn sử dụng và tuân thủ các biện pháp an toàn khi làm việc với chất khử.
10.8. Tại sao cần cân bằng phương trình phản ứng oxi hóa khử?
Cân bằng phương trình phản ứng oxi hóa khử đảm bảo rằng số lượng nguyên tử của mỗi nguyên tố và điện tích ở hai vế của phương trình bằng nhau, tuân thủ định luật bảo toàn khối lượng và điện tích.
10.9. Phương pháp thăng bằng electron có phải là phương pháp duy nhất để cân bằng phương trình phản ứng oxi hóa khử không?
Không, ngoài phương pháp thăng bằng electron, còn có phương pháp ion-electron (phương pháp nửa phản ứng) cũng được sử dụng để cân bằng phương trình phản ứng oxi hóa khử.
10.10. Chất khử có thể tái tạo được không?
Một số chất khử có thể được tái tạo thông qua các quá trình hóa học hoặc điện hóa. Ví dụ, các chất chống oxi hóa trong cơ thể có thể được tái tạo thông qua các phản ứng enzyme.
Kết Luận
Chất khử là chất có số oxi hóa tăng sau phản ứng, đóng vai trò quan trọng trong nhiều quá trình hóa học, công nghiệp và sinh học. Hiểu rõ về chất khử, chất oxi hóa và các phản ứng liên quan giúp chúng ta ứng dụng hiệu quả các kiến thức này vào thực tiễn. Nếu bạn đang tìm kiếm thông tin chi tiết và đáng tin cậy về xe tải ở Mỹ Đình, hãy truy cập XETAIMYDINH.EDU.VN để được tư vấn và giải đáp mọi thắc mắc.
Xe Tải Mỹ Đình cam kết cung cấp thông tin chính xác và cập nhật nhất về các loại xe tải, giá cả, địa điểm mua bán uy tín và dịch vụ sửa chữa chất lượng. Đừng ngần ngại liên hệ với chúng tôi qua địa chỉ Số 18 đường Mỹ Đình, phường Mỹ Đình 2, quận Nam Từ Liêm, Hà Nội hoặc hotline 0247 309 9988 để được hỗ trợ tốt nhất. Chúng tôi luôn sẵn lòng đồng hành cùng bạn trên mọi nẻo đường.