Cấu Trúc 4 Bậc Của Protein mô tả sự tổ chức phức tạp của phân tử protein, quyết định chức năng sinh học của chúng; Xe Tải Mỹ Đình sẽ giúp bạn hiểu rõ hơn về vấn đề này. Bài viết này sẽ cung cấp cái nhìn sâu sắc về từng bậc cấu trúc, từ trình tự axit amin đến sự tương tác giữa các chuỗi polypeptide, đồng thời làm rõ tầm quan trọng của chúng đối với sức khỏe và các ứng dụng trong ngành vận tải. Hãy cùng khám phá sâu hơn về các cấp độ cấu trúc protein và vai trò của chúng nhé!
1. Cấu Trúc Bậc 1 Của Protein Là Gì?
Cấu trúc bậc 1 của protein là trình tự tuyến tính của các axit amin trong chuỗi polypeptide. Trình tự này được xác định bởi thông tin di truyền trong DNA và được liên kết với nhau bằng các liên kết peptide.
1.1. Bản Chất Của Cấu Trúc Bậc 1
Cấu trúc bậc 1, còn được gọi là trình tự axit amin, là nền tảng cơ bản nhất của một phân tử protein. Nó xác định thứ tự chính xác của các axit amin được liên kết với nhau thông qua liên kết peptide, tạo thành chuỗi polypeptide.
- Định nghĩa: Trình tự các axit amin trong chuỗi polypeptide.
- Liên kết peptide: Liên kết hóa học hình thành giữa nhóm carboxyl của một axit amin và nhóm amino của axit amin kế tiếp.
- Vai trò: Cấu trúc bậc 1 đóng vai trò như một bản thiết kế, quyết định các bậc cấu trúc cao hơn của protein (cấu trúc bậc 2, 3, và 4) và do đó, chức năng sinh học của nó.
1.2. Tầm Quan Trọng Của Trình Tự Axit Amin
Trình tự axit amin không chỉ đơn thuần là một danh sách các thành phần; nó là yếu tố then chốt quyết định hình dạng ba chiều và chức năng của protein. Một sự thay đổi nhỏ trong trình tự này có thể dẫn đến những thay đổi lớn trong cấu trúc và hoạt động của protein, thậm chí gây ra bệnh tật.
- Độ đặc hiệu: Mỗi protein có một trình tự axit amin độc đáo, được mã hóa bởi gen tương ứng. Sự đặc hiệu này đảm bảo rằng protein thực hiện đúng chức năng của nó trong tế bào.
- Ảnh hưởng đến cấu trúc: Trình tự axit amin quyết định cách chuỗi polypeptide gấp lại và xoắn lại để tạo thành cấu trúc bậc 2 và bậc 3. Các tương tác giữa các gốc R của axit amin (kỵ nước, ưa nước, tích điện, v.v.) đóng vai trò quan trọng trong quá trình này.
- Liên quan đến bệnh tật: Nhiều bệnh di truyền phát sinh do đột biến trong gen mã hóa protein, dẫn đến thay đổi trình tự axit amin. Ví dụ, bệnh hồng cầu hình liềm là do một đột biến duy nhất trong gen beta-globin, thay thế axit glutamic bằng valine.
1.3. Ví Dụ Minh Họa Về Cấu Trúc Bậc 1
Để hiểu rõ hơn về tầm quan trọng của cấu trúc bậc 1, hãy xem xét một vài ví dụ cụ thể:
- Insulin: Hormone này bao gồm hai chuỗi polypeptide (A và B) được liên kết với nhau bằng các cầu disulfide. Trình tự axit amin chính xác của mỗi chuỗi là rất quan trọng để insulin có thể liên kết với thụ thể của nó và điều chỉnh lượng đường trong máu.
- Hemoglobin: Protein vận chuyển oxy trong hồng cầu này bao gồm bốn chuỗi polypeptide (hai alpha và hai beta). Trình tự axit amin của mỗi chuỗi quyết định khả năng liên kết oxy của hemoglobin.
- Enzyme: Các enzyme có trình tự axit amin đặc biệt cho phép chúng liên kết với các chất nền cụ thể và xúc tác các phản ứng hóa học một cách hiệu quả.
1.4. Phương Pháp Xác Định Cấu Trúc Bậc 1
Việc xác định trình tự axit amin của một protein là một quá trình phức tạp, đòi hỏi các kỹ thuật tiên tiến.
- Giải trình tự Edman: Phương pháp này sử dụng các phản ứng hóa học để loại bỏ từng axit amin từ đầu N của chuỗi polypeptide và xác định chúng.
- Sắc ký khối phổ (Mass spectrometry): Kỹ thuật này đo tỷ lệ khối lượng trên điện tích của các peptide và cho phép xác định trình tự axit amin một cách chính xác.
- Phân tích DNA: Trình tự axit amin của một protein có thể được suy ra từ trình tự nucleotide của gen mã hóa nó.
1.5. Tóm Tắt
Cấu trúc bậc 1 của protein là trình tự axit amin, nền tảng cho các bậc cấu trúc cao hơn và chức năng của protein. Sự chính xác của trình tự này rất quan trọng để đảm bảo protein hoạt động đúng cách và duy trì sức khỏe.
2. Cấu Trúc Bậc 2 Của Protein Hình Thành Như Thế Nào?
Cấu trúc bậc 2 của protein hình thành do sự gấp khúc cục bộ của chuỗi polypeptide, tạo ra các cấu trúc ổn định như alpha helix và beta sheet, được giữ vững bởi các liên kết hydro giữa các nhóm peptide.
2.1. Các Yếu Tố Hình Thành Cấu Trúc Bậc 2
Cấu trúc bậc 2 của protein là kết quả của sự tương tác giữa các axit amin gần nhau trong chuỗi polypeptide, chủ yếu thông qua liên kết hydro.
- Liên kết hydro: Liên kết yếu hình thành giữa nguyên tử hydro mang điện tích dương một phần và một nguyên tử âm điện như oxy hoặc nitơ. Trong cấu trúc bậc 2 của protein, liên kết hydro hình thành giữa nhóm carbonyl (C=O) của một axit amin và nhóm amino (N-H) của một axit amin khác.
- Alpha helix (α-helix): Cấu trúc xoắn ốc chặt chẽ, trong đó chuỗi polypeptide cuộn lại quanh một trục tưởng tượng. Các liên kết hydro hình thành giữa các axit amin cách nhau bốn vị trí trong chuỗi.
- Beta sheet (β-sheet): Cấu trúc dạng tấm, trong đó các chuỗi polypeptide (hoặc các phần của cùng một chuỗi) nằm song song hoặc đối song song với nhau. Các liên kết hydro hình thành giữa các chuỗi liền kề.
2.2. Đặc Điểm Của Alpha Helix Và Beta Sheet
Alpha helix và beta sheet là hai loại cấu trúc bậc 2 phổ biến nhất, mỗi loại có những đặc điểm riêng biệt.
- Alpha helix:
- Hình dạng: Xoắn ốc, với các axit amin nhô ra phía ngoài.
- Độ ổn định: Được giữ vững bởi các liên kết hydro giữa các axit amin cách nhau bốn vị trí.
- Ví dụ: Tìm thấy trong myoglobin và hemoglobin.
- Beta sheet:
- Hình dạng: Tấm gấp nếp, với các chuỗi polypeptide nằm song song hoặc đối song song.
- Độ ổn định: Được giữ vững bởi các liên kết hydro giữa các chuỗi liền kề.
- Ví dụ: Tìm thấy trong fibroin (tơ tằm) và một số enzyme.
2.3. Các Loại Cấu Trúc Bậc 2 Khác
Ngoài alpha helix và beta sheet, còn có các loại cấu trúc bậc 2 khác, mặc dù ít phổ biến hơn.
- Beta turn (β-turn): Cấu trúc ngắn, giúp chuỗi polypeptide đổi hướng.
- Random coil: Các đoạn chuỗi polypeptide không có cấu trúc bậc 2 ổn định.
2.4. Ảnh Hưởng Của Cấu Trúc Bậc 2 Đến Chức Năng Protein
Cấu trúc bậc 2 đóng vai trò quan trọng trong việc xác định hình dạng ba chiều của protein và do đó, ảnh hưởng đến chức năng của nó.
- Độ ổn định: Các cấu trúc alpha helix và beta sheet giúp ổn định cấu trúc tổng thể của protein.
- Liên kết: Các cấu trúc bậc 2 có thể tạo thành các vị trí liên kết cho các phân tử khác, chẳng hạn như chất nền của enzyme hoặc kháng thể.
- Tính linh hoạt: Các đoạn chuỗi polypeptide không có cấu trúc bậc 2 ổn định có thể cho phép protein thay đổi hình dạng để thực hiện chức năng của nó.
2.5. Phương Pháp Nghiên Cứu Cấu Trúc Bậc 2
Có nhiều phương pháp khác nhau được sử dụng để nghiên cứu cấu trúc bậc 2 của protein.
- Phổ CD (Circular Dichroism Spectroscopy): Kỹ thuật này đo sự hấp thụ khác nhau của ánh sáng phân cực tròn bởi các cấu trúc alpha helix và beta sheet.
- Phổ Raman: Kỹ thuật này sử dụng sự tán xạ ánh sáng để xác định các rung động của các liên kết hóa học trong protein, từ đó suy ra thông tin về cấu trúc bậc 2.
- Dự đoán cấu trúc: Các thuật toán máy tính có thể được sử dụng để dự đoán cấu trúc bậc 2 của protein dựa trên trình tự axit amin của nó.
2.6. Tóm Tắt
Cấu trúc bậc 2 của protein hình thành do sự gấp khúc cục bộ của chuỗi polypeptide, tạo ra các cấu trúc ổn định như alpha helix và beta sheet. Các cấu trúc này được giữ vững bởi các liên kết hydro và đóng vai trò quan trọng trong việc xác định hình dạng ba chiều và chức năng của protein.
3. Cấu Trúc Bậc 3 Của Protein Định Hình Như Thế Nào?
Cấu trúc bậc 3 của protein là hình dạng ba chiều hoàn chỉnh của một chuỗi polypeptide, được hình thành do sự tương tác giữa các gốc R của axit amin, bao gồm liên kết disulfide, tương tác kỵ nước, liên kết ion và liên kết hydro.
3.1. Các Lực Tương Tác Trong Cấu Trúc Bậc 3
Cấu trúc bậc 3 của protein là kết quả của sự tương tác giữa các gốc R (chuỗi bên) của các axit amin trong chuỗi polypeptide. Các lực tương tác này bao gồm:
- Liên kết disulfide: Liên kết cộng hóa trị mạnh hình thành giữa các gốc cysteine.
- Tương tác kỵ nước: Các gốc kỵ nước có xu hướng tập trung ở bên trong protein, tránh tiếp xúc với nước.
- Liên kết ion (liên kết muối): Lực hút tĩnh điện giữa các gốc tích điện trái dấu.
- Liên kết hydro: Liên kết yếu hình thành giữa các nguyên tử hydro và các nguyên tử âm điện.
- Lực Van der Waals: Lực hút yếu giữa các nguyên tử gần nhau.
3.2. Vai Trò Của Các Lực Tương Tác
Mỗi loại lực tương tác đóng một vai trò riêng trong việc định hình cấu trúc bậc 3 của protein.
- Liên kết disulfide: Giúp ổn định cấu trúc protein, đặc biệt là trong môi trường khắc nghiệt.
- Tương tác kỵ nước: Góp phần tạo ra lõi kỵ nước của protein, giúp protein gấp lại đúng cách.
- Liên kết ion: Giúp ổn định cấu trúc protein và tạo ra các vị trí liên kết cho các phân tử khác.
- Liên kết hydro: Giúp ổn định cấu trúc protein và tạo ra các vị trí liên kết cho các phân tử khác.
- Lực Van der Waals: Góp phần vào sự ổn định tổng thể của cấu trúc protein.
3.3. Domain Protein
Một domain protein là một phần của chuỗi polypeptide có thể gấp lại và hoạt động độc lập với các phần khác của protein. Nhiều protein lớn bao gồm nhiều domain khác nhau, mỗi domain có một chức năng riêng biệt.
- Ví dụ: Một enzyme có thể có một domain liên kết với chất nền và một domain xúc tác phản ứng hóa học.
3.4. Chaperone Protein
Chaperone protein là các protein giúp các protein khác gấp lại đúng cách. Chúng ngăn chặn sự kết tập không mong muốn của các protein và đảm bảo rằng protein đạt được cấu trúc ba chiều chính xác của nó.
- Cơ chế hoạt động: Chaperone protein liên kết với các protein đang gấp lại và ngăn chặn chúng kết tập lại với nhau. Chúng cũng có thể giúp protein gấp lại bằng cách cung cấp một môi trường bảo vệ.
3.5. Ảnh Hưởng Của Cấu Trúc Bậc 3 Đến Chức Năng Protein
Cấu trúc bậc 3 là yếu tố quyết định chức năng của protein. Hình dạng ba chiều của protein xác định khả năng liên kết với các phân tử khác, chẳng hạn như chất nền của enzyme hoặc kháng thể.
- Ví dụ: Enzyme có một vị trí hoạt động, là một khe hoặc túi trên bề mặt protein có hình dạng phù hợp với chất nền của nó.
3.6. Phương Pháp Nghiên Cứu Cấu Trúc Bậc 3
Có nhiều phương pháp khác nhau được sử dụng để nghiên cứu cấu trúc bậc 3 của protein.
- Tinh thể học tia X (X-ray crystallography): Phương pháp này sử dụng tia X để xác định vị trí của các nguyên tử trong protein.
- Cộng hưởng từ hạt nhân (Nuclear Magnetic Resonance – NMR) spectroscopy: Kỹ thuật này sử dụng từ trường để xác định cấu trúc của protein trong dung dịch.
- Kính hiển vi điện tử cryo (Cryo-electron microscopy): Kỹ thuật này sử dụng chùm electron để tạo ra hình ảnh của protein ở nhiệt độ rất thấp.
3.7. Tóm Tắt
Cấu trúc bậc 3 của protein là hình dạng ba chiều hoàn chỉnh của một chuỗi polypeptide, được hình thành do sự tương tác giữa các gốc R của axit amin. Cấu trúc này là yếu tố quyết định chức năng của protein và được nghiên cứu bằng nhiều phương pháp khác nhau.
4. Cấu Trúc Bậc 4 Của Protein Xuất Hiện Khi Nào?
Cấu trúc bậc 4 của protein xuất hiện khi một protein bao gồm hai hoặc nhiều chuỗi polypeptide (subunit) kết hợp với nhau để tạo thành một phức hợp protein hoàn chỉnh.
4.1. Khái Niệm Về Cấu Trúc Bậc 4
Cấu trúc bậc 4 là mức độ tổ chức cao nhất của protein, chỉ áp dụng cho các protein có cấu tạo từ hai hoặc nhiều chuỗi polypeptide riêng biệt, được gọi là các subunit. Cấu trúc này mô tả cách các subunit sắp xếp và tương tác với nhau trong không gian ba chiều để tạo thành protein hoàn chỉnh.
- Protein đa phân (multimeric protein): Protein có cấu trúc bậc 4, bao gồm nhiều subunit.
- Subunit: Chuỗi polypeptide riêng lẻ tạo nên protein đa phân.
- Tương tác giữa các subunit: Các subunit được giữ với nhau bởi các lực tương tác không cộng hóa trị, chẳng hạn như liên kết hydro, tương tác kỵ nước và liên kết ion.
4.2. Các Loại Protein Có Cấu Trúc Bậc 4
Không phải tất cả các protein đều có cấu trúc bậc 4. Chỉ những protein bao gồm hai hoặc nhiều subunit mới có cấu trúc này.
- Hemoglobin: Protein vận chuyển oxy trong hồng cầu, bao gồm bốn subunit (hai alpha và hai beta).
- Kháng thể (Antibodies): Protein miễn dịch bao gồm hai chuỗi nặng và hai chuỗi nhẹ.
- DNA polymerase: Enzyme sao chép DNA, bao gồm nhiều subunit.
4.3. Tầm Quan Trọng Của Cấu Trúc Bậc 4
Cấu trúc bậc 4 đóng vai trò quan trọng trong việc xác định chức năng của protein.
- Độ ổn định: Sự tương tác giữa các subunit có thể giúp ổn định cấu trúc tổng thể của protein.
- Tính hợp tác: Trong một số protein, sự liên kết của một phân tử với một subunit có thể ảnh hưởng đến khả năng liên kết của các subunit khác. Điều này được gọi là tính hợp tác (cooperativity). Ví dụ, sự liên kết của oxy với một subunit của hemoglobin làm tăng ái lực của các subunit khác đối với oxy.
- Điều hòa: Cấu trúc bậc 4 có thể cho phép protein được điều hòa bởi các phân tử khác. Ví dụ, sự liên kết của một phân tử điều hòa với một subunit có thể làm thay đổi cấu trúc của protein và ảnh hưởng đến hoạt động của nó.
4.4. Các Lực Tương Tác Giữa Các Subunit
Các subunit trong protein có cấu trúc bậc 4 được giữ với nhau bởi các lực tương tác không cộng hóa trị, tương tự như các lực tương tác trong cấu trúc bậc 3.
- Liên kết hydro: Liên kết yếu hình thành giữa các nguyên tử hydro và các nguyên tử âm điện.
- Tương tác kỵ nước: Các gốc kỵ nước có xu hướng tập trung ở bên trong protein, tránh tiếp xúc với nước.
- Liên kết ion (liên kết muối): Lực hút tĩnh điện giữa các gốc tích điện trái dấu.
- Lực Van der Waals: Lực hút yếu giữa các nguyên tử gần nhau.
4.5. Phương Pháp Nghiên Cứu Cấu Trúc Bậc 4
Các phương pháp được sử dụng để nghiên cứu cấu trúc bậc 4 của protein tương tự như các phương pháp được sử dụng để nghiên cứu cấu trúc bậc 3.
- Tinh thể học tia X (X-ray crystallography): Phương pháp này sử dụng tia X để xác định vị trí của các nguyên tử trong protein.
- Cộng hưởng từ hạt nhân (Nuclear Magnetic Resonance – NMR) spectroscopy: Kỹ thuật này sử dụng từ trường để xác định cấu trúc của protein trong dung dịch.
- Kính hiển vi điện tử cryo (Cryo-electron microscopy): Kỹ thuật này sử dụng chùm electron để tạo ra hình ảnh của protein ở nhiệt độ rất thấp.
4.6. Ví Dụ Về Cấu Trúc Bậc 4
Hemoglobin là một ví dụ điển hình về protein có cấu trúc bậc 4. Nó bao gồm bốn subunit: hai chuỗi alpha-globin và hai chuỗi beta-globin. Mỗi chuỗi chứa một phân tử heme, nơi oxy liên kết.
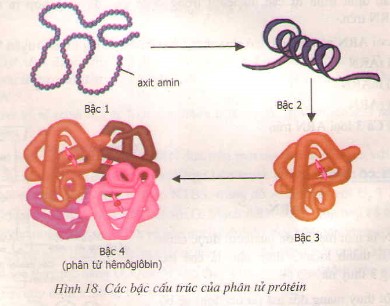 Cấu trúc bậc 4 của hemoglobin
Cấu trúc bậc 4 của hemoglobin
4.7. Tóm Tắt
Cấu trúc bậc 4 của protein xuất hiện khi một protein bao gồm hai hoặc nhiều subunit kết hợp với nhau để tạo thành một phức hợp protein hoàn chỉnh. Cấu trúc này đóng vai trò quan trọng trong việc xác định chức năng của protein và được nghiên cứu bằng nhiều phương pháp khác nhau.
5. Tại Sao Cấu Trúc Của Protein Lại Quan Trọng?
Cấu trúc của protein quan trọng vì nó quyết định chức năng sinh học của protein. Một protein phải có cấu trúc ba chiều chính xác để thực hiện đúng chức năng của nó.
5.1. Mối Quan Hệ Giữa Cấu Trúc Và Chức Năng
Mối quan hệ giữa cấu trúc và chức năng là một nguyên tắc cơ bản trong sinh học. Cấu trúc ba chiều của một protein, được xác định bởi trình tự axit amin và các tương tác giữa các axit amin, quyết định khả năng liên kết với các phân tử khác và thực hiện các phản ứng hóa học.
- Độ đặc hiệu: Protein có cấu trúc độc đáo cho phép chúng liên kết với các phân tử cụ thể. Ví dụ, một enzyme có một vị trí hoạt động có hình dạng phù hợp với chất nền của nó.
- Hoạt động xúc tác: Enzyme sử dụng cấu trúc ba chiều của chúng để xúc tác các phản ứng hóa học một cách hiệu quả. Vị trí hoạt động của enzyme tạo ra một môi trường tối ưu cho phản ứng xảy ra.
- Vận chuyển: Các protein vận chuyển, chẳng hạn như hemoglobin, sử dụng cấu trúc của chúng để liên kết và vận chuyển các phân tử khác.
5.2. Điều Gì Xảy Ra Nếu Cấu Trúc Protein Bị Thay Đổi?
Nếu cấu trúc của một protein bị thay đổi, nó có thể mất chức năng của nó. Điều này có thể xảy ra do nhiều yếu tố, chẳng hạn như nhiệt độ cao, pH khắc nghiệt hoặc sự hiện diện của các chất hóa học.
- Sự biến tính (Denaturation): Quá trình làm mất cấu trúc ba chiều của protein, dẫn đến mất chức năng.
- Đột biến: Thay đổi trong trình tự DNA có thể dẫn đến thay đổi trong trình tự axit amin của protein, làm thay đổi cấu trúc và chức năng của nó.
- Bệnh tật: Nhiều bệnh tật liên quan đến sự gấp sai của protein. Ví dụ, bệnh Alzheimer liên quan đến sự tích tụ của các protein amyloid gấp sai trong não.
5.3. Các Ứng Dụng Của Việc Nghiên Cứu Cấu Trúc Protein
Việc nghiên cứu cấu trúc protein có nhiều ứng dụng quan trọng.
- Phát triển thuốc: Hiểu cấu trúc của protein có thể giúp các nhà khoa học thiết kế các loại thuốc liên kết với protein và thay đổi hoạt động của chúng.
- Công nghệ sinh học: Các protein có thể được thiết kế để thực hiện các chức năng mới. Ví dụ, các enzyme có thể được thiết kế để xúc tác các phản ứng hóa học mới.
- Y học: Hiểu cấu trúc của protein có thể giúp các nhà khoa học phát triển các phương pháp điều trị mới cho các bệnh liên quan đến sự gấp sai của protein.
5.4. Các Yếu Tố Ảnh Hưởng Đến Cấu Trúc Protein
Nhiều yếu tố có thể ảnh hưởng đến cấu trúc của protein, bao gồm:
- Nhiệt độ: Nhiệt độ cao có thể làm biến tính protein.
- pH: pH khắc nghiệt có thể làm biến tính protein.
- Các chất hóa học: Một số chất hóa học có thể làm biến tính protein.
- Ion kim loại: Một số ion kim loại có thể liên kết với protein và thay đổi cấu trúc của chúng.
5.5. Tóm Tắt
Cấu trúc của protein quan trọng vì nó quyết định chức năng sinh học của protein. Sự thay đổi trong cấu trúc protein có thể dẫn đến mất chức năng và bệnh tật. Việc nghiên cứu cấu trúc protein có nhiều ứng dụng quan trọng trong phát triển thuốc, công nghệ sinh học và y học.
6. Cấu Trúc 4 Bậc Của Protein Liên Hệ Thế Nào Đến Vận Tải Hàng Hóa?
Mặc dù cấu trúc 4 bậc của protein là một khái niệm sinh học, nhưng nó có thể liên hệ đến vận tải hàng hóa thông qua việc nghiên cứu và ứng dụng các vật liệu sinh học và enzyme trong quá trình vận chuyển và bảo quản hàng hóa.
6.1. Ứng Dụng Vật Liệu Sinh Học
- Bao bì phân hủy sinh học: Nghiên cứu cấu trúc protein giúp tạo ra các vật liệu bao bì phân hủy sinh học từ protein thực vật hoặc động vật. Các vật liệu này có thể thay thế bao bì nhựa truyền thống, giảm thiểu ô nhiễm môi trường trong quá trình vận chuyển.
- Màng protein bảo quản thực phẩm: Sử dụng màng protein để bảo quản thực phẩm trong quá trình vận chuyển. Cấu trúc protein đặc biệt giúp kiểm soát độ ẩm, oxy hóa và sự phát triển của vi sinh vật, kéo dài thời gian bảo quản và giảm lãng phí thực phẩm.
6.2. Sử Dụng Enzyme Trong Vận Tải Hàng Hóa
- Enzyme làm sạch: Sử dụng enzyme để làm sạch các bề mặt vận chuyển như thùng chứa, xe tải và tàu thuyền. Enzyme có khả năng phân hủy các chất bẩn hữu cơ một cách hiệu quả, giảm thiểu ô nhiễm và đảm bảo an toàn vệ sinh trong quá trình vận chuyển.
- Enzyme phân hủy chất thải: Sử dụng enzyme để phân hủy chất thải hữu cơ trong quá trình vận chuyển, giảm khối lượng chất thải và tạo ra các sản phẩm có giá trị như phân bón hoặc năng lượng sinh học.
6.3. Nghiên Cứu Độ Bền Vật Liệu
- Protein tơ nhện: Nghiên cứu cấu trúc protein tơ nhện để tạo ra các vật liệu siêu bền, có thể ứng dụng trong sản xuất dây thừng, lưới và các vật liệu gia cố khác trong vận tải hàng hóa.
- Protein keo dính: Nghiên cứu cấu trúc protein keo dính của các loài sinh vật biển để tạo ra các chất kết dính tự nhiên, có khả năng chịu nước và chịu lực tốt, ứng dụng trong xây dựng và sửa chữa các công trình vận tải như cầu cảng và tàu thuyền.
6.4. Cảm Biến Sinh Học
- Cảm biến phát hiện chất độc: Sử dụng protein để tạo ra các cảm biến sinh học có khả năng phát hiện các chất độc hại trong hàng hóa hoặc môi trường vận chuyển, đảm bảo an toàn cho người tiêu dùng và môi trường.
- Cảm biến theo dõi nhiệt độ: Sử dụng protein nhạy cảm với nhiệt độ để tạo ra các cảm biến theo dõi nhiệt độ hàng hóa trong quá trình vận chuyển, đảm bảo chất lượng và an toàn cho các mặt hàng dễ hư hỏng như thực phẩm và dược phẩm.
6.5. Ví Dụ Cụ Thể
- Sử dụng enzyme cellulase: Enzyme này có khả năng phân hủy cellulose, một thành phần chính của giấy và bìa carton. Trong vận tải, cellulase có thể được sử dụng để xử lý và tái chế bao bì giấy, giảm thiểu chất thải và tiết kiệm tài nguyên.
- Ứng dụng protein kháng khuẩn: Các protein kháng khuẩn tự nhiên có thể được sử dụng để phủ lên bề mặt các thùng chứa hoặc xe tải chở thực phẩm, ngăn chặn sự phát triển của vi khuẩn và kéo dài thời gian bảo quản thực phẩm.
6.6. Tóm Tắt
Mặc dù không trực tiếp liên quan đến hoạt động vận tải hàng hóa, cấu trúc 4 bậc của protein có thể được ứng dụng trong việc nghiên cứu và phát triển các vật liệu sinh học, enzyme và cảm biến sinh học, góp phần vào quá trình vận chuyển và bảo quản hàng hóa hiệu quả hơn, an toàn hơn và thân thiện với môi trường hơn.
7. Những Yếu Tố Nào Ảnh Hưởng Đến Cấu Trúc Của Protein?
Có nhiều yếu tố ảnh hưởng đến cấu trúc của protein, bao gồm nhiệt độ, pH, nồng độ muối, dung môi và sự hiện diện của các chất biến tính.
7.1. Nhiệt Độ
Nhiệt độ là một trong những yếu tố quan trọng nhất ảnh hưởng đến cấu trúc protein.
- Nhiệt độ thấp: Ở nhiệt độ thấp, protein có thể trở nên cứng nhắc và mất tính linh hoạt.
- Nhiệt độ cao: Ở nhiệt độ cao, protein có thể bị biến tính, mất cấu trúc ba chiều và chức năng ban đầu. Sự biến tính xảy ra khi các liên kết yếu (liên kết hydro, tương tác kỵ nước, liên kết ion) bị phá vỡ, làm cho protein mất đi hình dạng tự nhiên.
7.2. Độ pH
Độ pH của môi trường cũng ảnh hưởng đến cấu trúc protein.
- pH axit hoặc kiềm: pH quá axit hoặc quá kiềm có thể làm thay đổi điện tích của các nhóm chức trong protein, ảnh hưởng đến các tương tác ion và liên kết hydro, dẫn đến biến tính protein.
- pH tối ưu: Mỗi protein có một pH tối ưu, là pH mà protein hoạt động ổn định và hiệu quả nhất.
7.3. Nồng Độ Muối
Nồng độ muối trong dung dịch có thể ảnh hưởng đến các tương tác ion giữa các axit amin trong protein.
- Nồng độ muối thấp: Nồng độ muối thấp có thể làm tăng cường các tương tác ion, giúp ổn định cấu trúc protein.
- Nồng độ muối cao: Nồng độ muối cao có thể làm giảm các tương tác ion, dẫn đến biến tính protein.
7.4. Dung Môi
Dung môi mà protein hòa tan cũng có thể ảnh hưởng đến cấu trúc của nó.
- Dung môi phân cực: Protein thường ổn định hơn trong dung môi phân cực như nước, vì nước có thể tạo liên kết hydro với các nhóm chức của protein.
- Dung môi không phân cực: Protein có thể bị biến tính trong dung môi không phân cực, vì các tương tác kỵ nước giữa các axit amin trong protein bị suy yếu.
7.5. Chất Biến Tính
Chất biến tính là các chất hóa học có thể làm biến tính protein.
- Urea và Guanidinium chloride: Các chất này phá vỡ các liên kết hydro và tương tác kỵ nước trong protein, dẫn đến biến tính.
- Detergent (chất tẩy rửa): Detergent có thể phá vỡ các tương tác kỵ nước và làm biến tính protein.
7.6. Các Yếu Tố Khác
Ngoài các yếu tố trên, còn có một số yếu tố khác có thể ảnh hưởng đến cấu trúc protein, bao gồm:
- Áp suất: Áp suất cao có thể làm thay đổi cấu trúc protein.
- Bức xạ: Bức xạ có thể làm hỏng protein và làm thay đổi cấu trúc của nó.
- Ion kim loại: Một số ion kim loại có thể liên kết với protein và làm thay đổi cấu trúc của chúng.
7.7. Tóm Tắt
Cấu trúc của protein rất nhạy cảm với môi trường xung quanh. Nhiệt độ, pH, nồng độ muối, dung môi và sự hiện diện của các chất biến tính đều có thể ảnh hưởng đến cấu trúc protein và làm thay đổi chức năng của nó.
8. Làm Thế Nào Để Ổn Định Cấu Trúc Protein?
Để ổn định cấu trúc protein, cần kiểm soát các yếu tố môi trường như nhiệt độ, pH và nồng độ muối, đồng thời sử dụng các chất bảo vệ protein và kỹ thuật ổn định protein.
8.1. Kiểm Soát Các Yếu Tố Môi Trường
- Nhiệt độ: Duy trì nhiệt độ ổn định và phù hợp với protein. Tránh nhiệt độ quá cao hoặc quá thấp.
- pH: Điều chỉnh pH của dung dịch để phù hợp với pH tối ưu của protein. Sử dụng buffer để duy trì pH ổn định.
- Nồng độ muối: Điều chỉnh nồng độ muối trong dung dịch để tối ưu hóa các tương tác ion trong protein.
8.2. Sử Dụng Chất Bảo Vệ Protein
Chất bảo vệ protein là các chất có thể giúp ổn định cấu trúc protein và ngăn ngừa biến tính.
- Glycerol: Glycerol là một chất bảo vệ protein phổ biến, có tác dụng ổn định cấu trúc protein và ngăn ngừa sự kết tập.
- Đường (Sucrose, Trehalose): Đường có thể tạo liên kết hydro với protein, giúp ổn định cấu trúc và ngăn ngừa biến tính.
- Polyethylene glycol (PEG): PEG là một polymer có thể giúp ổn định cấu trúc protein và ngăn ngừa sự kết tập.
- Amino acids (Arginine, Proline): Một số amino acid có thể giúp ổn định cấu trúc protein và ngăn ngừa biến tính.
8.3. Kỹ Thuật Ổn Định Protein
Có nhiều kỹ thuật khác nhau có thể được sử dụng để ổn định cấu trúc protein.
- Lyophilization (sấy đông khô): Kỹ thuật này loại bỏ nước khỏi protein bằng cách đông lạnh và sau đó giảm áp suất, giúp bảo quản protein trong thời gian dài.
- Cross-linking (liên kết chéo): Kỹ thuật này tạo ra các liên kết cộng hóa trị giữa các axit amin trong protein, giúp ổn định cấu trúc.
- Site-directed mutagenesis (đột biến định hướng vị trí): Kỹ thuật này thay đổi trình tự axit amin của protein để tăng cường độ ổn định của nó.
8.4. Các Phương Pháp Khác
- Sử dụng chaperone protein: Chaperone protein là các protein tự nhiên có tác dụng giúp các protein khác gấp lại đúng cách và ngăn ngừa sự kết tập.
- Thiết kế protein: Thiết kế protein mới với độ ổn định cao hơn.
8.5. Ví Dụ Cụ Thể
- Bảo quản enzyme: Enzyme thường được bảo quản trong dung dịch glycerol hoặc đường để ngăn ngừa biến tính.
- Bảo quản kháng thể: Kháng thể thường được bảo quản bằng phương pháp lyophilization để kéo dài thời gian sử dụng.
8.6. Tóm Tắt
Để ổn định cấu trúc protein, cần kiểm soát các yếu tố môi trường, sử dụng các chất bảo vệ protein và áp dụng các kỹ thuật ổn định protein phù hợp. Việc lựa chọn phương pháp ổn định protein phù hợp phụ thuộc vào loại protein, ứng dụng và điều kiện bảo quản.
9. Các Loại Bệnh Nào Liên Quan Đến Cấu Trúc Protein Bị Lỗi?
Nhiều bệnh liên quan đến cấu trúc protein bị lỗi, bao gồm bệnh Alzheimer, bệnh Parkinson, bệnh Huntington, bệnh xơ nang và bệnh hồng cầu hình liềm.
9.1. Bệnh Alzheimer
Bệnh Alzheimer là một bệnh thoái hóa thần kinh tiến triển, đặc trưng bởi sự tích tụ của các mảng amyloid-beta và các đám rối нейроfibrillary trong não.
- Amyloid-beta: Peptide amyloid-beta được tạo ra từ protein tiền chất amyloid (APP). Trong bệnh Alzheimer, amyloid-beta bị gấp sai và kết tập lại thành các mảng amyloid, gây tổn thương tế bào thần kinh.
- Tau protein: Tau protein là một protein liên kết với vi ống, giúp ổn định cấu trúc của tế bào thần kinh. Trong bệnh Alzheimer, tau protein bị phosphoryl hóa quá mức và kết tập lại thành các đám rối нейроfibrillary, làm rối loạn chức năng của tế bào thần kinh.
9.2. Bệnh Parkinson
Bệnh Parkinson là một bệnh thoái hóa thần kinh tiến triển, đặc trưng bởi sự mất mát của các tế bào thần kinh sản xuất dopamine trong não.
- Alpha-synuclein: Alpha-synuclein là một protein được tìm thấy trong các tế bào thần kinh. Trong bệnh Parkinson, alpha-synuclein bị gấp sai và kết tập lại thành các thể Lewy, gây tổn thương tế bào thần kinh.
9.3. Bệnh Huntington
Bệnh Huntington là một bệnh di truyền thoái hóa thần kinh, gây ra bởi sự đột biến trong gen mã hóa protein huntingtin.
- Huntingtin protein: Huntingtin protein chứa một đoạn lặp lại của glutamine (polyQ). Trong bệnh Huntington, số lượng lặp lại của glutamine tăng lên, làm cho protein huntingtin bị gấp sai và kết tập lại, gây tổn thương tế bào thần kinh.
9.4. Bệnh Xơ Nang
Bệnh xơ nang là một bệnh di truyền ảnh hưởng đến phổi, tuyến tụy và các cơ quan khác.
- CFTR protein: CFTR protein là một protein kênh chloride. Trong bệnh xơ nang, đột biến trong gen CFTR làm cho protein CFTR bị gấp sai và không thể vận chuyển chloride qua màng tế bào, dẫn đến tích tụ chất nhầy trong phổi và các cơ quan khác.
9.5. Bệnh Hồng Cầu Hình Liềm
Bệnh hồng cầu hình liềm là một bệnh di truyền ảnh hưởng đến các tế bào hồng cầu.
- Hemoglobin: Hemoglobin là một protein vận chuyển oxy trong hồng cầu. Trong bệnh hồng cầu hình liềm, một đột biến trong gen beta-globin làm cho hemoglobin bị gấp sai và kết tập lại, làm cho các tế bào hồng cầu có hình dạng hình liềm và không thể vận chuyển oxy hiệu quả.
9.6. Các Bệnh Khác
Ngoài các bệnh trên, còn có nhiều bệnh khác liên quan đến cấu trúc protein bị lỗi, bao gồm:
- Bệnh bò điên (Bovine spongiform encephalopathy – BSE): Gây ra bởi prion, một loại protein bị gấp sai có khả năng lây nhiễm.
- Amyotrophic lateral sclerosis (ALS): Một bệnh thoái hóa thần kinh ảnh hưởng đến các tế bào thần kinh vận động.
- **Familial amyloid polyneuropathy (F