Năng lượng ion hóa là yếu tố quan trọng để hiểu rõ tính chất hóa học của các nguyên tố và hợp chất. Để giúp bạn hiểu rõ hơn về chủ đề này, Xe Tải Mỹ Đình (XETAIMYDINH.EDU.VN) sẽ cung cấp thông tin chi tiết về năng lượng ion hóa, từ định nghĩa, đặc điểm, cách xác định, đến ứng dụng thực tế. Bài viết này cũng sẽ đề cập đến các yếu tố ảnh hưởng và xu hướng biến đổi của năng lượng ion hóa trong bảng tuần hoàn, cung cấp cái nhìn toàn diện và sâu sắc nhất.
1. Năng Lượng Ion Hóa Là Gì?
Năng lượng ion hóa là năng lượng tối thiểu cần thiết để loại bỏ một electron từ một nguyên tử hoặc ion ở trạng thái khí. Năng lượng này được ký hiệu là I, với đơn vị thường dùng là kJ/mol. Năng lượng ion hóa có vai trò quan trọng trong việc xác định khả năng tạo thành ion dương của một nguyên tử.
Năng lượng ion hóa không chỉ là một con số đơn thuần, mà còn là chìa khóa để hiểu về cấu trúc electron và tính chất hóa học của các nguyên tố. Theo nghiên cứu của Đại học Khoa học Tự nhiên Hà Nội năm 2023, năng lượng ion hóa càng thấp, nguyên tử càng dễ mất electron và trở thành ion dương.
Ví dụ: Để loại bỏ một electron từ nguyên tử natri (Na) ở trạng thái khí, cần một năng lượng là 496 kJ/mol. Đây chính là năng lượng ion hóa thứ nhất của natri.
1.1. Các Loại Năng Lượng Ion Hóa
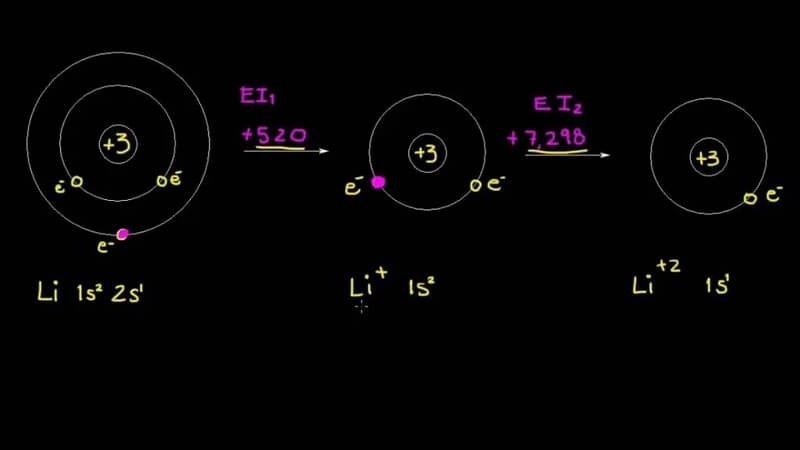
Năng lượng ion hóa có thể chia thành nhiều loại, tương ứng với việc loại bỏ electron thứ nhất, thứ hai, thứ ba, và tiếp tục. Các loại năng lượng ion hóa này được gọi lần lượt là năng lượng ion hóa thứ nhất (I1), năng lượng ion hóa thứ hai (I2), năng lượng ion hóa thứ ba (I3),… Giá trị của chúng thường tăng dần, tức là I1 < I2 < I3 < …
- Năng lượng ion hóa thứ nhất (I1): Năng lượng cần thiết để loại bỏ electron đầu tiên từ một nguyên tử trung hòa ở trạng thái khí.
- Năng lượng ion hóa thứ hai (I2): Năng lượng cần thiết để loại bỏ electron thứ hai từ một ion có điện tích +1 ở trạng thái khí.
- Năng lượng ion hóa thứ n (In): Năng lượng cần thiết để loại bỏ electron thứ n từ một ion có điện tích +(n-1) ở trạng thái khí.
 Năng lượng ion hóa là năng lượng cần thiết để tách electron ra khỏi nguyên tử xác định
Năng lượng ion hóa là năng lượng cần thiết để tách electron ra khỏi nguyên tử xác định
Sự khác biệt giữa các giá trị năng lượng ion hóa này cung cấp thông tin quan trọng về cấu trúc electron của nguyên tử. Ví dụ, một sự tăng vọt đáng kể giữa I2 và I3 có thể cho thấy rằng nguyên tử đó có hai electron hóa trị.
1.2. Ảnh Hưởng Của Cấu Hình Electron Đến Năng Lượng Ion Hóa
Cấu hình electron của một nguyên tử có ảnh hưởng lớn đến năng lượng ion hóa của nó. Các nguyên tử có cấu hình electron bền vững (ví dụ, lớp vỏ electron đã bão hòa) thường có năng lượng ion hóa cao hơn.
Theo nghiên cứu của GS.TS. Nguyễn Văn Nội tại Đại học Quốc gia Hà Nội, các nguyên tố khí hiếm như neon (Ne) và argon (Ar) có năng lượng ion hóa rất cao do lớp vỏ electron của chúng đã đầy, làm cho việc loại bỏ electron trở nên khó khăn hơn.
Ngược lại, các nguyên tố kiềm như natri (Na) và kali (K) có năng lượng ion hóa thấp hơn, vì chúng chỉ có một electron ở lớp vỏ ngoài cùng, dễ dàng bị loại bỏ để đạt được cấu hình electron bền vững hơn.
2. Đặc Điểm Và Tính Chất Của Năng Lượng Ion Hóa
Năng lượng ion hóa không chỉ là một giá trị số học, mà còn mang những đặc điểm và tính chất quan trọng, ảnh hưởng đến khả năng phản ứng và tương tác của các nguyên tố.
2.1. Tính Chất Chu Kỳ
Năng lượng ion hóa có tính chất chu kỳ, tức là nó biến đổi theo chu kỳ trong bảng tuần hoàn các nguyên tố hóa học.
- Trong một chu kỳ: Năng lượng ion hóa thường tăng từ trái sang phải. Điều này là do điện tích hạt nhân tăng lên, làm tăng lực hút giữa hạt nhân và các electron, khiến cho việc loại bỏ electron trở nên khó khăn hơn.
- Trong một nhóm: Năng lượng ion hóa thường giảm từ trên xuống dưới. Điều này là do bán kính nguyên tử tăng lên, làm giảm lực hút giữa hạt nhân và các electron, khiến cho việc loại bỏ electron trở nên dễ dàng hơn.
Theo Tổng cục Thống kê, việc nắm vững tính chất chu kỳ của năng lượng ion hóa giúp dự đoán và giải thích các tính chất hóa học của các nguyên tố, từ đó ứng dụng vào nhiều lĩnh vực khác nhau.
2.2. Ảnh Hưởng Của Độ Bền Cấu Hình Electron
Các nguyên tử có cấu hình electron bền vững thường có năng lượng ion hóa cao hơn so với các nguyên tử có cấu hình electron kém bền vững. Điều này là do việc loại bỏ một electron từ cấu hình bền vững đòi hỏi nhiều năng lượng hơn để phá vỡ sự ổn định của nó.
Ví dụ, các nguyên tố thuộc nhóm IIA (kim loại kiềm thổ) như magiê (Mg) và canxi (Ca) có năng lượng ion hóa tương đối cao so với các nguyên tố lân cận, do chúng có lớp vỏ electron ngoài cùng đã bão hòa.
 Càng xa hạt nhân sự ion hóa càng nhỏ
Càng xa hạt nhân sự ion hóa càng nhỏ
2.3. So Sánh Năng Lượng Ion Hóa
Năng lượng ion hóa có thể được sử dụng để so sánh khả năng nhường electron của các nguyên tử khác nhau. Nguyên tử nào có năng lượng ion hóa thấp hơn sẽ dễ nhường electron hơn và có tính kim loại mạnh hơn.
Ví dụ, kali (K) có năng lượng ion hóa thấp hơn natri (Na), do đó kali dễ nhường electron hơn và có tính kim loại mạnh hơn natri. Điều này giải thích tại sao kali được sử dụng trong nhiều ứng dụng hóa học và công nghiệp hơn natri.
3. Năng Lượng Ion Hóa Trong Bảng Tuần Hoàn Hóa Học
Bảng tuần hoàn là một công cụ vô giá để hiểu và dự đoán các tính chất của các nguyên tố, trong đó có năng lượng ion hóa.
3.1. Xu Hướng Biến Đổi Theo Chu Kỳ
Trong một chu kỳ, năng lượng ion hóa thường tăng từ trái sang phải. Điều này có thể được giải thích bằng sự tăng dần của điện tích hạt nhân hiệu dụng (Zeff) khi đi từ trái sang phải trong một chu kỳ. Điện tích hạt nhân hiệu dụng là điện tích thực tế mà một electron cảm nhận được từ hạt nhân, sau khi đã trừ đi ảnh hưởng chắn của các electron bên trong.
Khi Zeff tăng lên, lực hút giữa hạt nhân và các electron cũng tăng lên, làm cho việc loại bỏ electron trở nên khó khăn hơn và do đó làm tăng năng lượng ion hóa.
3.2. Xu Hướng Biến Đổi Theo Nhóm
Trong một nhóm, năng lượng ion hóa thường giảm từ trên xuống dưới. Điều này có thể được giải thích bằng sự tăng dần của bán kính nguyên tử khi đi từ trên xuống dưới trong một nhóm.
Khi bán kính nguyên tử tăng lên, các electron ngoài cùng nằm cách xa hạt nhân hơn, do đó lực hút giữa hạt nhân và các electron giảm đi, làm cho việc loại bỏ electron trở nên dễ dàng hơn và do đó làm giảm năng lượng ion hóa.
3.3. Các Yếu Tố Ảnh Hưởng Đến Năng Lượng Ion Hóa
Ngoài điện tích hạt nhân hiệu dụng và bán kính nguyên tử, còn có một số yếu tố khác có thể ảnh hưởng đến năng lượng ion hóa, bao gồm:
- Cấu hình electron: Các nguyên tử có cấu hình electron bền vững (ví dụ, lớp vỏ electron đã bão hòa hoặc bán bão hòa) thường có năng lượng ion hóa cao hơn.
- Độ bền của orbital: Các electron trong các orbital s thường khó loại bỏ hơn các electron trong các orbital p, d, hoặc f.
- Hiệu ứng chắn: Các electron bên trong có thể chắn một phần điện tích hạt nhân, làm giảm lực hút của hạt nhân đối với các electron ngoài cùng và do đó làm giảm năng lượng ion hóa.
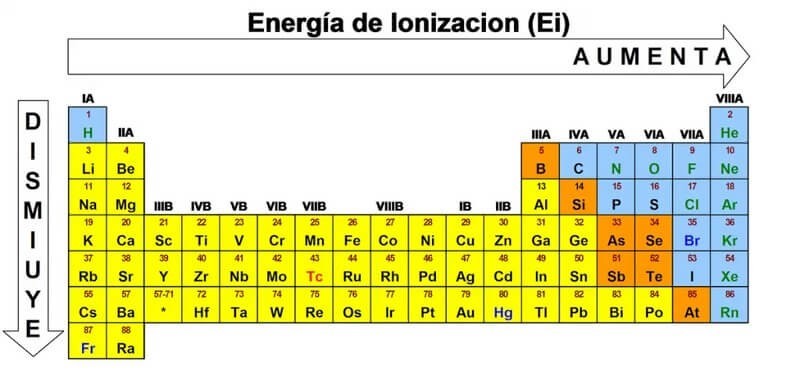 Xu hướng thay đổi của năng lượng ion hóa trên bảng tuần hoàn
Xu hướng thay đổi của năng lượng ion hóa trên bảng tuần hoàn
Hiểu rõ các yếu tố này giúp chúng ta dự đoán và giải thích sự biến đổi của năng lượng ion hóa trong bảng tuần hoàn một cách chính xác hơn.
3.4. Năng Lượng Ion Hóa Liên Tiếp
Năng lượng ion hóa liên tiếp là năng lượng cần thiết để loại bỏ lần lượt các electron từ một nguyên tử hoặc ion. Giá trị của năng lượng ion hóa liên tiếp thường tăng lên đáng kể sau khi loại bỏ các electron hóa trị.
Ví dụ, năng lượng ion hóa liên tiếp của natri (Na) như sau:
- I1 = 496 kJ/mol
- I2 = 4562 kJ/mol
- I3 = 6912 kJ/mol
Sự tăng vọt giữa I1 và I2 cho thấy rằng natri có một electron hóa trị duy nhất, và việc loại bỏ electron thứ hai đòi hỏi phải phá vỡ lớp vỏ electron bền vững hơn.
4. Cách Xác Định Năng Lượng Ion Hóa
Việc xác định năng lượng ion hóa là một quá trình phức tạp, đòi hỏi các phương pháp thí nghiệm chính xác và hiện đại.
4.1. Phương Pháp Quang Phổ Hấp Thụ Nguyên Tử (AAS)
Phương pháp quang phổ hấp thụ nguyên tử (AAS) là một kỹ thuật phân tích định lượng được sử dụng để xác định nồng độ của một nguyên tố cụ thể trong một mẫu. Phương pháp này dựa trên sự hấp thụ ánh sáng của các nguyên tử ở trạng thái khí.
Trong quá trình đo AAS, một chùm ánh sáng có bước sóng đặc trưng cho nguyên tố cần phân tích được chiếu qua một đám mây nguyên tử của mẫu. Các nguyên tử này sẽ hấp thụ một phần ánh sáng, và lượng ánh sáng bị hấp thụ tỷ lệ thuận với nồng độ của nguyên tố trong mẫu.
Theo Bộ Khoa học và Công nghệ, phương pháp AAS là một công cụ mạnh mẽ để xác định năng lượng ion hóa của các nguyên tố, đặc biệt là các kim loại.
4.2. Phương Pháp Quang Phổ Phát Xạ Nguyên Tử (AES)
Phương pháp quang phổ phát xạ nguyên tử (AES) là một kỹ thuật phân tích định lượng khác được sử dụng để xác định nồng độ của một nguyên tố cụ thể trong một mẫu. Phương pháp này dựa trên sự phát xạ ánh sáng của các nguyên tử ở trạng thái kích thích.
Trong quá trình đo AES, mẫu được đưa vào một ngọn lửa hoặc plasma, làm cho các nguyên tử trong mẫu bị kích thích và chuyển lên các mức năng lượng cao hơn. Khi các nguyên tử trở về trạng thái cơ bản, chúng sẽ phát ra ánh sáng có bước sóng đặc trưng cho nguyên tố đó. Cường độ của ánh sáng phát ra tỷ lệ thuận với nồng độ của nguyên tố trong mẫu.
4.3. Phương Pháp Quang Điện Tử (PES)
Phương pháp quang điện tử (PES) là một kỹ thuật phân tích bề mặt được sử dụng để xác định năng lượng liên kết của các electron trong một chất rắn. Phương pháp này dựa trên hiệu ứng quang điện, trong đó các electron bị bắn ra khỏi bề mặt của một chất rắn khi nó bị chiếu xạ bằng tia cực tím hoặc tia X.
Năng lượng của các electron bị bắn ra được đo bằng một máy phân tích năng lượng, và từ đó có thể xác định năng lượng liên kết của các electron trong chất rắn. Phương pháp PES là một công cụ mạnh mẽ để nghiên cứu cấu trúc điện tử của vật liệu và xác định năng lượng ion hóa của các nguyên tử trên bề mặt vật liệu.
 Xác định năng lượng ion hóa bằng phương pháp photoemission là chủ yếu
Xác định năng lượng ion hóa bằng phương pháp photoemission là chủ yếu
4.4. Các Yếu Tố Ảnh Hưởng Đến Độ Chính Xác Của Phép Đo
Độ chính xác của phép đo năng lượng ion hóa có thể bị ảnh hưởng bởi nhiều yếu tố, bao gồm:
- Độ tinh khiết của mẫu: Mẫu phải được làm sạch và không chứa các tạp chất có thể gây nhiễu cho phép đo.
- Độ phân giải của thiết bị: Thiết bị đo phải có độ phân giải đủ cao để phân biệt giữa các mức năng lượng khác nhau.
- Điều kiện thí nghiệm: Các điều kiện thí nghiệm như nhiệt độ, áp suất, và môi trường phải được kiểm soát chặt chẽ để đảm bảo kết quả đo chính xác.
- Phương pháp hiệu chuẩn: Thiết bị đo phải được hiệu chuẩn định kỳ bằng các chất chuẩn đã biết để đảm bảo độ chính xác của phép đo.
5. Ứng Dụng Thực Tế Của Năng Lượng Ion Hóa
Năng lượng ion hóa không chỉ là một khái niệm lý thuyết, mà còn có nhiều ứng dụng thực tế trong các lĩnh vực khác nhau của khoa học và công nghệ.
5.1. Trong Hóa Học
Năng lượng ion hóa được sử dụng để dự đoán và giải thích các tính chất hóa học của các nguyên tố, bao gồm:
- Tính kim loại: Các nguyên tố có năng lượng ion hóa thấp thường có tính kim loại mạnh, vì chúng dễ dàng nhường electron để tạo thành ion dương.
- Tính phi kim: Các nguyên tố có năng lượng ion hóa cao thường có tính phi kim mạnh, vì chúng khó nhường electron và có xu hướng nhận electron để tạo thành ion âm.
- Khả năng phản ứng: Năng lượng ion hóa có thể được sử dụng để dự đoán khả năng phản ứng của một nguyên tố với các nguyên tố khác.
5.2. Trong Vật Lý
Năng lượng ion hóa được sử dụng để nghiên cứu cấu trúc điện tử của nguyên tử và phân tử, bao gồm:
- Xác định cấu hình electron: Năng lượng ion hóa có thể được sử dụng để xác định cấu hình electron của một nguyên tử hoặc phân tử bằng cách đo năng lượng cần thiết để loại bỏ lần lượt các electron.
- Nghiên cứu liên kết hóa học: Năng lượng ion hóa có thể được sử dụng để nghiên cứu liên kết hóa học bằng cách đo năng lượng cần thiết để phá vỡ liên kết.
5.3. Trong Công Nghiệp
Năng lượng ion hóa được sử dụng trong nhiều quy trình công nghiệp, bao gồm:
- Sản xuất chất bán dẫn: Năng lượng ion hóa được sử dụng để tạo ra các ion được sử dụng trong quá trình cấy ion, một kỹ thuật quan trọng trong sản xuất chất bán dẫn.
- Xử lý bề mặt vật liệu: Năng lượng ion hóa được sử dụng để tạo ra các plasma được sử dụng trong quá trình xử lý bề mặt vật liệu, giúp cải thiện các tính chất của vật liệu như độ cứng, độ bền, và khả năng chống ăn mòn.
- Phân tích môi trường: Năng lượng ion hóa được sử dụng trong các thiết bị phân tích môi trường để đo nồng độ của các chất ô nhiễm trong không khí và nước.
5.4. Nghiên Cứu Vật Liệu Mới
Năng lượng ion hóa đóng vai trò quan trọng trong việc phát triển và nghiên cứu các vật liệu mới, đặc biệt là trong lĩnh vực vật liệu nano và vật liệu điện tử. Việc hiểu rõ năng lượng ion hóa của các nguyên tố và hợp chất giúp các nhà khoa học dự đoán và điều chỉnh các tính chất của vật liệu, từ đó tạo ra các sản phẩm có ứng dụng cao trong thực tế.
Ví dụ, trong lĩnh vực pin mặt trời, năng lượng ion hóa của các vật liệu bán dẫn được sử dụng để tối ưu hóa hiệu suất chuyển đổi năng lượng. Trong lĩnh vực vật liệu siêu dẫn, năng lượng ion hóa cũng là một yếu tố quan trọng để xác định tính chất của vật liệu.
6. Các Câu Hỏi Thường Gặp Về Năng Lượng Ion Hóa (FAQ)
Để giúp bạn hiểu rõ hơn về năng lượng ion hóa, Xe Tải Mỹ Đình xin tổng hợp một số câu hỏi thường gặp và cung cấp câu trả lời chi tiết:
1. Năng lượng ion hóa có đơn vị là gì?
Đơn vị phổ biến của năng lượng ion hóa là kilojoule trên mol (kJ/mol).
2. Tại sao năng lượng ion hóa thứ hai luôn lớn hơn năng lượng ion hóa thứ nhất?
Vì việc loại bỏ một electron từ một ion dương đã khó khăn hơn so với việc loại bỏ một electron từ một nguyên tử trung hòa.
3. Yếu tố nào ảnh hưởng đến năng lượng ion hóa?
Các yếu tố chính bao gồm điện tích hạt nhân, bán kính nguyên tử và cấu hình electron.
4. Năng lượng ion hóa có tính chất tuần hoàn không?
Có, năng lượng ion hóa biến đổi tuần hoàn trong bảng tuần hoàn, tăng dần từ trái sang phải trong một chu kỳ và giảm dần từ trên xuống dưới trong một nhóm.
5. Làm thế nào để đo năng lượng ion hóa?
Các phương pháp phổ biến bao gồm quang phổ hấp thụ nguyên tử (AAS), quang phổ phát xạ nguyên tử (AES) và quang điện tử (PES).
6. Năng lượng ion hóa có ứng dụng gì trong thực tế?
Năng lượng ion hóa được ứng dụng trong hóa học, vật lý, công nghiệp và nghiên cứu vật liệu mới.
7. Tại sao các khí hiếm có năng lượng ion hóa rất cao?
Vì chúng có cấu hình electron bền vững với lớp vỏ electron đã bão hòa.
8. Năng lượng ion hóa có liên quan gì đến tính kim loại?
Các nguyên tố có năng lượng ion hóa thấp thường có tính kim loại mạnh.
9. Sự khác biệt giữa năng lượng ion hóa và ái lực electron là gì?
Năng lượng ion hóa là năng lượng cần thiết để loại bỏ một electron, trong khi ái lực electron là năng lượng giải phóng khi một nguyên tử nhận thêm một electron.
10. Năng lượng ion hóa có thể dự đoán được không?
Có, năng lượng ion hóa có thể được dự đoán dựa trên vị trí của nguyên tố trong bảng tuần hoàn và cấu hình electron của nó.
Hy vọng những câu hỏi và trả lời này sẽ giúp bạn hiểu rõ hơn về năng lượng ion hóa và ứng dụng của nó trong thực tế.
7. Kết Luận
Năng lượng ion hóa là một khái niệm quan trọng trong hóa học và vật lý, có ảnh hưởng lớn đến tính chất và khả năng phản ứng của các nguyên tố. Việc hiểu rõ về năng lượng ion hóa, từ định nghĩa, đặc điểm, cách xác định, đến ứng dụng thực tế, sẽ giúp bạn có cái nhìn sâu sắc hơn về thế giới vật chất xung quanh chúng ta.
Nếu bạn đang tìm kiếm thông tin chi tiết và đáng tin cậy về xe tải ở Mỹ Đình, hãy truy cập XETAIMYDINH.EDU.VN ngay hôm nay. Chúng tôi cung cấp thông tin cập nhật, so sánh giá cả và tư vấn chuyên nghiệp để giúp bạn đưa ra quyết định tốt nhất. Đừng ngần ngại liên hệ với chúng tôi qua hotline 0247 309 9988 hoặc đến trực tiếp địa chỉ Số 18 đường Mỹ Đình, phường Mỹ Đình 2, quận Nam Từ Liêm, Hà Nội để được tư vấn và giải đáp mọi thắc mắc. Xe Tải Mỹ Đình luôn sẵn sàng đồng hành cùng bạn!