Bạn đang tìm hiểu về Các Phản ứng Oxi Hóa Khử Thường Gặp? Bạn muốn nắm vững kiến thức về ứng dụng và ví dụ thực tế của chúng? Bài viết này từ Xe Tải Mỹ Đình sẽ cung cấp cho bạn cái nhìn toàn diện về chủ đề này. Chúng tôi sẽ giúp bạn hiểu rõ bản chất, nhận biết, và ứng dụng của các phản ứng oxi hóa khử, đồng thời cung cấp các ví dụ minh họa dễ hiểu. Để giúp bạn khám phá sâu hơn về lĩnh vực xe tải, chúng tôi còn cung cấp thông tin về sự ăn mòn kim loại và các biện pháp bảo vệ xe tải khỏi quá trình này.
1. Phản Ứng Oxi Hóa Khử Là Gì?
Phản ứng oxi hóa khử là phản ứng hóa học, trong đó có sự thay đổi số oxi hóa của một số nguyên tố. Điều này có nghĩa là có sự chuyển dịch electron giữa các chất tham gia phản ứng.
1.1. Định Nghĩa Chi Tiết
Phản ứng oxi hóa khử (Redox) bao gồm hai quá trình xảy ra đồng thời:
- Oxi hóa: Quá trình một chất mất electron, số oxi hóa tăng lên. Chất nhường electron gọi là chất khử.
- Khử: Quá trình một chất nhận electron, số oxi hóa giảm xuống. Chất nhận electron gọi là chất oxi hóa.
Ví dụ: Phản ứng giữa kẽm (Zn) và axit clohidric (HCl):
Zn + 2HCl → ZnCl2 + H2
Trong phản ứng này:
- Kẽm (Zn) bị oxi hóa (từ 0 lên +2) và là chất khử.
- Hydro (H+) trong HCl bị khử (từ +1 xuống 0) và là chất oxi hóa.
1.2. Vai Trò Của Chất Khử và Chất Oxi Hóa
- Chất khử: Là chất nhường electron, làm tăng số oxi hóa của mình và bị oxi hóa.
- Chất oxi hóa: Là chất nhận electron, làm giảm số oxi hóa của mình và bị khử.
Bảng Tóm Tắt:
| Thuộc Tính | Chất Khử | Chất Oxi Hóa |
|---|---|---|
| Vai trò | Nhường electron | Nhận electron |
| Số oxi hóa | Tăng | Giảm |
| Quá trình | Bị oxi hóa | Bị khử |
| Ví dụ | Kim loại (Na, Mg, Fe), H2, CO | O2, Cl2, KMnO4, HNO3 |
1.3 Phân Loại Các Phản Ứng Oxi Hóa Khử
Có nhiều cách để phân loại phản ứng oxi hóa khử, nhưng phổ biến nhất là dựa vào bản chất của các chất tham gia phản ứng:
- Phản ứng giữa kim loại và axit: Ví dụ: Fe + HCl → FeCl2 + H2
- Phản ứng giữa kim loại và muối: Ví dụ: Fe + CuSO4 → FeSO4 + Cu
- Phản ứng đốt cháy: Ví dụ: C + O2 → CO2
- Phản ứng điều chế kim loại từ oxit: Ví dụ: Fe2O3 + CO → Fe + CO2
- Phản ứng phân hủy: Ví dụ: KMnO4 → K2MnO4 + MnO2 + O2
2. Dấu Hiệu Nhận Biết Phản Ứng Oxi Hóa Khử
Để nhận biết một phản ứng có phải là phản ứng oxi hóa khử hay không, ta cần dựa vào sự thay đổi số oxi hóa của các nguyên tố.
2.1. Cách Xác Định Số Oxi Hóa
Để xác định số oxi hóa, cần tuân theo các quy tắc sau:
- Số oxi hóa của nguyên tố trong đơn chất bằng 0.
- Số oxi hóa của ion đơn nguyên tử bằng điện tích của ion đó.
- Trong hợp chất, tổng số oxi hóa của các nguyên tố bằng 0.
- Số oxi hóa của một số nguyên tố thường gặp:
- Hydro (H): +1 (trừ trong hydrua kim loại như NaH, CaH2 là -1)
- Oxi (O): -2 (trừ trong OF2 là +2, trong peoxit như H2O2 là -1)
- Kim loại kiềm (nhóm IA): +1
- Kim loại kiềm thổ (nhóm IIA): +2
- Nhôm (Al): +3
Ví dụ: Xác định số oxi hóa của Mn trong KMnO4:
- K có số oxi hóa +1.
- O có số oxi hóa -2.
- Tổng số oxi hóa của KMnO4 là 0.
Vậy: +1 + Mn + 4(-2) = 0 => Mn = +7
2.2. Các Dấu Hiệu Thường Gặp
- Có sự thay đổi màu sắc của dung dịch: Ví dụ, phản ứng giữa KMnO4 (màu tím) và FeSO4 (không màu) làm mất màu tím của dung dịch KMnO4.
- Có khí thoát ra: Ví dụ, phản ứng giữa Zn và HCl tạo ra khí H2.
- Có kết tủa xuất hiện hoặc tan ra: Ví dụ, phản ứng giữa AgNO3 và Cu tạo ra kết tủa Ag.
- Có sự thay đổi về nhiệt độ: Phản ứng tỏa nhiệt (nhiệt độ tăng) hoặc thu nhiệt (nhiệt độ giảm).
2.3. Ứng Dụng Trong Đời Sống và Sản Xuất
Phản ứng oxi hóa khử có vai trò quan trọng trong nhiều lĩnh vực:
- Trong công nghiệp: Sản xuất kim loại, hóa chất, phân bón, thuốc nổ…
- Trong đời sống: Đốt nhiên liệu, hô hấp, quang hợp…
- Trong môi trường: Xử lý nước thải, khí thải…
Ví dụ: Quá trình quang hợp ở cây xanh:
6CO2 + 6H2O → C6H12O6 + 6O2
Trong quá trình này, CO2 bị khử thành C6H12O6 (glucozo) và H2O bị oxi hóa thành O2.
3. Các Bước Viết Phương Trình Phản Ứng Oxi Hóa Khử
Để viết đúng phương trình phản ứng oxi hóa khử, cần tuân theo các bước sau:
3.1. Xác Định Số Oxi Hóa Của Các Nguyên Tố
Xác định số oxi hóa của tất cả các nguyên tố trong phản ứng để tìm ra chất khử và chất oxi hóa.
Ví dụ: Phản ứng giữa Fe và H2SO4 đặc, nóng:
Fe + H2SO4 → Fe2(SO4)3 + SO2 + H2O
Số oxi hóa của các nguyên tố:
- Fe: 0 → +3
- S: +6 → +4
3.2. Viết Quá Trình Oxi Hóa và Quá Trình Khử
Viết riêng quá trình oxi hóa (nhường electron) và quá trình khử (nhận electron).
- Quá trình oxi hóa: Fe → Fe3+ + 3e
- Quá trình khử: S6+ + 2e → S4+
3.3. Cân Bằng Số Electron Nhường và Nhận
Nhân các quá trình oxi hóa và khử với hệ số thích hợp để số electron nhường bằng số electron nhận.
- 2 x (Fe → Fe3+ + 3e)
- 3 x (S6+ + 2e → S4+)
Kết quả:
- 2Fe → 2Fe3+ + 6e
- 3S6+ + 6e → 3S4+
3.4. Cộng Các Quá Trình và Cân Bằng Phương Trình
Cộng các quá trình oxi hóa và khử lại với nhau, sau đó cân bằng phương trình hóa học.
2Fe + 3H2SO4 → Fe2(SO4)3 + 3SO2 + H2O
Kiểm tra lại số lượng nguyên tử của mỗi nguyên tố ở hai vế để đảm bảo phương trình đã được cân bằng chính xác.
Phương trình cân bằng:
2Fe + 6H2SO4 → Fe2(SO4)3 + 3SO2 + 6H2O
4. Các Phản Ứng Oxi Hóa Khử Thường Gặp
Có rất nhiều phản ứng oxi hóa khử trong hóa học, nhưng dưới đây là một số phản ứng thường gặp nhất:
4.1. Phản Ứng Oxi Hóa Khử Trong Môi Trường Axit
-
Phản ứng giữa KMnO4 và FeSO4:
Đây là một phản ứng quan trọng trong hóa học phân tích, dùng để định lượng Fe2+. Trong môi trường axit, KMnO4 oxi hóa Fe2+ thành Fe3+ và bị khử thành Mn2+.
Phương trình ion rút gọn:
MnO4- + 5Fe2+ + 8H+ → Mn2+ + 5Fe3+ + 4H2O
-
Phản ứng giữa K2Cr2O7 và FeSO4:
Tương tự KMnO4, K2Cr2O7 cũng là chất oxi hóa mạnh trong môi trường axit. Nó oxi hóa Fe2+ thành Fe3+ và bị khử thành Cr3+.
Phương trình ion rút gọn:
Cr2O72- + 6Fe2+ + 14H+ → 2Cr3+ + 6Fe3+ + 7H2O
-
Phản ứng giữa kim loại và HNO3:
HNO3 là chất oxi hóa mạnh, có thể oxi hóa hầu hết các kim loại (trừ Au và Pt). Sản phẩm khử của HNO3 phụ thuộc vào nồng độ axit và bản chất của kim loại.
Ví dụ: Cu + HNO3 → Cu(NO3)2 + NO2 + H2O (HNO3 đặc)
Cu + HNO3 → Cu(NO3)2 + NO + H2O (HNO3 loãng) -
Phản ứng giữa kim loại và H2SO4 đặc, nóng:
H2SO4 đặc, nóng cũng là chất oxi hóa mạnh, có thể oxi hóa nhiều kim loại. Sản phẩm khử thường là SO2.
Ví dụ: Cu + H2SO4 → CuSO4 + SO2 + H2O
4.2. Phản Ứng Oxi Hóa Khử Trong Môi Trường Bazơ
-
Phản ứng giữa Cl2 và NaOH:
Cl2 tác dụng với NaOH tạo ra hỗn hợp muối NaCl và NaClO (nước Javel).
Phương trình:
Cl2 + 2NaOH → NaCl + NaClO + H2O
-
Phản ứng giữa KMnO4 và KI:
Trong môi trường kiềm, KMnO4 oxi hóa I- thành I2 và bị khử thành K2MnO4 hoặc MnO2.
Phương trình:
KMnO4 + KI + KOH → K2MnO4 + I2 + H2O
-
Phản ứng giữa H2O2 và KMnO4:
Trong môi trường kiềm, H2O2 thể hiện tính khử mạnh mẽ, có thể khử KMnO4 về MnO2.Phương trình:
2KMnO4 + 3H2O2 → 2MnO2 + 2KOH + 3O2 + 2H2O
4.3. Phản Ứng Oxi Hóa Khử Trong Công Nghiệp
-
Sản xuất gang thép:
Trong lò cao, Fe2O3 bị khử bởi CO để tạo thành Fe.
Phương trình:
Fe2O3 + 3CO → 2Fe + 3CO2
-
Sản xuất nhôm:
Al2O3 bị điện phân nóng chảy để tạo thành Al.
Phương trình:
2Al2O3 → 4Al + 3O2
-
Sản xuất axit sunfuric:
SO2 được oxi hóa thành SO3 bằng xúc tác V2O5.
Phương trình:
2SO2 + O2 → 2SO3
-
Sản xuất phân đạm:
N2 được khử thành NH3 bằng quá trình Haber-Bosch.
Phương trình:
N2 + 3H2 → 2NH3
4.4. Phản Ứng Oxi Hóa Khử Trong Đời Sống
-
Quá trình hô hấp:
C6H12O6 bị oxi hóa bởi O2 để tạo ra năng lượng, CO2 và H2O.
Phương trình:
C6H12O6 + 6O2 → 6CO2 + 6H2O
-
Quá trình quang hợp:
CO2 và H2O được khử thành C6H12O6 và O2 nhờ năng lượng ánh sáng.
Phương trình:
6CO2 + 6H2O → C6H12O6 + 6O2
-
Sự ăn mòn kim loại:
Kim loại bị oxi hóa bởi O2 hoặc các chất oxi hóa khác trong môi trường.
Ví dụ: Fe bị ăn mòn tạo thành gỉ sắt (Fe2O3).
5. Ví Dụ Về Phản Ứng Oxi Hóa Khử Lớp 10
5.1. Ví Dụ Trong Phản Ứng Oxi Hóa Khử Al + HNO3
Trong phản ứng giữa Al và HNO3, nhôm (Al) là chất khử, axit nitric (HNO3) là chất oxi hóa. Số oxi hóa của Al tăng từ 0 lên +3, trong khi số oxi hóa của N giảm từ +5 xuống các mức khác nhau tùy thuộc vào sản phẩm khử.
Ví dụ:
Al + 4HNO3 → Al(NO3)3 + NO + 2H2O
Trong phản ứng này:
- Al nhường 3 electron: Al → Al3+ + 3e
- N+5 trong HNO3 nhận 3 electron để tạo thành N+2 trong NO: N5+ + 3e → N2+
5.2. Ví Dụ Trong Phản Ứng Oxi Hóa Khử KMnO4
Kali pemanganat (KMnO4) là một chất oxi hóa mạnh, thường được sử dụng trong các phản ứng oxi hóa khử trong môi trường axit.
Ví dụ:
2KMnO4 + 10FeSO4 + 8H2SO4 → K2SO4 + 2MnSO4 + 5Fe2(SO4)3 + 8H2O
Trong phản ứng này:
- Mn+7 trong KMnO4 nhận 5 electron để tạo thành Mn+2 trong MnSO4: Mn7+ + 5e → Mn2+
- Fe2+ trong FeSO4 nhường 1 electron để tạo thành Fe3+ trong Fe2(SO4)3: Fe2+ → Fe3+ + 1e
5.3. Ví Dụ Trong Phản Ứng Oxi Hóa Khử Cu + H2SO4
Phản ứng giữa đồng (Cu) và axit sunfuric đặc, nóng là một ví dụ điển hình về phản ứng oxi hóa khử.
Ví dụ:
Cu + 2H2SO4 (đặc, nóng) → CuSO4 + SO2 + 2H2O
Trong phản ứng này:
- Cu nhường 2 electron: Cu → Cu2+ + 2e
- S+6 trong H2SO4 nhận 2 electron để tạo thành S+4 trong SO2: S6+ + 2e → S4+
6. Bài Tập Về Phản Ứng Oxi Hóa Khử Lớp 10
6.1. Bài Tập 1:
Cho các phương trình phản ứng sau, xác định đâu là phản ứng oxi hóa khử:
A: 2HgO → 2Hg + O2
B: CaCO3 → CaO + CO2
C: 2Al(OH)3 → Al2O3 + 3H2O
D: 2NaHCO3 → Na2CO3 + CO2 + H2O
Lời giải:
Đáp án đúng là A, vì có sự thay đổi số oxi hóa của các nguyên tố:
- Hg2+ + 2e → Hg0
- 2O2- → O2 + 4e
6.2. Bài Tập 2:
Cho các phương trình phản ứng sau, ở phản ứng nào NH3 đóng vai trò là chất khử?
A: 4NH3 + 5O2 → 4NO + 6H2O
B: 2NH3 + 3Cl2 → N2 + 6HCl
C: 2NH3 + 3CuO → 3Cu + N2 + 3H2O
D: 2NH3 + H2O2 + MnSO4 → MnO2 + (NH4)2SO4
Lời giải:
Đáp án đúng là A, vì N trong NH3 tăng số oxi hóa từ -3 lên +2.
6.3. Bài Tập 3:
Cho các phương trình phản ứng sau, xác định phản ứng nào là phản ứng oxi hóa khử:
A: HNO3 + NaOH → NaNO3 + H2O
B: N2O5 + H2O → 2HNO3
C: 2HNO3 + 3H2S → 3S + 2NO + 4H2O
D: 2Fe(OH)3 → Fe2O3 + 3H2O
Lời giải:
Đáp án đúng là C, vì có sự thay đổi số oxi hóa của các nguyên tố.
6.4. Bài Tập 4:
Thế nào là phản ứng oxi hóa khử? Cho 3 ví dụ.
Lời giải:
Phản ứng oxi hóa khử là phản ứng hóa học, trong đó có sự chuyển đổi electron giữa các chất trong phản ứng.
Ví dụ:
- H2 + Cl2 → 2HCl
- Fe + 2HCl → FeCl2 + H2
- FeCl2 + Cl2 → 2FeCl3
6.5. Bài Tập 5:
Cần bao nhiêu gam đồng để khử hoàn toàn lượng ion bạc có trong 85ml dung dịch AgNO3 0,15M?
Lời giải:
- VAgNO3 = 85 ml = 85/1000 lít
- nAgNO3 = Cm x V = (0,15 x 85)/1000 = 0,01275 mol
Phương trình phản ứng:
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag
Theo phương trình ta có:
nCu = ½ nAgNO3 = 0,01275/2 = 0,006375 mol
Vậy mCu = 0,006375 x 64 = 0,408g.
7. Ứng Dụng Thực Tiễn Của Phản Ứng Oxi Hóa Khử Trong Xe Tải
Phản ứng oxi hóa khử không chỉ là kiến thức hóa học, mà còn có nhiều ứng dụng quan trọng trong lĩnh vực xe tải.
7.1. Ắc Quy (Pin Axit-Chì)
Ắc quy là một ví dụ điển hình về ứng dụng của phản ứng oxi hóa khử trong xe tải.
-
Cấu tạo: Gồm các bản cực chì (Pb) và chì oxit (PbO2) nhúng trong dung dịch axit sunfuric (H2SO4).
-
Nguyên lý hoạt động: Khi ắc quy phóng điện, chì (Pb) bị oxi hóa ở cực âm và chì oxit (PbO2) bị khử ở cực dương.
Phương trình:
Pb + PbO2 + 2H2SO4 → 2PbSO4 + 2H2O
-
Ứng dụng: Cung cấp điện năng cho hệ thống khởi động, đèn chiếu sáng và các thiết bị điện khác trên xe tải.
7.2. Động Cơ Đốt Trong
Động cơ đốt trong hoạt động dựa trên quá trình đốt cháy nhiên liệu (xăng, dầu diesel) trong không khí. Đây là một phản ứng oxi hóa khử mạnh, tạo ra năng lượng nhiệt để sinh công.
-
Quá trình: Nhiên liệu (hydrocacbon) phản ứng với oxi trong không khí tạo ra CO2 và H2O, đồng thời giải phóng năng lượng.
Ví dụ: Đốt cháy xăng (C8H18)
2C8H18 + 25O2 → 16CO2 + 18H2O
-
Ứng dụng: Cung cấp động lực cho xe tải di chuyển.
7.3. Ăn Mòn Kim Loại và Bảo Vệ Xe Tải
Ăn mòn kim loại là quá trình oxi hóa kim loại do tác động của môi trường, dẫn đến hư hỏng và giảm tuổi thọ của xe tải.
-
Cơ chế ăn mòn: Kim loại (ví dụ: Fe trong thép) bị oxi hóa thành ion kim loại, tạo thành gỉ sét.
Phương trình:
Fe → Fe2+ + 2e
Fe2+ + O2 + H2O → Fe2O3.nH2O (gỉ sét) -
Biện pháp bảo vệ:
- Sơn phủ: Tạo lớp bảo vệ ngăn kim loại tiếp xúc với môi trường.
- Mạ điện: Phủ một lớp kim loại khác (ví dụ: Zn, Cr) lên bề mặt kim loại cần bảo vệ.
- Sử dụng vật liệu chống ăn mòn: Sử dụng thép không gỉ hoặc hợp kim nhôm.
- Bảo dưỡng định kỳ: Vệ sinh, kiểm tra và xử lý kịp thời các vết gỉ sét.
8. Tìm Hiểu Thêm Tại Xe Tải Mỹ Đình
Nếu bạn đang tìm kiếm thông tin chi tiết và đáng tin cậy về xe tải ở Mỹ Đình, hãy truy cập XETAIMYDINH.EDU.VN ngay hôm nay. Tại đây, bạn sẽ tìm thấy:
- Thông tin chi tiết và cập nhật về các loại xe tải có sẵn.
- So sánh giá cả và thông số kỹ thuật giữa các dòng xe.
- Tư vấn lựa chọn xe phù hợp với nhu cầu và ngân sách của bạn.
- Giải đáp các thắc mắc liên quan đến thủ tục mua bán, đăng ký và bảo dưỡng xe tải.
- Thông tin về các dịch vụ sửa chữa xe tải uy tín trong khu vực.
Xe Tải Mỹ Đình cam kết cung cấp thông tin chính xác và hữu ích nhất để giúp bạn đưa ra quyết định tốt nhất cho nhu cầu của mình.
9. FAQ – Các Câu Hỏi Thường Gặp Về Phản Ứng Oxi Hóa Khử
9.1. Phản ứng oxi hóa khử có vai trò gì trong đời sống?
Phản ứng oxi hóa khử có vai trò vô cùng quan trọng trong đời sống, từ quá trình hô hấp của con người và động vật, quá trình quang hợp của cây xanh, đến các hoạt động đốt nhiên liệu, sản xuất điện năng, và nhiều ứng dụng khác trong công nghiệp và nông nghiệp.
9.2. Làm thế nào để nhận biết một phản ứng là oxi hóa khử?
Để nhận biết một phản ứng có phải là oxi hóa khử hay không, cần xác định số oxi hóa của các nguyên tố trước và sau phản ứng. Nếu có sự thay đổi số oxi hóa của ít nhất một nguyên tố, thì đó là phản ứng oxi hóa khử.
9.3. Chất khử là gì và có vai trò gì trong phản ứng oxi hóa khử?
Chất khử là chất nhường electron cho chất khác trong phản ứng oxi hóa khử. Quá trình nhường electron này làm tăng số oxi hóa của chất khử. Chất khử đóng vai trò quan trọng trong việc khử các chất khác và giúp phản ứng diễn ra.
9.4. Chất oxi hóa là gì và có vai trò gì trong phản ứng oxi hóa khử?
Chất oxi hóa là chất nhận electron từ chất khác trong phản ứng oxi hóa khử. Quá trình nhận electron này làm giảm số oxi hóa của chất oxi hóa. Chất oxi hóa đóng vai trò quan trọng trong việc oxi hóa các chất khác và giúp phản ứng diễn ra.
9.5. Tại sao cần phải cân bằng phương trình phản ứng oxi hóa khử?
Cân bằng phương trình phản ứng oxi hóa khử là cần thiết để đảm bảo tuân thủ định luật bảo toàn khối lượng và điện tích. Việc cân bằng giúp xác định đúng tỉ lệ các chất tham gia và sản phẩm, từ đó tính toán chính xác lượng chất cần thiết cho phản ứng.
9.6. Phản ứng oxi hóa khử có ứng dụng gì trong công nghiệp?
Phản ứng oxi hóa khử có rất nhiều ứng dụng trong công nghiệp, như sản xuất kim loại (gang, thép, nhôm), sản xuất hóa chất (axit sunfuric, amoniac), sản xuất phân bón, và nhiều quá trình khác liên quan đến chuyển đổi năng lượng và vật chất.
9.7. Ăn mòn kim loại có phải là một dạng phản ứng oxi hóa khử không?
Đúng vậy, ăn mòn kim loại là một dạng phản ứng oxi hóa khử. Trong quá trình này, kim loại bị oxi hóa bởi các tác nhân trong môi trường (như oxi, nước, axit), tạo thành các hợp chất oxi hóa (như gỉ sét).
9.8. Làm thế nào để bảo vệ xe tải khỏi bị ăn mòn?
Có nhiều biện pháp để bảo vệ xe tải khỏi bị ăn mòn, bao gồm sơn phủ bề mặt, mạ điện, sử dụng vật liệu chống ăn mòn, và bảo dưỡng định kỳ để loại bỏ gỉ sét và các tác nhân gây ăn mòn.
9.9. Ắc quy hoạt động dựa trên nguyên tắc nào của phản ứng oxi hóa khử?
Ắc quy hoạt động dựa trên nguyên tắc chuyển đổi năng lượng hóa học thành năng lượng điện thông qua các phản ứng oxi hóa khử. Khi ắc quy phóng điện, các chất trong ắc quy tham gia vào các phản ứng oxi hóa khử, tạo ra dòng điện.
9.10. Động cơ đốt trong có liên quan gì đến phản ứng oxi hóa khử?
Động cơ đốt trong hoạt động dựa trên quá trình đốt cháy nhiên liệu, là một phản ứng oxi hóa khử mạnh. Trong quá trình này, nhiên liệu (hydrocacbon) phản ứng với oxi trong không khí, tạo ra năng lượng nhiệt và các sản phẩm như CO2 và H2O.
10. Liên Hệ Với Xe Tải Mỹ Đình Ngay Hôm Nay
Bạn còn thắc mắc gì về xe tải? Đừng ngần ngại liên hệ với Xe Tải Mỹ Đình để được tư vấn và giải đáp mọi thắc mắc. Chúng tôi luôn sẵn lòng hỗ trợ bạn!
Địa chỉ: Số 18 đường Mỹ Đình, phường Mỹ Đình 2, quận Nam Từ Liêm, Hà Nội
Hotline: 0247 309 9988
Trang web: XETAIMYDINH.EDU.VN
Hãy truy cập XETAIMYDINH.EDU.VN ngay hôm nay để khám phá thế giới xe tải và nhận được sự hỗ trợ tốt nhất!
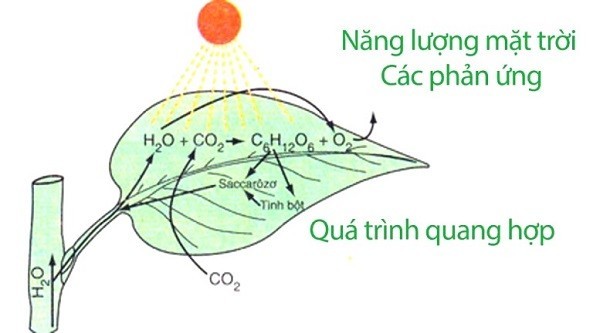 Phản ứng oxi hóa khử trong thực tế
Phản ứng oxi hóa khử trong thực tế
Quá trình quang hợp của cây xanh, một ví dụ điển hình về phản ứng oxi hóa khử, giúp duy trì sự sống trên Trái Đất.
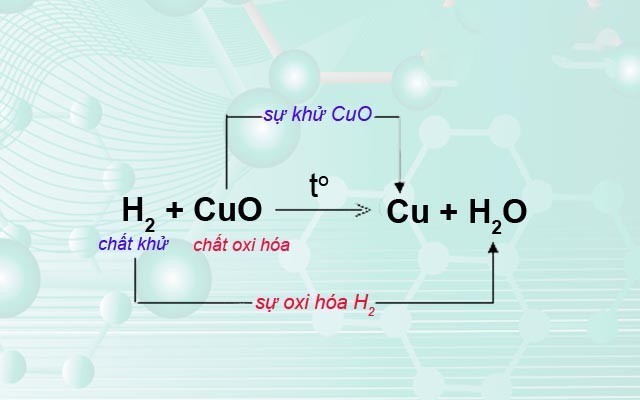 Ví dụ về phản ứng oxi hóa khử
Ví dụ về phản ứng oxi hóa khử
Minh họa về chất khử và chất oxi hóa trong phản ứng oxi hóa khử, giúp học sinh dễ dàng hình dung và nắm bắt kiến thức.
 Bài tập về phản ứng oxi hóa khử
Bài tập về phản ứng oxi hóa khử
Một bài tập ví dụ về phản ứng oxi hóa khử giúp học sinh lớp 10 củng cố kiến thức và rèn luyện kỹ năng giải bài tập hóa học.
