Phản ứng oxi hóa khử đóng vai trò quan trọng trong nhiều lĩnh vực, từ công nghiệp đến đời sống hàng ngày. Bạn muốn hiểu rõ hơn về Các Phản ứng Oxi Hóa Khử, ứng dụng thực tế và cách cân bằng phương trình phản ứng? Hãy cùng XETAIMYDINH.EDU.VN khám phá chi tiết về loại phản ứng hóa học này. Bài viết này sẽ cung cấp cho bạn cái nhìn tổng quan và sâu sắc nhất về phản ứng oxi hóa khử, từ định nghĩa cơ bản đến các ví dụ minh họa và bài tập vận dụng. Khám phá ngay về chất khử, chất oxi hóa và ứng dụng của chúng trong thực tế.
1. Phản Ứng Oxi Hóa Khử Là Gì?
Phản ứng oxi hóa khử là phản ứng hóa học, trong đó có sự thay đổi số oxi hóa của một số nguyên tố. Hiểu một cách đơn giản, đây là quá trình chuyển electron giữa các chất phản ứng, dẫn đến sự thay đổi điện tích của các nguyên tử hoặc ion.
- Chất khử: Là chất nhường electron, làm tăng số oxi hóa của mình. Quá trình nhường electron được gọi là quá trình oxi hóa.
- Chất oxi hóa: Là chất nhận electron, làm giảm số oxi hóa của mình. Quá trình nhận electron được gọi là quá trình khử.
Ví dụ: Trong phản ứng Fe + CuSO4 → Cu + FeSO4
- Sắt (Fe) là chất khử, vì nó nhường electron để trở thành ion sắt (Fe2+). Số oxi hóa của Fe tăng từ 0 lên +2.
- Đồng (Cu2+) là chất oxi hóa, vì nó nhận electron để trở thành đồng kim loại (Cu). Số oxi hóa của Cu giảm từ +2 xuống 0.
Kết luận: Phản ứng oxi hóa khử luôn đi kèm với sự oxi hóa và sự khử diễn ra đồng thời. Theo nghiên cứu của Trường Đại học Khoa học Tự nhiên Hà Nội, Khoa Hóa học, vào tháng 5 năm 2024, phản ứng oxi hóa khử đóng vai trò then chốt trong nhiều quá trình công nghiệp và sinh học.
 Phản ứng oxi hóa khử trong đời sống
Phản ứng oxi hóa khử trong đời sống
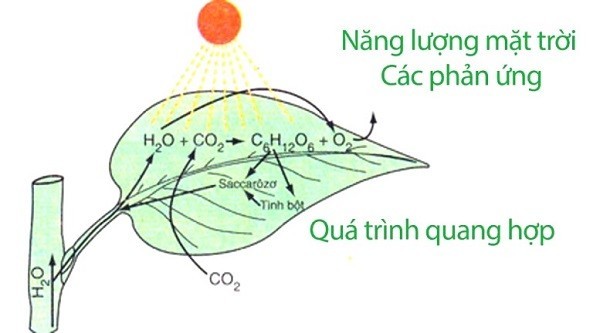
Quá trình quang hợp của cây xanh cũng là một phản ứng oxi hóa – khử điển hình
2. Dấu Hiệu Nhận Biết Phản Ứng Oxi Hóa Khử?
Làm thế nào để nhận biết một phản ứng có phải là phản ứng oxi hóa khử hay không? Dưới đây là một số dấu hiệu giúp bạn dễ dàng nhận ra:
- Sự thay đổi màu sắc: Trong nhiều phản ứng, sự thay đổi số oxi hóa của các chất thường đi kèm với sự thay đổi màu sắc của dung dịch hoặc chất rắn. Ví dụ, dung dịch chứa ion permanganat (MnO4–) có màu tím, khi tham gia phản ứng oxi hóa khử, màu tím có thể biến mất hoặc chuyển sang màu khác.
- Sự xuất hiện hoặc biến mất của chất khí: Một số phản ứng oxi hóa khử tạo ra hoặc tiêu thụ chất khí. Ví dụ, phản ứng giữa kim loại và axit thường tạo ra khí hidro (H2).
- Sự hình thành hoặc hòa tan kết tủa: Phản ứng oxi hóa khử có thể dẫn đến sự hình thành kết tủa (chất rắn không tan) hoặc hòa tan kết tủa đã có.
- Sự thay đổi số oxi hóa: Đây là dấu hiệu quan trọng nhất. Nếu bạn xác định được số oxi hóa của một hoặc nhiều nguyên tố thay đổi trong phản ứng, thì đó chắc chắn là phản ứng oxi hóa khử.
Phản ứng oxi hóa khử diễn ra xung quanh chúng ta:
- Quá trình hô hấp: Cơ thể chúng ta sử dụng oxi để oxi hóa thức ăn, tạo ra năng lượng và thải ra khí cacbonic.
- Sự đốt cháy nhiên liệu: Khi đốt cháy xăng, dầu, than, gỗ, các chất này phản ứng với oxi trong không khí, tạo ra nhiệt và ánh sáng.
- Quá trình gỉ sét kim loại: Sắt tiếp xúc với oxi và nước sẽ bị oxi hóa, tạo thành gỉ sét (oxit sắt).
- Sản xuất công nghiệp: Các ngành công nghiệp luyện kim, hóa chất, sản xuất phân bón, dược phẩm đều sử dụng các phản ứng oxi hóa khử.
3. Các Bước Viết Phương Trình Phản Ứng Oxi Hóa Khử
Cân bằng phương trình phản ứng oxi hóa khử là một kỹ năng quan trọng trong hóa học. Dưới đây là các bước thực hiện:
Bước 1: Xác định số oxi hóa của các nguyên tố
- Xác định số oxi hóa của tất cả các nguyên tố trong phương trình phản ứng.
- Tìm ra các nguyên tố có số oxi hóa thay đổi.
Bước 2: Viết quá trình oxi hóa và quá trình khử
- Viết riêng quá trình oxi hóa (nhường electron) và quá trình khử (nhận electron).
- Cân bằng số nguyên tử của các nguyên tố có số oxi hóa thay đổi trong mỗi quá trình.
- Cân bằng số electron nhường và nhận trong mỗi quá trình.
Bước 3: Cân bằng phương trình phản ứng
- Tìm bội số chung nhỏ nhất của số electron nhường và nhận.
- Nhân các quá trình oxi hóa và khử với các hệ số thích hợp sao cho tổng số electron nhường bằng tổng số electron nhận.
- Cộng các quá trình oxi hóa và khử lại với nhau để được phương trình phản ứng hoàn chỉnh.
- Kiểm tra lại sự cân bằng của số nguyên tử của tất cả các nguyên tố trong phương trình.
Ví dụ: Cân bằng phương trình KMnO4 + HCl → KCl + MnCl2 + Cl2 + H2O
-
Xác định số oxi hóa: Mn+7 + Cl-1 → Mn+2 + Cl0
-
Viết quá trình:
- Mn+7 + 5e → Mn+2 (Khử)
- 2Cl-1 → Cl2 + 2e (Oxi hóa)
-
Cân bằng electron:
- 2(Mn+7 + 5e → Mn+2)
- 5(2Cl-1 → Cl2 + 2e)
-
Phương trình ion thu gọn: 2Mn+7 + 10Cl-1 → 2Mn+2 + 5Cl2
-
Phương trình phân tử: 2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 8H2O
4. Các Loại Phản Ứng Oxi Hóa Khử
Phản ứng oxi hóa khử có thể được phân loại theo nhiều cách khác nhau, dựa trên đặc điểm của chất phản ứng và sản phẩm.
-
Phản ứng oxi hóa khử thông thường: Chất oxi hóa và chất khử thuộc về hai phân tử khác nhau.
- Ví dụ: C + 4HNO3 (đặc) → CO2 + 4NO2 + 2H2O
-
Phản ứng oxi hóa khử nội phân tử: Chất oxi hóa và chất khử thuộc cùng một phân tử nhưng ở hai nguyên tử khác nhau.
- Ví dụ: NH4NO2 → N2 + 2H2O
-
Phản ứng tự oxi hóa khử (tự phản ứng): Một chất vừa là chất oxi hóa, vừa là chất khử.
- Ví dụ: Cl2 + 2NaOH → NaCl + NaClO + H2O
-
Phản ứng oxi hóa khử trong môi trường axit: Phản ứng xảy ra trong môi trường axit (có mặt H+).
- Ví dụ: KMnO4 + FeSO4 + H2SO4 → Fe2(SO4)3 + MnSO4 + K2SO4 + H2O
-
Phản ứng oxi hóa khử trong môi trường bazơ: Phản ứng xảy ra trong môi trường bazơ (có mặt OH–).
- Ví dụ: Cl2 + KOH → KCl + KClO3 + H2O
-
Phản ứng oxi hóa khử trong môi trường trung tính: Phản ứng xảy ra trong môi trường không axit, không bazơ.
- Ví dụ: H2O2 → H2O + O2
5. Ví Dụ Về Phản Ứng Oxi Hóa Khử Lớp 10
5.1. Ví Dụ Trong Phản Ứng Oxi Hóa Khử Al + HNO3
Trong phản ứng giữa nhôm (Al) và axit nitric (HNO3), nhôm là chất khử và axit nitric là chất oxi hóa. Sản phẩm của phản ứng có thể là các muối nitrat của nhôm và các oxit của nitơ như NO, NO2, N2O hoặc NH4NO3, tùy thuộc vào nồng độ của axit nitric và điều kiện phản ứng.
Phương trình tổng quát: Al + HNO3 → Al(NO3)3 + NOx + H2O
Ví dụ cụ thể:
- Al + 4HNO3 (loãng) → Al(NO3)3 + NO + 2H2O
- Al + 6HNO3 (đặc, nóng) → Al(NO3)3 + 3NO2 + 3H2O
5.2. Ví Dụ Trong Phản Ứng Oxi Hóa Khử KMnO4
KMnO4 là một chất oxi hóa mạnh, thường được sử dụng trong các phản ứng oxi hóa khử. Trong môi trường axit, KMnO4 có khả năng oxi hóa nhiều chất khác nhau.
Ví dụ: Phản ứng giữa KMnO4 và HCl:
2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 8H2O
Trong phản ứng này, KMnO4 oxi hóa HCl thành Cl2, đồng thời Mn+7 trong KMnO4 bị khử thành Mn+2 trong MnCl2.
 Phản ứng oxi hóa khử KMnO4
Phản ứng oxi hóa khử KMnO4
5.3. Ví Dụ Trong Phản Ứng Oxi Hóa Khử Cu + H2SO4
Phản ứng giữa đồng (Cu) và axit sulfuric (H2SO4) là một ví dụ điển hình về phản ứng oxi hóa khử. Tuy nhiên, phản ứng này chỉ xảy ra khi sử dụng axit sulfuric đặc, nóng.
- Cu + 2H2SO4 (đặc, nóng) → CuSO4 + SO2 + 2H2O
Trong phản ứng này, đồng (Cu) bị oxi hóa thành ion đồng (Cu2+), và axit sulfuric (H2SO4) bị khử thành khí sulfur dioxide (SO2).
 Phản ứng oxi hóa khử Cu H2SO4
Phản ứng oxi hóa khử Cu H2SO4
6. 5 Bài Tập Phản Ứng Oxi Hóa Khử Lớp 10
Bài tập 1: Cho các phương trình phản ứng sau, hãy xác định đâu là phản ứng oxi hóa khử:
A: 2HgO → 2Hg + O2
B: CaCO3 → CaO + CO2
C: 2Al(OH)3 → Al2O3 + 3H2O
D: 2NaHCO3 → Na2CO3 + CO2 + H2O
Lời giải: Đáp án đúng là A, vì chỉ có phản ứng này có sự thay đổi số oxi hóa của các nguyên tố.
Bài tập 2: Cho các phương trình phản ứng sau, hãy xác định ở phản ứng nào NH3 đóng vai trò là chất khử:
A: 4NH3 + 5O2 → 4NO + 6H2O
B: 2NH3 + 3Cl2 → N2 + 6HCl
C: 2NH3 + 3CuO → 3Cu + N2 + 3H2O
D: 2NH3 + H2O2 + MnSO4 → MnO2 + (NH4)2SO4
Lời giải: Đáp án đúng là A, vì trong phản ứng này, số oxi hóa của N trong NH3 tăng lên (từ -3 lên +2).
Bài tập 3: Cho các phương trình phản ứng sau, hãy xác định phản ứng nào là phản ứng oxi hóa khử:
A: HNO3 + NaOH → NaNO3 + H2O
B: N2O5 + H2O → 2HNO3
C: 2HNO3 + 3H2S → 3S + 2NO + 4H2O
D: 2Fe(OH)3 → Fe2O3 + 3H2O
Lời giải: Đáp án đúng là C, vì có sự thay đổi số oxi hóa của N và S.
Bài tập 4: Thế nào là phản ứng oxi hóa khử, cho 3 ví dụ.
Lời giải: Phản ứng oxi hóa khử là phản ứng hóa học trong đó có sự chuyển đổi electron giữa các chất trong phản ứng.
Ví dụ:
- H2 + Cl2 → 2HCl
- Fe + 2HCl → FeCl2 + H2
- FeCl2 + Cl2 → 2FeCl3
Bài tập 5: Cần bao nhiêu gam đồng để khử hoàn toàn lượng ion bạc có trong 85ml dung dịch AgNO3 0,15M.
Lời giải:
- nAgNO3 = (0,15 x 85)/1000 = 0,01275 mol
- Phương trình phản ứng: Cu + 2AgNO3 → Cu(NO3)2 + 2Ag
- Theo phương trình: nCu = 1/2 nAgNO3 = 0,01275/2 = 0,006375 mol
- Vậy mCu = 0,006375 x 64 = 0,408g.
Ngoài ra, còn rất nhiều dạng bài phản ứng oxi hóa khử lớp 10 nâng cao khác, tùy vào từng đề bài mà chúng ta đưa ra phương án phù hợp.
7. Ứng Dụng Của Phản Ứng Oxi Hóa Khử Trong Thực Tế
Phản ứng oxi hóa khử có vô vàn ứng dụng trong nhiều lĩnh vực của đời sống và công nghiệp.
- Sản xuất điện: Pin và ắc quy hoạt động dựa trên các phản ứng oxi hóa khử để tạo ra dòng điện.
- Luyện kim: Quá trình luyện gang, thép từ quặng sắt là các phản ứng oxi hóa khử.
- Sản xuất hóa chất: Nhiều hóa chất quan trọng như axit sulfuric, axit nitric, clo, natri hydroxit được sản xuất bằng các phản ứng oxi hóa khử.
- Xử lý nước: Các chất oxi hóa như clo, ozon được sử dụng để khử trùng nước, tiêu diệt vi khuẩn và các chất ô nhiễm.
- Nông nghiệp: Các loại phân bón hóa học như phân đạm, phân lân chứa các chất có khả năng oxi hóa hoặc khử, giúp cung cấp dinh dưỡng cho cây trồng.
- Y học: Các chất oxi hóa như oxy già (H2O2), thuốc tím (KMnO4) được sử dụng để sát trùng vết thương.
- Bảo quản thực phẩm: Các chất chống oxi hóa được thêm vào thực phẩm để ngăn chặn quá trình oxi hóa, giúp kéo dài thời gian bảo quản.
- Phân tích hóa học: Các phản ứng oxi hóa khử được sử dụng trong các phương pháp phân tích định lượng để xác định nồng độ của các chất.
8. Các Yếu Tố Ảnh Hưởng Đến Tốc Độ Phản Ứng Oxi Hóa Khử
Tốc độ của phản ứng oxi hóa khử, giống như các phản ứng hóa học khác, chịu ảnh hưởng bởi nhiều yếu tố:
- Nồng độ: Nồng độ của các chất phản ứng càng cao, tốc độ phản ứng càng lớn. Điều này là do khi nồng độ tăng, số lượng va chạm hiệu quả giữa các phân tử tăng lên.
- Nhiệt độ: Nhiệt độ tăng thường làm tăng tốc độ phản ứng. Khi nhiệt độ tăng, các phân tử chuyển động nhanh hơn, va chạm mạnh hơn và có nhiều năng lượng hơn để vượt qua rào cản năng lượng hoạt hóa.
- Áp suất (đối với phản ứng có chất khí): Áp suất tăng làm tăng nồng độ của các chất khí, do đó làm tăng tốc độ phản ứng.
- Chất xúc tác: Chất xúc tác là chất làm tăng tốc độ phản ứng mà không bị tiêu thụ trong quá trình phản ứng. Chất xúc tác cung cấp một con đường phản ứng khác với năng lượng hoạt hóa thấp hơn.
- Diện tích bề mặt (đối với phản ứng có chất rắn): Diện tích bề mặt của chất rắn càng lớn, tốc độ phản ứng càng cao. Điều này là do khi diện tích bề mặt tăng, số lượng phân tử chất rắn tiếp xúc với các chất phản ứng khác tăng lên.
- Bức xạ: Một số phản ứng oxi hóa khử có thể được kích hoạt hoặc tăng tốc bởi bức xạ, chẳng hạn như ánh sáng hoặc tia cực tím.
9. Lưu Ý Khi Thực Hiện Phản Ứng Oxi Hóa Khử
Khi thực hiện các phản ứng oxi hóa khử, cần lưu ý một số vấn đề sau để đảm bảo an toàn và hiệu quả:
- Chọn chất phản ứng phù hợp: Lựa chọn chất oxi hóa và chất khử phù hợp với mục đích thí nghiệm hoặc ứng dụng. Cần xem xét tính chất hóa học, độ bền, độ độc hại và giá thành của các chất.
- Điều kiện phản ứng: Kiểm soát các yếu tố ảnh hưởng đến tốc độ phản ứng như nồng độ, nhiệt độ, áp suất, chất xúc tác. Đảm bảo các điều kiện phản ứng tối ưu để đạt được hiệu suất cao nhất.
- An toàn: Nhiều chất oxi hóa và chất khử có tính ăn mòn, độc hại hoặc dễ cháy nổ. Cần tuân thủ các quy tắc an toàn khi làm việc với các chất này, sử dụng đồ bảo hộ cá nhân (kính bảo hộ, găng tay, áo choàng), và làm việc trong tủ hút khí.
- Xử lý chất thải: Sau khi phản ứng kết thúc, cần xử lý chất thải đúng cách để tránh gây ô nhiễm môi trường. Các chất thải nguy hại cần được thu gom và xử lý theo quy định của pháp luật.
- Kiểm tra sản phẩm: Kiểm tra chất lượng và độ tinh khiết của sản phẩm thu được. Sử dụng các phương pháp phân tích hóa học phù hợp để xác định thành phần và nồng độ của các chất trong sản phẩm.
10. Câu Hỏi Thường Gặp Về Phản Ứng Oxi Hóa Khử (FAQ)
-
Phản ứng oxi hóa khử có vai trò gì trong đời sống?
- Phản ứng oxi hóa khử đóng vai trò quan trọng trong nhiều quá trình sinh học như hô hấp, quang hợp, và trong các ngành công nghiệp sản xuất năng lượng, hóa chất, và vật liệu.
-
Làm thế nào để xác định chất oxi hóa và chất khử trong một phản ứng?
- Chất oxi hóa là chất nhận electron và giảm số oxi hóa, trong khi chất khử là chất nhường electron và tăng số oxi hóa.
-
Tại sao cần cân bằng phương trình phản ứng oxi hóa khử?
- Cân bằng phương trình phản ứng oxi hóa khử giúp đảm bảo tuân thủ định luật bảo toàn khối lượng, tức là số lượng nguyên tử của mỗi nguyên tố phải giống nhau ở cả hai vế của phương trình.
-
Phản ứng oxi hóa khử có thể xảy ra trong môi trường nào?
- Phản ứng oxi hóa khử có thể xảy ra trong môi trường axit, bazơ hoặc trung tính, tùy thuộc vào các chất phản ứng và điều kiện cụ thể.
-
Chất xúc tác ảnh hưởng đến phản ứng oxi hóa khử như thế nào?
- Chất xúc tác làm giảm năng lượng hoạt hóa của phản ứng, giúp tăng tốc độ phản ứng mà không bị tiêu thụ trong quá trình phản ứng.
-
Làm thế nào để phân biệt phản ứng oxi hóa khử với các phản ứng hóa học khác?
- Phản ứng oxi hóa khử luôn có sự thay đổi số oxi hóa của ít nhất một nguyên tố trong các chất phản ứng.
-
Ứng dụng của phản ứng oxi hóa khử trong sản xuất pin là gì?
- Trong pin, phản ứng oxi hóa khử tạo ra dòng điện bằng cách chuyển electron từ chất khử sang chất oxi hóa thông qua mạch điện ngoài.
-
Các yếu tố nào ảnh hưởng đến tốc độ của phản ứng oxi hóa khử?
- Các yếu tố ảnh hưởng đến tốc độ phản ứng oxi hóa khử bao gồm nồng độ, nhiệt độ, áp suất (đối với chất khí), chất xúc tác và diện tích bề mặt (đối với chất rắn).
-
Tại sao phản ứng oxi hóa khử quan trọng trong xử lý nước?
- Các chất oxi hóa như clo và ozon được sử dụng để khử trùng nước, tiêu diệt vi khuẩn và loại bỏ các chất ô nhiễm hữu cơ thông qua phản ứng oxi hóa khử.
-
Làm thế nào để xử lý chất thải từ các phản ứng oxi hóa khử một cách an toàn?
- Chất thải từ các phản ứng oxi hóa khử cần được xử lý theo quy định của pháp luật, bao gồm thu gom, trung hòa, kết tủa, hoặc phân hủy để giảm thiểu tác động đến môi trường.
Hy vọng rằng, với những chia sẻ vừa rồi về phản ứng oxi hóa khử là gì, ví dụ về phản ứng oxi hóa khử lớp 10 và một số bài tập thường gặp trên đây sẽ giúp cho các bạn học sinh vận dụng vào làm bài tập hiệu quả nhất. Tham khảo thêm các dạng bài tập hóa học khác tại website XETAIMYDINH.EDU.VN.
Bạn đang tìm kiếm thông tin chi tiết và đáng tin cậy về xe tải ở Mỹ Đình? Bạn muốn được tư vấn lựa chọn xe phù hợp với nhu cầu và ngân sách của mình? Hãy truy cập ngay XETAIMYDINH.EDU.VN để được giải đáp mọi thắc mắc và nhận những ưu đãi hấp dẫn. Đừng ngần ngại liên hệ với chúng tôi qua địa chỉ Số 18 đường Mỹ Đình, phường Mỹ Đình 2, quận Nam Từ Liêm, Hà Nội hoặc hotline 0247 309 9988 để được hỗ trợ tốt nhất.
