Các Nguyên Tố Xếp ở Chu Kì 6 Có Số Lớp Electron Trong Nguyên Tử Là 6. Tìm hiểu chi tiết về cấu tạo bảng tuần hoàn và cách xác định số lớp electron tại XETAIMYDINH.EDU.VN, nơi cung cấp thông tin chính xác và dễ hiểu về xe tải và kiến thức khoa học liên quan, đồng thời khám phá thêm về cấu hình electron và tính chất hóa học của các nguyên tố này.
1. Tổng Quan Về Bảng Tuần Hoàn Các Nguyên Tố Hóa Học
Trước khi đi sâu vào tìm hiểu số lớp electron của các nguyên tố ở chu kì 6, hãy cùng điểm qua những nguyên tắc cơ bản trong cấu trúc bảng tuần hoàn. Bảng tuần hoàn không chỉ là một danh sách các nguyên tố, mà còn là một hệ thống sắp xếp khoa học dựa trên cấu trúc nguyên tử và tính chất hóa học của chúng.
1.1. Nguyên Tắc Sắp Xếp
Bảng tuần hoàn được xây dựng dựa trên ba nguyên tắc chính:
- Nguyên tắc 1: Các nguyên tố hóa học được sắp xếp theo chiều tăng dần điện tích hạt nhân (số proton).
- Nguyên tắc 2: Các nguyên tố mà nguyên tử của chúng có cùng số lớp electron được xếp thành một hàng ngang, gọi là chu kì.
- Nguyên tắc 3: Các nguyên tố mà nguyên tử của chúng có cùng số electron hóa trị (electron ở lớp ngoài cùng hoặc phân lớp gần ngoài cùng chưa bão hòa) được xếp thành một cột dọc, gọi là nhóm.
Electron hóa trị đóng vai trò quan trọng trong việc hình thành các liên kết hóa học, quyết định tính chất hóa học đặc trưng của mỗi nguyên tố.
1.2. Ô Nguyên Tố
Mỗi nguyên tố hóa học được đặt trong một ô riêng biệt trong bảng tuần hoàn, gọi là ô nguyên tố. Số thứ tự của ô nguyên tố trùng với số hiệu nguyên tử (số proton) của nguyên tố đó.
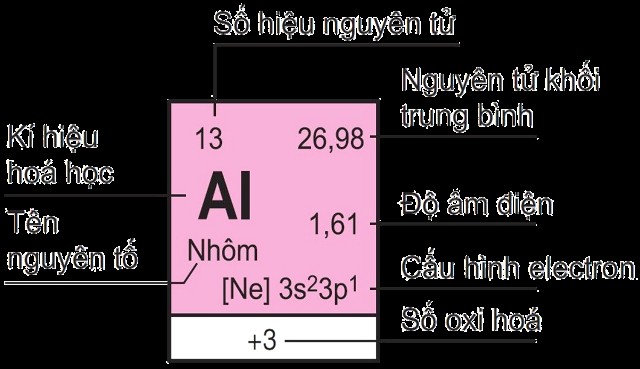 Ô nguyên tố – Cách xác định nhóm nguyên tố
Ô nguyên tố – Cách xác định nhóm nguyên tố
Alt: Minh họa ô nguyên tố trong bảng tuần hoàn, thể hiện số hiệu nguyên tử, ký hiệu hóa học, tên nguyên tố và khối lượng nguyên tử
1.3. Chu Kì
1.3.1. Định Nghĩa Chu Kì
Chu kì là một hàng ngang gồm các nguyên tố mà nguyên tử của chúng có cùng số lớp electron. Các nguyên tố trong cùng một chu kì được sắp xếp theo chiều tăng dần điện tích hạt nhân từ trái sang phải.
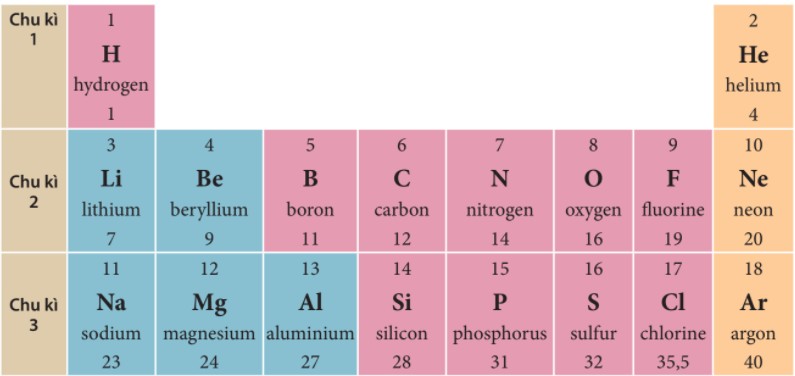 Chu kì nhằm xác định vị trí nguyên tố trong bảng tuần hoàn
Chu kì nhằm xác định vị trí nguyên tố trong bảng tuần hoàn
Alt: Hình ảnh minh họa chu kì trong bảng tuần hoàn, làm nổi bật các nguyên tố có cùng số lớp electron
1.3.2. Phân Loại Các Chu Kì
Bảng tuần hoàn hiện đại có 7 chu kì:
- Chu kì 1: Gồm 2 nguyên tố, từ Hydrogen (H, Z=1) đến Helium (He, Z=2).
- Chu kì 2: Gồm 8 nguyên tố, từ Lithium (Li, Z=3) đến Neon (Ne, Z=10).
- Chu kì 3: Gồm 8 nguyên tố, từ Sodium (Na, Z=11) đến Argon (Ar, Z=18).
- Chu kì 4: Gồm 18 nguyên tố, từ Potassium (K, Z=19) đến Krypton (Kr, Z=36).
- Chu kì 5: Gồm 18 nguyên tố, từ Rubidium (Rb, Z=37) đến Xenon (Xe, Z=54).
- Chu kì 6: Gồm 32 nguyên tố, từ Cesium (Cs, Z=55) đến Radon (Rn, Z=86), bao gồm cả họ Lanthanides.
- Chu kì 7: Bắt đầu từ Francium (Fr, Z=87) và chưa hoàn thành, bao gồm cả họ Actinides.
1.3.3. Chu Kì Ngắn Và Chu Kì Dài
- Chu kì ngắn: Chu kì 1, 2 và 3.
- Chu kì dài: Chu kì 4, 5, 6 và 7.
1.3.4. Nhận Xét Chung Về Chu Kì
- Các nguyên tố trong cùng một chu kì có số lớp electron bằng nhau và bằng chính số thứ tự của chu kì.
- Mỗi chu kì bắt đầu bằng một kim loại kiềm và kết thúc (trừ chu kì 1) bằng một khí hiếm. Gần cuối chu kì là các nguyên tố halogen.
- Hai hàng cuối của bảng tuần hoàn là hai họ nguyên tố đặc biệt: Lanthanides (thuộc chu kì 6, sau Lanthanum (La, Z=57)) và Actinides (thuộc chu kì 7, sau Actinium (Ac, Z=89)).
1.4. Nhóm Nguyên Tố
1.4.1. Định Nghĩa Nhóm Nguyên Tố
Nhóm nguyên tố là tập hợp các nguyên tố hóa học có cấu hình electron tương tự nhau, dẫn đến tính chất hóa học gần giống nhau. Chúng được sắp xếp thành một cột dọc trong bảng tuần hoàn.
1.4.2. Phân Loại Nhóm Nguyên Tố
Bảng tuần hoàn chia thành 18 nhóm, được đánh số từ 1 đến 18 từ trái sang phải. Các nhóm này có thể được chia thành hai loại chính:
- Nhóm A (Nhóm chính): Gồm các nguyên tố s và p.
- Nhóm B (Nhóm chuyển tiếp): Gồm các nguyên tố d và f.
Nguyên tử của các nguyên tố thuộc cùng một nhóm có số electron hóa trị bằng nhau, thường bằng số thứ tự của nhóm (trừ một số trường hợp ngoại lệ ở nhóm B).
1.5. Khối Nguyên Tố
Bảng tuần hoàn cũng có thể được chia thành các khối nguyên tố dựa trên phân lớp electron ngoài cùng:
- Khối s: Gồm các nguyên tố nhóm IA và IIA (trừ Helium).
- Khối p: Gồm các nguyên tố nhóm IIIA đến VIIIA (trừ Helium).
- Khối d: Gồm các nguyên tố nhóm B.
- Khối f: Gồm các nguyên tố Lanthanides và Actinides, nằm ở hai hàng cuối của bảng tuần hoàn.
2. Các Nguyên Tố Xếp Ở Chu Kì 6 Có Số Lớp Electron Trong Nguyên Tử Là Bao Nhiêu?
Các nguyên tố xếp ở chu kì 6 có số lớp electron trong nguyên tử là 6. Điều này xuất phát từ định nghĩa cơ bản của chu kì trong bảng tuần hoàn: số thứ tự của chu kì trùng với số lớp electron của nguyên tử các nguyên tố trong chu kì đó.
2.1. Giải Thích Chi Tiết
Chu kì 6 bắt đầu bằng Cesium (Cs, Z=55) và kết thúc bằng Radon (Rn, Z=86). Tất cả các nguyên tố từ Cs đến Rn đều có 6 lớp electron. Cấu hình electron của Cesium là [Xe] 6s1, cho thấy electron hóa trị nằm ở lớp thứ 6. Tương tự, cấu hình electron của Radon là [Xe] 4f14 5d10 6s2 6p6, cũng cho thấy lớp electron ngoài cùng là lớp thứ 6.
2.2. Ví Dụ Cụ Thể Về Cấu Hình Electron Của Một Số Nguyên Tố Chu Kì 6
Để minh họa rõ hơn, hãy xem xét cấu hình electron của một vài nguyên tố tiêu biểu trong chu kì 6:
- Cesium (Cs, Z=55): [Xe] 6s1 (6 lớp electron)
- Barium (Ba, Z=56): [Xe] 6s2 (6 lớp electron)
- Lanthanum (La, Z=57): [Xe] 5d1 6s2 (6 lớp electron)
- Gold (Au, Z=79): [Xe] 4f14 5d10 6s1 (6 lớp electron)
- Lead (Pb, Z=82): [Xe] 4f14 5d10 6s2 6p2 (6 lớp electron)
- Radon (Rn, Z=86): [Xe] 4f14 5d10 6s2 6p6 (6 lớp electron)
Như vậy, dù có sự khác biệt về số lượng electron trong các phân lớp, tất cả các nguyên tố này đều có 6 lớp electron.
2.3. Tại Sao Số Lớp Electron Lại Quan Trọng?
Số lớp electron quyết định kích thước của nguyên tử và ảnh hưởng trực tiếp đến các tính chất hóa học của nguyên tố. Các nguyên tố có cùng số lớp electron thường có tính chất biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân.
3. Đặc Điểm Của Các Nguyên Tố Chu Kì 6
Chu kì 6 là một chu kì dài, bao gồm nhiều nguyên tố có tính chất đa dạng, từ kim loại kiềm mạnh như Cesium đến khí hiếm trơ như Radon.
3.1. Sự Xuất Hiện Của Họ Lanthanides
Một điểm đặc biệt của chu kì 6 là sự xuất hiện của họ Lanthanides (từ Lanthanum (La, Z=57) đến Lutetium (Lu, Z=71)). Các nguyên tố Lanthanides có cấu hình electron đặc biệt, với electron được thêm vào phân lớp 4f. Điều này dẫn đến các tính chất hóa học tương đồng và khiến chúng thường được xếp riêng thành một hàng dưới bảng tuần hoàn.
3.2. Tính Chất Hóa Học Đa Dạng
Các nguyên tố chu kì 6 thể hiện nhiều tính chất hóa học khác nhau:
- Kim loại kiềm (Cs, Ba): Có tính khử mạnh, dễ dàng nhường electron để tạo thành ion dương.
- Kim loại chuyển tiếp (La, Au): Có khả năng tạo thành nhiều trạng thái oxi hóa khác nhau và tham gia vào nhiều phản ứng hóa học phức tạp.
- Kim loại nặng (Pb): Có độc tính cao và được sử dụng trong nhiều ứng dụng công nghiệp.
- Khí hiếm (Rn): Rất trơ về mặt hóa học, khó tham gia vào các phản ứng hóa học.
3.3. Ứng Dụng Thực Tế Của Các Nguyên Tố Chu Kì 6
Các nguyên tố chu kì 6 có nhiều ứng dụng quan trọng trong đời sống và công nghiệp:
- Cesium: Được sử dụng trong đồng hồ nguyên tử, thiết bị đo lường thời gian chính xác nhất hiện nay.
- Barium: Được sử dụng trong y học để chụp X-quang đường tiêu hóa.
- Lanthanides: Được sử dụng trong sản xuất nam châm vĩnh cửu, chất xúc tác và vật liệu phát quang.
- Gold: Được sử dụng trong trang sức, điện tử và nha khoa.
- Lead: Được sử dụng trong sản xuất ắc quy, vật liệu chống ăn mòn và bảo vệ phóng xạ.
- Radon: Được sử dụng trong xạ trị ung thư (dưới dạng đồng vị phóng xạ).
4. Cách Xác Định Số Lớp Electron Của Một Nguyên Tố
Để xác định số lớp electron của một nguyên tố, bạn có thể sử dụng bảng tuần hoàn hoặc cấu hình electron của nguyên tố đó.
4.1. Sử Dụng Bảng Tuần Hoàn
Số thứ tự của chu kì mà nguyên tố đó thuộc về chính là số lớp electron của nguyên tử nguyên tố đó. Ví dụ, nguyên tố nằm ở chu kì 3 sẽ có 3 lớp electron.
4.2. Sử Dụng Cấu Hình Electron
Cấu hình electron cho biết sự phân bố electron vào các lớp và phân lớp khác nhau. Số lớp electron được xác định bằng số lớp lớn nhất có electron. Ví dụ, cấu hình electron của Sodium (Na) là 1s2 2s2 2p6 3s1, cho thấy Sodium có 3 lớp electron (lớp 1, lớp 2 và lớp 3).
4.3. Ví Dụ Minh Họa
Ví dụ 1: Xác định số lớp electron của Iron (Fe, Z=26).
- Cách 1 (Bảng tuần hoàn): Iron nằm ở chu kì 4, vậy số lớp electron là 4.
- Cách 2 (Cấu hình electron): Cấu hình electron của Iron là 1s2 2s2 2p6 3s2 3p6 3d6 4s2, vậy số lớp electron là 4.
Ví dụ 2: Xác định số lớp electron của Iodine (I, Z=53).
- Cách 1 (Bảng tuần hoàn): Iodine nằm ở chu kì 5, vậy số lớp electron là 5.
- Cách 2 (Cấu hình electron): Cấu hình electron của Iodine là 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 5s2 5p5, vậy số lớp electron là 5.
5. Bài Tập Vận Dụng
Câu 1: Nguyên tố X có số hiệu nguyên tử là 38. Hỏi X có bao nhiêu lớp electron?
Câu 2: Nguyên tố Y có cấu hình electron là 1s2 2s2 2p6 3s2 3p4. Hỏi Y có bao nhiêu lớp electron và thuộc chu kì nào?
Câu 3: Dựa vào bảng tuần hoàn, hãy xác định số lớp electron của các nguyên tố sau: K, Br, Sr, Te.
Câu 4: Cho biết cấu hình electron của nguyên tố Z là [Ar] 3d10 4s2 4p3. Hỏi Z có bao nhiêu lớp electron và thuộc chu kì nào?
Câu 5: Nguyên tố T thuộc chu kì 6. Hỏi T có bao nhiêu lớp electron?
(Đáp án sẽ được cung cấp ở phần cuối bài viết)
6. Mối Liên Hệ Giữa Số Lớp Electron Và Tính Chất Của Nguyên Tố
Số lớp electron không chỉ là một thông tin về cấu trúc nguyên tử, mà còn có mối liên hệ mật thiết với tính chất vật lý và hóa học của nguyên tố.
6.1. Kích Thước Nguyên Tử
Số lớp electron càng lớn, kích thước nguyên tử càng lớn. Điều này là do các electron ở lớp ngoài cùng nằm càng xa hạt nhân, làm tăng bán kính nguyên tử.
6.2. Năng Lượng Ion Hóa
Năng lượng ion hóa là năng lượng cần thiết để tách một electron ra khỏi nguyên tử ở trạng thái khí. Các nguyên tố có số lớp electron lớn thường có năng lượng ion hóa thấp hơn, vì electron ngoài cùng dễ bị tách ra hơn do lực hút của hạt nhân yếu hơn.
6.3. Độ Âm Điện
Độ âm điện là khả năng hút electron của một nguyên tử trong liên kết hóa học. Các nguyên tố có số lớp electron nhỏ thường có độ âm điện cao hơn, vì chúng có xu hướng hút electron để đạt cấu hình electron bền vững hơn.
6.4. Tính Kim Loại Và Phi Kim
Các nguyên tố có số lớp electron ít và năng lượng ion hóa thấp thường là kim loại, vì chúng dễ nhường electron để tạo thành ion dương. Ngược lại, các nguyên tố có số lớp electron nhiều và độ âm điện cao thường là phi kim, vì chúng dễ nhận electron để tạo thành ion âm.
7. Những Lưu Ý Quan Trọng Khi Xác Định Số Lớp Electron
- Luôn nhớ rằng số lớp electron bằng số thứ tự của chu kì mà nguyên tố đó thuộc về.
- Kiểm tra cấu hình electron để đảm bảo không có sai sót trong việc xác định số lớp electron.
- Lưu ý đến các trường hợp ngoại lệ, chẳng hạn như các nguyên tố Lanthanides và Actinides, có cấu hình electron phức tạp hơn.
8. Ứng Dụng Kiến Thức Về Số Lớp Electron Trong Học Tập Và Nghiên Cứu
Hiểu rõ về số lớp electron và cấu trúc bảng tuần hoàn là nền tảng quan trọng để học tốt môn Hóa học và các ngành khoa học liên quan.
8.1. Giải Bài Tập Hóa Học
Kiến thức về số lớp electron giúp bạn giải quyết nhiều bài tập hóa học liên quan đến cấu hình electron, tính chất của nguyên tố và liên kết hóa học.
8.2. Nghiên Cứu Khoa Học
Trong nghiên cứu khoa học, việc hiểu rõ về cấu trúc nguyên tử và tính chất của các nguyên tố là rất quan trọng để phát triển các vật liệu mới, chất xúc tác hiệu quả và công nghệ tiên tiến.
8.3. Ứng Dụng Trong Thực Tế
Từ việc thiết kế pin mặt trời hiệu suất cao đến việc phát triển thuốc chữa bệnh, kiến thức về số lớp electron và tính chất của nguyên tố đóng vai trò then chốt trong nhiều lĩnh vực ứng dụng thực tế.
9. Các Câu Hỏi Thường Gặp Về Số Lớp Electron (FAQ)
Câu 1: Số lớp electron có ảnh hưởng đến kích thước của nguyên tử không?
Có, số lớp electron càng lớn, kích thước nguyên tử càng lớn.
Câu 2: Làm thế nào để xác định số lớp electron của một nguyên tố bằng bảng tuần hoàn?
Số lớp electron bằng số thứ tự của chu kì mà nguyên tố đó thuộc về.
Câu 3: Nguyên tố nào có số lớp electron lớn nhất trong bảng tuần hoàn?
Các nguyên tố thuộc chu kì 7 có số lớp electron lớn nhất, bằng 7.
Câu 4: Số lớp electron có liên quan đến tính kim loại của nguyên tố không?
Có, các nguyên tố có số lớp electron ít và năng lượng ion hóa thấp thường là kim loại.
Câu 5: Tại sao các nguyên tố trong cùng một chu kì lại có tính chất khác nhau?
Mặc dù có cùng số lớp electron, các nguyên tố trong cùng một chu kì có số proton khác nhau, dẫn đến sự khác biệt về điện tích hạt nhân và ảnh hưởng đến tính chất hóa học.
Câu 6: Cấu hình electron của một nguyên tố cho biết những thông tin gì về số lớp electron?
Cấu hình electron cho biết sự phân bố electron vào các lớp và phân lớp khác nhau, từ đó có thể xác định được số lớp electron của nguyên tố.
Câu 7: Số lớp electron có ảnh hưởng đến độ âm điện của nguyên tố không?
Có, các nguyên tố có số lớp electron nhỏ thường có độ âm điện cao hơn.
Câu 8: Các nguyên tố Lanthanides và Actinides có gì đặc biệt về số lớp electron?
Các nguyên tố Lanthanides và Actinides có cấu hình electron phức tạp hơn, với electron được thêm vào phân lớp f, nhưng số lớp electron vẫn tuân theo số thứ tự của chu kì.
Câu 9: Tại sao việc hiểu rõ về số lớp electron lại quan trọng trong học tập môn Hóa học?
Hiểu rõ về số lớp electron là nền tảng quan trọng để học tốt môn Hóa học và các ngành khoa học liên quan, giúp bạn giải quyết các bài tập, nghiên cứu khoa học và ứng dụng kiến thức vào thực tế.
Câu 10: Ở đâu có thể tìm hiểu thêm thông tin chi tiết và đáng tin cậy về cấu trúc nguyên tử và bảng tuần hoàn?
Bạn có thể tìm hiểu thêm thông tin tại XETAIMYDINH.EDU.VN, nơi cung cấp kiến thức khoa học chính xác và dễ hiểu, hoặc tham khảo các sách giáo khoa, tài liệu tham khảo uy tín và các trang web khoa học đáng tin cậy.
10. Lời Kết
Hi vọng bài viết này đã giúp bạn hiểu rõ về số lớp electron của các nguyên tố xếp ở chu kì 6 và vai trò quan trọng của nó trong việc xác định tính chất của nguyên tố. Tại XETAIMYDINH.EDU.VN, chúng tôi luôn nỗ lực cung cấp những thông tin chính xác và hữu ích nhất để bạn có thể nắm vững kiến thức và ứng dụng vào thực tế.
Nếu bạn có bất kỳ thắc mắc nào về xe tải hoặc các vấn đề liên quan đến khoa học và kỹ thuật, đừng ngần ngại liên hệ với chúng tôi. Đội ngũ chuyên gia của Xe Tải Mỹ Đình luôn sẵn sàng tư vấn và giải đáp mọi thắc mắc của bạn.
Liên hệ ngay với Xe Tải Mỹ Đình để được tư vấn và giải đáp mọi thắc mắc về xe tải và kiến thức khoa học liên quan!
- Địa chỉ: Số 18 đường Mỹ Đình, phường Mỹ Đình 2, quận Nam Từ Liêm, Hà Nội.
- Hotline: 0247 309 9988.
- Trang web: XETAIMYDINH.EDU.VN.
Đáp án bài tập vận dụng:
- Câu 1: 5 lớp electron.
- Câu 2: 3 lớp electron, chu kì 3.
- Câu 3: K (4), Br (4), Sr (5), Te (5).
- Câu 4: 4 lớp electron, chu kì 4.
- Câu 5: 6 lớp electron.
Alt: Bảng tuần hoàn các nguyên tố hóa học đầy đủ, với màu sắc phân biệt các nhóm nguyên tố và chu kì
Thông qua bài viết này, Xe Tải Mỹ Đình mong muốn không chỉ cung cấp thông tin về xe tải mà còn chia sẻ kiến thức khoa học hữu ích, giúp bạn đọc có cái nhìn toàn diện và sâu sắc hơn về thế giới xung quanh.
