Biến Thiên Enthalpy là một khái niệm quan trọng trong hóa học, đặc biệt khi nghiên cứu về các phản ứng tỏa nhiệt và thu nhiệt. Bạn muốn tìm hiểu sâu hơn về biến thiên enthalpy, ý nghĩa và cách ứng dụng nó trong thực tế? Hãy cùng Xe Tải Mỹ Đình khám phá chi tiết về chủ đề này để hiểu rõ hơn về các quá trình hóa học diễn ra xung quanh chúng ta.
1. Biến Thiên Enthalpy Là Gì Và Tại Sao Nó Quan Trọng?
Biến thiên enthalpy, hay còn gọi là nhiệt phản ứng, là lượng nhiệt mà một hệ thống hấp thụ hoặc giải phóng trong một quá trình diễn ra ở áp suất không đổi. Nó rất quan trọng vì giúp ta dự đoán và tính toán được năng lượng liên quan đến các phản ứng hóa học, từ đó ứng dụng vào nhiều lĩnh vực khác nhau.
1.1. Định Nghĩa Chi Tiết Về Biến Thiên Enthalpy
Biến thiên enthalpy (ký hiệu là ΔH) là sự thay đổi về hàm enthalpy của một hệ thống trong một quá trình. Enthalpy (H) là một hàm trạng thái, phụ thuộc vào các yếu tố như nhiệt độ, áp suất và thể tích của hệ thống.
Công thức tính biến thiên enthalpy:
ΔH = H(sản phẩm) – H(phản ứng)
Trong đó:
- ΔH: Biến thiên enthalpy của phản ứng
- H(sản phẩm): Tổng enthalpy của các sản phẩm
- H(phản ứng): Tổng enthalpy của các chất phản ứng
Theo PGS.TS Trần Mạnh Trí, Khoa Hóa học, Đại học Khoa học Tự nhiên Hà Nội, biến thiên enthalpy giúp xác định một phản ứng là tỏa nhiệt (ΔH < 0) hay thu nhiệt (ΔH > 0).
1.2. Phân Biệt Biến Thiên Enthalpy Với Các Khái Niệm Liên Quan
Để hiểu rõ hơn về biến thiên enthalpy, cần phân biệt nó với các khái niệm liên quan:
- Nội năng (U): Là tổng năng lượng của hệ thống, bao gồm động năng và thế năng của các phân tử.
- Nhiệt (q): Là năng lượng trao đổi giữa hệ thống và môi trường do sự khác biệt về nhiệt độ.
- Công (w): Là năng lượng trao đổi giữa hệ thống và môi trường không do sự khác biệt về nhiệt độ.
Mối liên hệ giữa các khái niệm này được thể hiện qua định luật thứ nhất của nhiệt động lực học:
ΔU = q + w
Trong điều kiện áp suất không đổi, ta có:
ΔH = ΔU + PΔV = qp
Trong đó:
- P: Áp suất
- ΔV: Sự thay đổi thể tích
1.3. Ý Nghĩa Của Dấu Và Giá Trị Biến Thiên Enthalpy
Dấu và giá trị của biến thiên enthalpy cung cấp thông tin quan trọng về tính chất của phản ứng:
- ΔH < 0 (âm): Phản ứng tỏa nhiệt, giải phóng năng lượng ra môi trường. Ví dụ: Phản ứng đốt cháy nhiên liệu.
- ΔH > 0 (dương): Phản ứng thu nhiệt, hấp thụ năng lượng từ môi trường. Ví dụ: Phản ứng phân hủy đá vôi.
- Giá trị tuyệt đối của ΔH: Cho biết lượng nhiệt tỏa ra hoặc thu vào trong quá trình phản ứng. Giá trị càng lớn, lượng nhiệt trao đổi càng nhiều.
 Biến thiên enthalpy là gì
Biến thiên enthalpy là gì
1.4. Biến Thiên Enthalpy Chuẩn Là Gì?
Biến thiên enthalpy chuẩn (ΔH° ) là biến thiên enthalpy của một phản ứng được đo ở điều kiện chuẩn. Điều kiện chuẩn thường được quy định là 298 K (25°C) và áp suất 1 bar (100 kPa).
Ký hiệu: ΔH°298 hoặc ΔH°
Biến thiên enthalpy chuẩn được sử dụng để so sánh và đánh giá khả năng xảy ra của các phản ứng hóa học khác nhau.
2. Phản Ứng Tỏa Nhiệt Và Thu Nhiệt: Ứng Dụng Trong Thực Tế
Phản ứng tỏa nhiệt và thu nhiệt là hai loại phản ứng hóa học cơ bản, được phân loại dựa trên sự thay đổi về năng lượng nhiệt trong quá trình phản ứng.
2.1. Phản Ứng Tỏa Nhiệt Là Gì?
Phản ứng tỏa nhiệt là phản ứng giải phóng năng lượng dưới dạng nhiệt ra môi trường xung quanh. Trong quá trình này, enthalpy của hệ thống giảm xuống (ΔH < 0).
Ví dụ về phản ứng tỏa nhiệt:
- Đốt cháy nhiên liệu: Đốt than, củi, gas…
- Phản ứng trung hòa: Axit tác dụng với bazơ.
- Phản ứng tạo gỉ sắt: Sắt tác dụng với oxy trong không khí.
2.2. Phản Ứng Thu Nhiệt Là Gì?
Phản ứng thu nhiệt là phản ứng hấp thụ năng lượng dưới dạng nhiệt từ môi trường xung quanh. Trong quá trình này, enthalpy của hệ thống tăng lên (ΔH > 0).
Ví dụ về phản ứng thu nhiệt:
- Phân hủy đá vôi: CaCO3 → CaO + CO2
- Điện phân nước: H2O → H2 + O2
- Nấu ăn: Các quá trình nấu chín thực phẩm thường yêu cầu nhiệt.
2.3. Ứng Dụng Của Phản Ứng Tỏa Nhiệt Và Thu Nhiệt Trong Đời Sống
Các phản ứng tỏa nhiệt và thu nhiệt có nhiều ứng dụng quan trọng trong đời sống và công nghiệp:
- Phản ứng tỏa nhiệt:
- Sưởi ấm: Đốt nhiên liệu để sưởi ấm nhà cửa, đun nước…
- Sản xuất điện: Đốt than, dầu, khí đốt trong các nhà máy nhiệt điện.
- Nấu ăn: Sử dụng gas, củi, điện để nấu chín thức ăn.
- Phản ứng thu nhiệt:
- Sản xuất hóa chất: Nhiều quá trình sản xuất hóa chất đòi hỏi phản ứng thu nhiệt.
- Làm lạnh: Sử dụng các phản ứng thu nhiệt để làm lạnh thực phẩm, đồ uống.
- Điều hòa không khí: Một số hệ thống điều hòa sử dụng phản ứng thu nhiệt để làm mát không khí.
2.4. Ví Dụ Minh Họa Về Ứng Dụng Thực Tế Của Phản Ứng Tỏa Nhiệt
Một ví dụ điển hình về ứng dụng của phản ứng tỏa nhiệt là động cơ đốt trong của xe tải.
- Quá trình: Động cơ đốt trong sử dụng phản ứng đốt cháy nhiên liệu (xăng, dầu diesel) để tạo ra năng lượng cơ học, giúp xe di chuyển.
- Phản ứng hóa học: Nhiên liệu (ví dụ: xăng) phản ứng với oxy trong không khí, tạo ra khí CO2 và H2O, đồng thời giải phóng nhiệt lượng lớn.
- Ứng dụng: Nhiệt lượng này được sử dụng để làm giãn nở khí, đẩy piston và tạo ra công cơ học.
 Ứng dụng của phản ứng tỏa nhiệt
Ứng dụng của phản ứng tỏa nhiệt
2.5. Ví Dụ Minh Họa Về Ứng Dụng Thực Tế Của Phản Ứng Thu Nhiệt
Ứng dụng của phản ứng thu nhiệt có thể thấy rõ trong các túi chườm lạnh y tế.
- Quá trình: Túi chườm lạnh chứa hai chất hóa học riêng biệt. Khi bóp túi, vách ngăn giữa hai chất bị vỡ, chúng trộn lẫn vào nhau và xảy ra phản ứng thu nhiệt.
- Phản ứng hóa học: Phản ứng giữa amoni nitrat và nước là một ví dụ điển hình. Khi amoni nitrat hòa tan trong nước, nó hấp thụ nhiệt từ môi trường xung quanh, làm lạnh túi.
- Ứng dụng: Túi chườm lạnh được sử dụng để giảm đau, sưng tấy do chấn thương.
 Ứng dụng của phản ứng thu nhiệt
Ứng dụng của phản ứng thu nhiệt
3. Nhiệt Tạo Thành: Cơ Sở Để Tính Biến Thiên Enthalpy
Nhiệt tạo thành là một khái niệm quan trọng trong nhiệt hóa học, được sử dụng để tính toán biến thiên enthalpy của các phản ứng hóa học.
3.1. Định Nghĩa Về Nhiệt Tạo Thành
Nhiệt tạo thành (ΔfH) của một chất là biến thiên enthalpy khi tạo thành 1 mol chất đó từ các đơn chất bền vững nhất ở điều kiện xác định.
- Đơn chất bền vững nhất: Là dạng tồn tại ổn định nhất của một nguyên tố ở điều kiện chuẩn. Ví dụ: O2 là dạng bền vững nhất của oxy, C (graphite) là dạng bền vững nhất của carbon.
3.2. Nhiệt Tạo Thành Chuẩn Là Gì?
Nhiệt tạo thành chuẩn (ΔfH°) là nhiệt tạo thành được đo ở điều kiện chuẩn (298 K và 1 bar).
- Giá trị của nhiệt tạo thành chuẩn: Được tra cứu trong các bảng dữ liệu nhiệt động lực học.
- Nhiệt tạo thành chuẩn của các đơn chất bền vững nhất: Bằng 0.
3.3. Cách Tính Biến Thiên Enthalpy Theo Nhiệt Tạo Thành
Biến thiên enthalpy của một phản ứng có thể được tính toán dựa trên nhiệt tạo thành của các chất tham gia và sản phẩm:
ΔrH° = Σ ΔfH°(sản phẩm) – Σ ΔfH°(chất phản ứng)
Trong đó:
- ΔrH°: Biến thiên enthalpy chuẩn của phản ứng
- Σ ΔfH°(sản phẩm): Tổng nhiệt tạo thành chuẩn của các sản phẩm, nhân với hệ số tỷ lượng tương ứng.
- Σ ΔfH°(chất phản ứng): Tổng nhiệt tạo thành chuẩn của các chất phản ứng, nhân với hệ số tỷ lượng tương ứng.
3.4. Ví Dụ Minh Họa Cách Tính Biến Thiên Enthalpy Theo Nhiệt Tạo Thành
Xét phản ứng đốt cháy methane (CH4):
CH4(g) + 2O2(g) → CO2(g) + 2H2O(l)
Biết nhiệt tạo thành chuẩn của các chất:
- ΔfH°(CH4(g)) = -74.8 kJ/mol
- ΔfH°(O2(g)) = 0 kJ/mol
- ΔfH°(CO2(g)) = -393.5 kJ/mol
- ΔfH°(H2O(l)) = -285.8 kJ/mol
Tính biến thiên enthalpy chuẩn của phản ứng:
ΔrH° = [ΔfH°(CO2(g)) + 2 ΔfH°(H2O(l))] – [ΔfH°(CH4(g)) + 2 ΔfH°(O2(g))]
= [-393.5 + 2 (-285.8)] – [-74.8 + 2 0]
= -890.3 kJ/mol
Vậy, phản ứng đốt cháy methane là phản ứng tỏa nhiệt, giải phóng 890.3 kJ nhiệt lượng cho mỗi mol methane bị đốt cháy.
 Công thức tính biến thiên enthalpy
Công thức tính biến thiên enthalpy
4. Năng Lượng Liên Kết Và Mối Liên Hệ Với Biến Thiên Enthalpy
Năng lượng liên kết là năng lượng cần thiết để phá vỡ một liên kết hóa học trong phân tử ở trạng thái khí. Nó có mối liên hệ mật thiết với biến thiên enthalpy của các phản ứng hóa học.
4.1. Định Nghĩa Về Năng Lượng Liên Kết
Năng lượng liên kết (Eb) là năng lượng cần thiết để phá vỡ 1 mol liên kết hóa học cụ thể ở trạng thái khí, tạo thành các nguyên tử ở trạng thái khí.
- Đơn vị: kJ/mol
- Giá trị: Luôn dương (vì cần cung cấp năng lượng để phá vỡ liên kết).
4.2. Mối Liên Hệ Giữa Năng Lượng Liên Kết Và Biến Thiên Enthalpy
Trong một phản ứng hóa học, các liên kết trong chất phản ứng bị phá vỡ, và các liên kết mới được hình thành trong sản phẩm. Biến thiên enthalpy của phản ứng có thể được ước tính dựa trên năng lượng liên kết của các liên kết bị phá vỡ và hình thành:
ΔrH = Σ Eb(liên kết bị phá vỡ) – Σ Eb(liên kết được hình thành)
Trong đó:
- ΔrH: Biến thiên enthalpy của phản ứng
- Σ Eb(liên kết bị phá vỡ): Tổng năng lượng liên kết của các liên kết bị phá vỡ trong chất phản ứng.
- Σ Eb(liên kết được hình thành): Tổng năng lượng liên kết của các liên kết được hình thành trong sản phẩm.
4.3. Lưu Ý Khi Sử Dụng Năng Lượng Liên Kết Để Tính Biến Thiên Enthalpy
- Chỉ áp dụng cho các chất ở trạng thái khí: Năng lượng liên kết được định nghĩa cho các phân tử ở trạng thái khí.
- Giá trị ước tính: Phương pháp này chỉ cho kết quả ước tính, vì nó không tính đến các yếu tố khác như năng lượng tương tác giữa các phân tử.
- Cần biết cấu trúc phân tử: Để tính được năng lượng liên kết, cần biết rõ cấu trúc phân tử và các loại liên kết có trong phân tử.
4.4. Ví Dụ Minh Họa Cách Tính Biến Thiên Enthalpy Theo Năng Lượng Liên Kết
Xét phản ứng:
H2(g) + Cl2(g) → 2HCl(g)
Biết năng lượng liên kết:
- Eb(H-H) = 436 kJ/mol
- Eb(Cl-Cl) = 243 kJ/mol
- Eb(H-Cl) = 431 kJ/mol
Tính biến thiên enthalpy của phản ứng:
ΔrH = [Eb(H-H) + Eb(Cl-Cl)] – [2 * Eb(H-Cl)]
= [436 + 243] – [2 * 431]
= -183 kJ/mol
Vậy, phản ứng trên là phản ứng tỏa nhiệt, giải phóng 183 kJ nhiệt lượng cho mỗi mol H2 phản ứng.
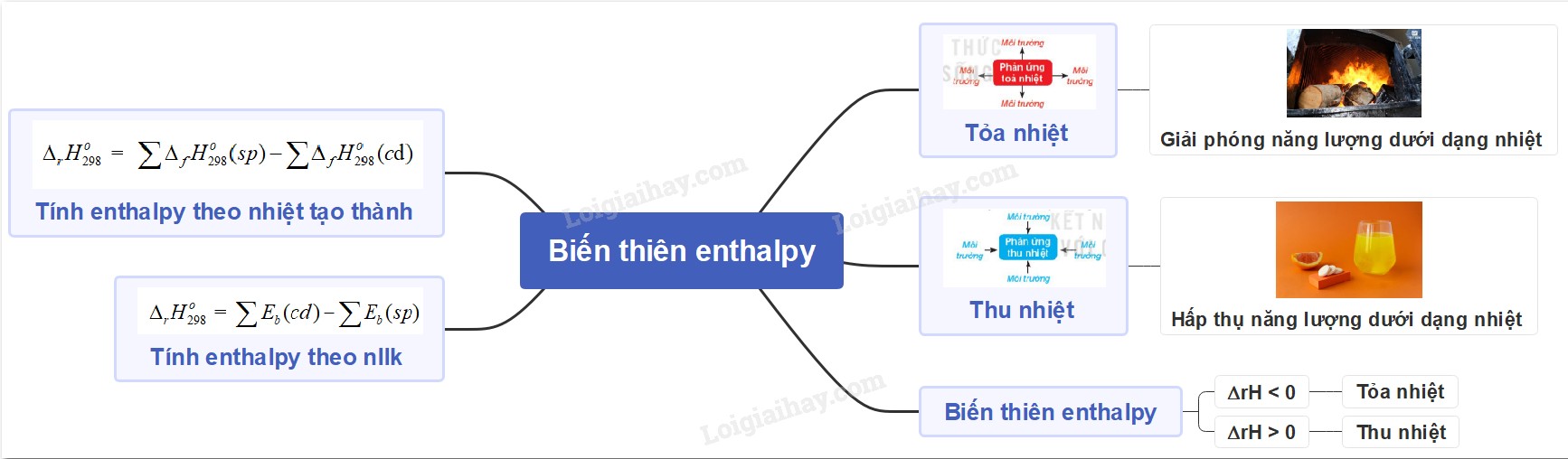 Sơ đồ tư duy biến thiên enthalpy
Sơ đồ tư duy biến thiên enthalpy
5. Các Yếu Tố Ảnh Hưởng Đến Biến Thiên Enthalpy
Biến thiên enthalpy của một phản ứng có thể bị ảnh hưởng bởi nhiều yếu tố khác nhau, bao gồm:
5.1. Nhiệt Độ
Nhiệt độ ảnh hưởng đến năng lượng của các phân tử và do đó ảnh hưởng đến biến thiên enthalpy của phản ứng.
- Quy tắc: Biến thiên enthalpy thường thay đổi không đáng kể trong một khoảng nhiệt độ hẹp. Tuy nhiên, khi nhiệt độ thay đổi lớn, biến thiên enthalpy có thể thay đổi đáng kể.
- Phương trình Kirchhoff: Mô tả sự phụ thuộc của biến thiên enthalpy vào nhiệt độ:
ΔH(T2) = ΔH(T1) + ∫(T1 đến T2) ΔCp dT
Trong đó:
- ΔH(T1): Biến thiên enthalpy ở nhiệt độ T1
- ΔH(T2): Biến thiên enthalpy ở nhiệt độ T2
- ΔCp: Sự thay đổi về nhiệt dung đẳng áp của phản ứng
5.2. Áp Suất
Áp suất có ảnh hưởng đến biến thiên enthalpy, đặc biệt đối với các phản ứng có sự thay đổi về số mol khí.
- Quy tắc: Với các phản ứng có sự thay đổi về số mol khí, áp suất cao có thể làm thay đổi biến thiên enthalpy.
- Ảnh hưởng không đáng kể: Đối với các phản ứng trong pha lỏng hoặc rắn, áp suất thường có ảnh hưởng không đáng kể đến biến thiên enthalpy.
5.3. Trạng Thái Vật Chất
Trạng thái vật chất của các chất phản ứng và sản phẩm (rắn, lỏng, khí) ảnh hưởng đến biến thiên enthalpy.
- Quy tắc: Các chất ở trạng thái khí thường có enthalpy cao hơn so với trạng thái lỏng hoặc rắn. Do đó, sự thay đổi trạng thái vật chất trong phản ứng có thể làm thay đổi đáng kể biến thiên enthalpy.
- Ví dụ: Biến thiên enthalpy của phản ứng tạo thành nước ở trạng thái lỏng khác với phản ứng tạo thành nước ở trạng thái khí.
5.4. Nồng Độ
Nồng độ của các chất phản ứng và sản phẩm có thể ảnh hưởng đến biến thiên enthalpy, đặc biệt trong các dung dịch.
- Quy tắc: Nồng độ cao có thể làm thay đổi hoạt độ của các chất, từ đó ảnh hưởng đến biến thiên enthalpy.
- Dung dịch lý tưởng: Trong các dung dịch lý tưởng, ảnh hưởng của nồng độ đến biến thiên enthalpy là không đáng kể.
5.5. Chất Xúc Tác
Chất xúc tác không làm thay đổi biến thiên enthalpy của phản ứng, nhưng nó có thể làm thay đổi cơ chế phản ứng và tốc độ phản ứng.
- Quy tắc: Chất xúc tác làm giảm năng lượng hoạt hóa của phản ứng, giúp phản ứng xảy ra nhanh hơn, nhưng không ảnh hưởng đến năng lượng tổng thể của phản ứng.
- Ứng dụng: Chất xúc tác được sử dụng rộng rãi trong công nghiệp để tăng hiệu suất của các phản ứng hóa học.
6. Ứng Dụng Thực Tế Của Biến Thiên Enthalpy Trong Công Nghiệp Xe Tải
Biến thiên enthalpy không chỉ là một khái niệm lý thuyết mà còn có nhiều ứng dụng thực tế trong công nghiệp xe tải, đặc biệt trong các lĩnh vực như thiết kế động cơ, nghiên cứu nhiên liệu và xử lý khí thải.
6.1. Thiết Kế Động Cơ
Biến thiên enthalpy được sử dụng để tính toán hiệu suất và hiệu quả của động cơ đốt trong.
- Tính toán nhiệt lượng: Các kỹ sư sử dụng biến thiên enthalpy để tính toán lượng nhiệt được giải phóng từ quá trình đốt cháy nhiên liệu trong động cơ.
- Tối ưu hóa thiết kế: Thông tin này giúp tối ưu hóa thiết kế của động cơ để đạt được hiệu suất cao nhất và giảm thiểu lượng nhiên liệu tiêu thụ.
- Vật liệu chế tạo: Biến thiên enthalpy cũng giúp lựa chọn vật liệu phù hợp để chế tạo các bộ phận của động cơ, đảm bảo chúng có thể chịu được nhiệt độ cao và áp suất lớn.
6.2. Nghiên Cứu Nhiên Liệu
Biến thiên enthalpy được sử dụng để đánh giá chất lượng và hiệu quả của các loại nhiên liệu khác nhau.
- So sánh nhiên liệu: Các nhà khoa học sử dụng biến thiên enthalpy để so sánh lượng nhiệt được giải phóng từ các loại nhiên liệu khác nhau (ví dụ: xăng, dầu diesel, khí tự nhiên).
- Phát triển nhiên liệu mới: Thông tin này giúp phát triển các loại nhiên liệu mới có hiệu suất cao hơn và ít gây ô nhiễm môi trường hơn.
- Phụ gia nhiên liệu: Biến thiên enthalpy cũng được sử dụng để nghiên cứu ảnh hưởng của các chất phụ gia đến quá trình đốt cháy nhiên liệu, từ đó cải thiện hiệu suất và giảm khí thải.
6.3. Xử Lý Khí Thải
Biến thiên enthalpy được sử dụng để thiết kế và tối ưu hóa các hệ thống xử lý khí thải của xe tải.
- Tính toán nhiệt lượng: Các kỹ sư sử dụng biến thiên enthalpy để tính toán lượng nhiệt cần thiết để thực hiện các phản ứng hóa học trong hệ thống xử lý khí thải (ví dụ: oxy hóa các chất ô nhiễm).
- Thiết kế bộ xúc tác: Thông tin này giúp thiết kế các bộ xúc tác hiệu quả hơn, giúp loại bỏ các chất ô nhiễm như NOx, CO và HC trong khí thải.
- Giảm thiểu ô nhiễm: Biến thiên enthalpy cũng được sử dụng để nghiên cứu các phương pháp giảm thiểu khí thải từ động cơ, từ đó bảo vệ môi trường và sức khỏe con người.
6.4. Ví Dụ Cụ Thể Về Ứng Dụng Trong Xe Tải
- Động cơ diesel: Trong động cơ diesel, biến thiên enthalpy của quá trình đốt cháy dầu diesel được sử dụng để tính toán hiệu suất của động cơ và lựa chọn vật liệu chịu nhiệt phù hợp.
- Hệ thống xử lý khí thải: Trong hệ thống xử lý khí thải của xe tải, biến thiên enthalpy của các phản ứng oxy hóa NOx được sử dụng để thiết kế bộ xúc tác và điều chỉnh nhiệt độ hoạt động của hệ thống.
- Nhiên liệu sinh học: Biến thiên enthalpy được sử dụng để so sánh hiệu quả của nhiên liệu sinh học (ví dụ: biodiesel) với dầu diesel truyền thống, từ đó đánh giá tính khả thi của việc sử dụng nhiên liệu sinh học trong xe tải.
Ảnh minh họa động cơ xe tải
7. Các Phương Pháp Đo Và Tính Biến Thiên Enthalpy
Để xác định biến thiên enthalpy của một phản ứng, có nhiều phương pháp đo và tính toán khác nhau.
7.1. Phương Pháp Calorimet
Calorimet là phương pháp đo trực tiếp nhiệt lượng tỏa ra hoặc thu vào trong một phản ứng hóa học.
- Calorimet kế: Thiết bị dùng để đo nhiệt lượng, bao gồm calorimet kế đẳng áp (đo ở áp suất không đổi) và calorimet kế đẳng tích (đo ở thể tích không đổi).
- Nguyên tắc: Nhiệt lượng tỏa ra hoặc thu vào được tính toán dựa trên sự thay đổi nhiệt độ của calorimet kế và nhiệt dung của nó.
7.2. Phương Pháp Sử Dụng Nhiệt Tạo Thành
Biến thiên enthalpy của phản ứng có thể được tính toán dựa trên nhiệt tạo thành của các chất tham gia và sản phẩm.
- Công thức: ΔrH° = Σ ΔfH°(sản phẩm) – Σ ΔfH°(chất phản ứng)
- Dữ liệu: Nhiệt tạo thành chuẩn của các chất được tra cứu trong các bảng dữ liệu nhiệt động lực học.
7.3. Phương Pháp Sử Dụng Năng Lượng Liên Kết
Biến thiên enthalpy của phản ứng có thể được ước tính dựa trên năng lượng liên kết của các liên kết bị phá vỡ và hình thành.
- Công thức: ΔrH = Σ Eb(liên kết bị phá vỡ) – Σ Eb(liên kết được hình thành)
- Lưu ý: Phương pháp này chỉ cho kết quả ước tính và áp dụng cho các chất ở trạng thái khí.
7.4. Phương Pháp Sử Dụng Chu Trình Hess
Chu trình Hess là một phương pháp gián tiếp để tính biến thiên enthalpy của một phản ứng bằng cách sử dụng các phản ứng trung gian.
- Nguyên tắc: Biến thiên enthalpy của một phản ứng chỉ phụ thuộc vào trạng thái đầu và trạng thái cuối của hệ thống, không phụ thuộc vào con đường phản ứng.
- Ứng dụng: Chu trình Hess được sử dụng để tính biến thiên enthalpy của các phản ứng khó đo trực tiếp bằng calorimet.
7.5. Các Phần Mềm Và Công Cụ Tính Toán
Hiện nay, có nhiều phần mềm và công cụ trực tuyến hỗ trợ tính toán biến thiên enthalpy của các phản ứng hóa học.
- Phần mềm: CHEMCAD, Aspen HYSYS, Gaussian…
- Công cụ trực tuyến: NIST Chemistry WebBook, Wolfram Alpha…
- Ưu điểm: Tiết kiệm thời gian và công sức, độ chính xác cao.
8. Những Lưu Ý Quan Trọng Khi Nghiên Cứu Về Biến Thiên Enthalpy
Khi nghiên cứu về biến thiên enthalpy, cần lưu ý một số điểm quan trọng để đảm bảo tính chính xác và độ tin cậy của kết quả.
8.1. Đảm Bảo Điều Kiện Phản Ứng Ổn Định
- Áp suất không đổi: Biến thiên enthalpy được định nghĩa cho các quá trình diễn ra ở áp suất không đổi.
- Nhiệt độ ổn định: Nhiệt độ cần được kiểm soát và duy trì ổn định trong quá trình đo.
- Tránh các yếu tố gây nhiễu: Đảm bảo không có các yếu tố bên ngoài (ví dụ: ánh sáng, rung động) ảnh hưởng đến quá trình phản ứng.
8.2. Sử Dụng Thiết Bị Đo Chính Xác
- Calorimet kế: Chọn calorimet kế phù hợp với loại phản ứng và đảm bảo nó được hiệu chuẩn đúng cách.
- Cảm biến nhiệt độ: Sử dụng cảm biến nhiệt độ có độ chính xác cao và được hiệu chuẩn thường xuyên.
- Thiết bị đo áp suất: Nếu phản ứng có sự thay đổi về số mol khí, cần sử dụng thiết bị đo áp suất để kiểm soát áp suất.
8.3. Kiểm Tra Độ Tinh Khiết Của Các Chất
- Chất phản ứng: Sử dụng các chất phản ứng có độ tinh khiết cao để tránh các phản ứng phụ không mong muốn.
- Dung môi: Chọn dung môi phù hợp và đảm bảo nó không chứa các tạp chất ảnh hưởng đến phản ứng.
- Xử lý mẫu: Chuẩn bị mẫu cẩn thận để loại bỏ các tạp chất và đảm bảo tính đồng nhất.
8.4. Tham Khảo Các Nguồn Dữ Liệu Tin Cậy
- Bảng dữ liệu nhiệt động lực học: Sử dụng các bảng dữ liệu nhiệt động lực học từ các nguồn uy tín như NIST, CRC Handbook.
- Bài báo khoa học: Tham khảo các bài báo khoa học đã được công bố trên các tạp chí chuyên ngành.
- Sách giáo trình: Đọc sách giáo trình và tài liệu tham khảo từ các nhà xuất bản uy tín.
8.5. Đánh Giá Sai Số Và Độ Tin Cậy
- Tính toán sai số: Tính toán sai số của các phép đo và đánh giá ảnh hưởng của chúng đến kết quả cuối cùng.
- So sánh với các kết quả khác: So sánh kết quả của bạn với các kết quả đã được công bố bởi các nhà nghiên cứu khác.
- Thực hiện lặp lại: Thực hiện các phép đo lặp lại để đảm bảo tính ổn định và độ tin cậy của kết quả.
9. FAQ – Câu Hỏi Thường Gặp Về Biến Thiên Enthalpy
Dưới đây là một số câu hỏi thường gặp về biến thiên enthalpy, giúp bạn hiểu rõ hơn về khái niệm này:
9.1. Biến Thiên Enthalpy Có Phải Là Một Hàm Trạng Thái Không?
Trả lời: Đúng vậy, biến thiên enthalpy là một hàm trạng thái. Điều này có nghĩa là giá trị của nó chỉ phụ thuộc vào trạng thái đầu và trạng thái cuối của hệ thống, chứ không phụ thuộc vào con đường mà hệ thống đi qua để đạt được trạng thái cuối.
9.2. Tại Sao Biến Thiên Enthalpy Quan Trọng Trong Hóa Học?
Trả lời: Biến thiên enthalpy quan trọng vì nó cho phép chúng ta dự đoán và tính toán được năng lượng liên quan đến các phản ứng hóa học. Nó giúp chúng ta hiểu rõ hơn về tính chất của các phản ứng, từ đó ứng dụng vào nhiều lĩnh vực khác nhau như thiết kế động cơ, nghiên cứu nhiên liệu và xử lý khí thải.
9.3. Làm Thế Nào Để Phân Biệt Phản Ứng Tỏa Nhiệt Và Thu Nhiệt Dựa Vào Biến Thiên Enthalpy?
Trả lời: Phản ứng tỏa nhiệt có biến thiên enthalpy âm (ΔH < 0), tức là giải phóng nhiệt ra môi trường. Ngược lại, phản ứng thu nhiệt có biến thiên enthalpy dương (ΔH > 0), tức là hấp thụ nhiệt từ môi trường.
9.4. Biến Thiên Enthalpy Có Thay Đổi Theo Nhiệt Độ Không?
Trả lời: Có, biến thiên enthalpy có thể thay đổi theo nhiệt độ, nhưng sự thay đổi này thường không đáng kể trong một khoảng nhiệt độ hẹp. Khi nhiệt độ thay đổi lớn, biến thiên enthalpy có thể thay đổi đáng kể.
9.5. Nhiệt Tạo Thành Chuẩn Của Một Đơn Chất Bền Vững Nhất Bằng Bao Nhiêu?
Trả lời: Nhiệt tạo thành chuẩn của một đơn chất bền vững nhất luôn bằng 0.
9.6. Làm Thế Nào Để Tính Biến Thiên Enthalpy Của Một Phản Ứng Nếu Biết Nhiệt Tạo Thành Của Các Chất Tham Gia Và Sản Phẩm?
Trả lời: Biến thiên enthalpy của phản ứng có thể được tính bằng công thức: ΔrH° = Σ ΔfH°(sản phẩm) – Σ ΔfH°(chất phản ứng), trong đó ΔfH° là nhiệt tạo thành chuẩn của các chất.
9.7. Năng Lượng Liên Kết Có Mối Liên Hệ Như Thế Nào Với Biến Thiên Enthalpy?
Trả lời: Năng lượng liên kết là năng lượng cần thiết để phá vỡ một liên kết hóa học. Biến thiên enthalpy của phản ứng có thể được ước tính dựa trên năng lượng liên kết của các liên kết bị phá vỡ và hình thành trong phản ứng.
9.8. Các Yếu Tố Nào Có Thể Ảnh Hưởng Đến Biến Thiên Enthalpy?
Trả lời: Các yếu tố có thể ảnh hưởng đến biến thiên enthalpy bao gồm nhiệt độ, áp suất, trạng thái vật chất, nồng độ và chất xúc tác.
9.9. Phương Pháp Nào Được Sử Dụng Để Đo Biến Thiên Enthalpy?
Trả lời: Phương pháp chính để đo biến thiên enthalpy là calorimet, sử dụng calorimet kế để đo trực tiếp nhiệt lượng tỏa ra hoặc thu vào trong một phản ứng hóa học.
9.10. Tại Sao Cần Lưu Ý Đến Điều Kiện Phản Ứng Khi Nghiên Cứu Về Biến Thiên Enthalpy?
Trả lời: Cần lưu ý đến điều kiện phản ứng vì biến thiên enthalpy phụ thuộc vào các yếu tố như áp suất, nhiệt độ và trạng thái vật chất. Đảm bảo điều kiện phản ứng ổn định và được kiểm soát giúp đảm bảo tính chính xác và độ tin cậy của kết quả nghiên cứu.
10. Xe Tải Mỹ Đình – Địa Chỉ Tin Cậy Cho Mọi Thông Tin Về Xe Tải
Bạn đang tìm kiếm thông tin chi tiết và đáng tin cậy về các loại xe tải? Bạn muốn được tư vấn về lựa chọn xe phù hợp với nhu cầu và ngân sách của mình? Hãy đến với Xe Tải Mỹ Đình – địa chỉ uy tín hàng đầu tại Hà Nội, chuyên cung cấp các dịch vụ tư vấn, mua bán và bảo dưỡng xe tải.
Tại XETAIMYDINH.EDU.VN, bạn sẽ tìm thấy:
- Thông tin chi tiết và cập nhật về các loại xe tải có sẵn trên thị trường, từ các thương hiệu nổi tiếng đến các dòng xe mới nhất.
- So sánh giá cả và thông số kỹ thuật giữa các dòng xe, giúp bạn dễ dàng lựa chọn được chiếc xe phù hợp nhất.
- Tư vấn chuyên nghiệp từ đội ngũ nhân viên giàu kinh nghiệm, giúp bạn giải đáp mọi thắc mắc liên quan đến xe tải.
- Thông tin về các dịch vụ sửa chữa và bảo dưỡng xe tải uy tín trong khu vực Mỹ Đình và Hà Nội.
Xe Tải Mỹ Đình cam kết mang đến cho bạn những thông tin chính xác, khách quan và hữu ích nhất, giúp bạn đưa ra quyết định đúng đắn khi mua xe tải.
Đừng chần chừ nữa, hãy truy cập ngay XETAIMYDINH.EDU.VN để khám phá thế giới xe tải và nhận được sự tư vấn tận tình từ chúng tôi!
Liên hệ ngay với Xe Tải Mỹ Đình để được hỗ trợ tốt nhất:
- Địa chỉ: Số 18 đường Mỹ Đình, phường Mỹ Đình 2, quận Nam Từ Liêm, Hà Nội
- Hotline: 0247 309 9988
- Trang web: XETAIMYDINH.EDU.VN
Xe Tải Mỹ Đình – Đồng hành cùng bạn trên mọi nẻo đường!