Bảng Cấu Hình Electron là chìa khóa để hiểu rõ tính chất hóa học của các nguyên tố. Tại XETAIMYDINH.EDU.VN, chúng tôi cung cấp thông tin chi tiết và dễ hiểu về bảng cấu hình electron, giúp bạn nắm vững kiến thức này một cách hiệu quả nhất. Khám phá ngay cấu hình electron, cách viết cấu hình electron và bài tập vận dụng.
1. Bảng Cấu Hình Electron Là Gì?
Bảng cấu hình electron, hay còn gọi là cấu hình electron nguyên tử, mô tả sự phân bố các electron trong các lớp và phân lớp electron của một nguyên tử. Đây là một khái niệm quan trọng trong hóa học, giúp ta hiểu rõ hơn về tính chất và khả năng tương tác của các nguyên tố.
1.1. Tại Sao Cần Hiểu Về Bảng Cấu Hình Electron?
Hiểu về bảng cấu hình electron mang lại nhiều lợi ích quan trọng:
- Dự đoán tính chất hóa học: Cấu hình electron quyết định khả năng tạo liên kết hóa học của một nguyên tố.
- Giải thích các hiện tượng hóa học: Cấu hình electron giúp giải thích tại sao một số nguyên tố lại hoạt động mạnh hơn các nguyên tố khác.
- Nền tảng cho các khái niệm nâng cao: Cấu hình electron là cơ sở để hiểu các khái niệm phức tạp hơn như liên kết cộng hóa trị, liên kết ion và cấu trúc phân tử. Theo nghiên cứu của Trường Đại học Khoa học Tự nhiên Hà Nội, việc nắm vững cấu hình electron giúp sinh viên tiếp thu kiến thức hóa học tốt hơn.
1.2. Các Thành Phần Cơ Bản Của Bảng Cấu Hình Electron
Để hiểu rõ về bảng cấu hình electron, cần nắm vững các thành phần sau:
- Lớp electron: Các electron được sắp xếp thành các lớp khác nhau xung quanh hạt nhân, được đánh số từ 1 đến 7 (hoặc K, L, M, N, O, P, Q).
- Phân lớp electron: Mỗi lớp electron lại được chia thành các phân lớp, ký hiệu là s, p, d, f.
- Số electron: Số electron trong mỗi phân lớp được biểu thị bằng số mũ. Ví dụ: 1s², 2p⁶.
 Bảng Cấu Hình Electron Nguyên Tử Và Phân Mức Năng Lượng
Bảng Cấu Hình Electron Nguyên Tử Và Phân Mức Năng Lượng
2. Cách Viết Bảng Cấu Hình Electron Chi Tiết
Việc viết bảng cấu hình electron đòi hỏi sự hiểu biết về thứ tự năng lượng của các lớp và phân lớp, cũng như các quy tắc phân bố electron.
2.1. Nguyên Tắc Aufbau (Nguyên Lý Xây Dựng)
Nguyên tắc Aufbau nói rằng các electron sẽ chiếm các orbital có mức năng lượng thấp nhất trước khi chuyển sang các orbital có mức năng lượng cao hơn. Thứ tự năng lượng của các orbital như sau: 1s < 2s < 2p < 3s < 3p < 4s < 3d < 4p < 5s < 4d < 5p < 6s < 4f < 5d < 6p < 7s < 5f < 6d < 7p.
2.2. Quy Tắc Hund
Quy tắc Hund nói rằng trong cùng một phân lớp, các electron sẽ phân bố sao cho số electron độc thân là tối đa và các electron này phải có spin song song. Ví dụ, đối với phân lớp p (có 3 orbital), các electron sẽ lần lượt chiếm từng orbital một trước khi ghép đôi.
2.3. Nguyên Lý Pauli
Nguyên lý Pauli nói rằng trong một nguyên tử, không có hai electron nào có thể có cùng bốn số lượng tử (n, l, ml, ms). Điều này có nghĩa là mỗi orbital chỉ có thể chứa tối đa hai electron và chúng phải có spin ngược nhau.
2.4. Các Bước Viết Cấu Hình Electron
Để viết cấu hình electron một cách chính xác, hãy tuân theo các bước sau:
Bước 1: Xác định số electron của nguyên tử. Số electron bằng số proton, và bằng số nguyên tử (Z).
Bước 2: Xác định thứ tự các orbital theo nguyên tắc Aufbau.
Bước 3: Điền electron vào các orbital theo thứ tự năng lượng tăng dần, tuân theo quy tắc Hund và nguyên lý Pauli.
Bước 4: Viết cấu hình electron, biểu diễn số lớp (n), ký hiệu phân lớp (s, p, d, f) và số electron trong phân lớp (số mũ).
Ví dụ: Viết cấu hình electron của nguyên tử Oxygen (O, Z = 8).
- Số electron: 8
- Thứ tự orbital: 1s < 2s < 2p
- Điền electron: 1s² 2s² 2p⁴
- Cấu hình electron: 1s²2s²2p⁴
 Cấu Hình E Của Nguyên Tử Na
Cấu Hình E Của Nguyên Tử Na
3. Cấu Hình Electron Biểu Diễn Điều Gì?
Cấu hình electron không chỉ là một cách viết, mà còn mang nhiều ý nghĩa quan trọng về tính chất của nguyên tử.
3.1. Số Lớp Electron Và Vị Trí Trong Bảng Tuần Hoàn
Số lớp electron cho biết chu kỳ của nguyên tố trong bảng tuần hoàn. Ví dụ, các nguyên tố có 3 lớp electron (ví dụ: Na, Mg, Al) thuộc chu kỳ 3.
3.2. Số Electron Hóa Trị Và Tính Chất Hóa Học
Số electron hóa trị (electron ở lớp ngoài cùng) quyết định tính chất hóa học của nguyên tố. Các nguyên tố có số electron hóa trị giống nhau thường có tính chất hóa học tương tự nhau. Theo báo cáo của Bộ Khoa học và Công nghệ, các nghiên cứu về electron hóa trị giúp dự đoán khả năng tạo hợp chất của các nguyên tố.
3.3. Xác Định Nguyên Tố Kim Loại, Phi Kim, Khí Hiếm
- Kim loại: Thường có 1, 2 hoặc 3 electron ở lớp ngoài cùng. Dễ nhường electron để tạo thành ion dương.
- Phi kim: Thường có 5, 6 hoặc 7 electron ở lớp ngoài cùng. Dễ nhận electron để tạo thành ion âm.
- Khí hiếm: Có 8 electron ở lớp ngoài cùng (trừ He có 2). Rất bền vững và khó tham gia phản ứng hóa học.
4. Bảng Cấu Hình Electron Của 20 Nguyên Tố Đầu Tiên
Dưới đây là bảng cấu hình electron của 20 nguyên tố đầu tiên trong bảng tuần hoàn:
| Số Thứ Tự (Z) | Ký Hiệu | Tên Nguyên Tố | Cấu Hình Electron |
|---|---|---|---|
| 1 | H | Hydrogen | 1s¹ |
| 2 | He | Helium | 1s² |
| 3 | Li | Lithium | 1s²2s¹ |
| 4 | Be | Beryllium | 1s²2s² |
| 5 | B | Boron | 1s²2s²2p¹ |
| 6 | C | Carbon | 1s²2s²2p² |
| 7 | N | Nitrogen | 1s²2s²2p³ |
| 8 | O | Oxygen | 1s²2s²2p⁴ |
| 9 | F | Fluorine | 1s²2s²2p⁵ |
| 10 | Ne | Neon | 1s²2s²2p⁶ |
| 11 | Na | Sodium | 1s²2s²2p⁶3s¹ |
| 12 | Mg | Magnesium | 1s²2s²2p⁶3s² |
| 13 | Al | Aluminum | 1s²2s²2p⁶3s²3p¹ |
| 14 | Si | Silicon | 1s²2s²2p⁶3s²3p² |
| 15 | P | Phosphorus | 1s²2s²2p⁶3s²3p³ |
| 16 | S | Sulfur | 1s²2s²2p⁶3s²3p⁴ |
| 17 | Cl | Chlorine | 1s²2s²2p⁶3s²3p⁵ |
| 18 | Ar | Argon | 1s²2s²2p⁶3s²3p⁶ |
| 19 | K | Potassium | 1s²2s²2p⁶3s²3p⁶4s¹ |
| 20 | Ca | Calcium | 1s²2s²2p⁶3s²3p⁶4s² |
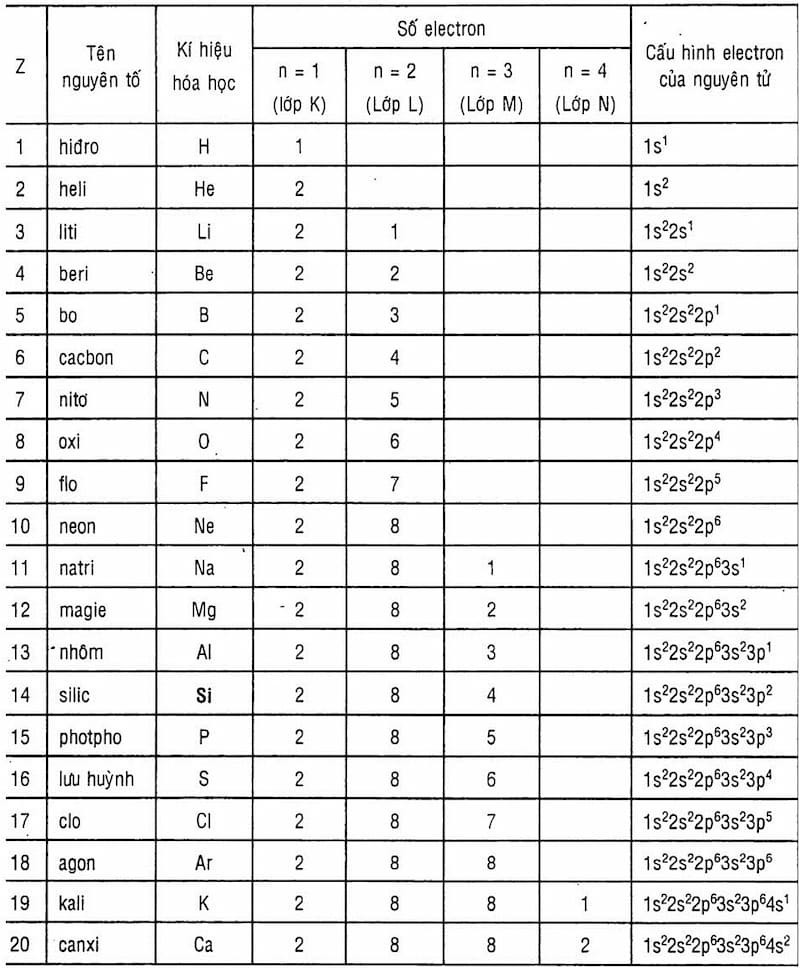 Bảng Cấu Hình E Nguyên Tử Của 20 Nguyên Tố Đầu Tiên
Bảng Cấu Hình E Nguyên Tử Của 20 Nguyên Tố Đầu Tiên
5. Các Trường Hợp Đặc Biệt Của Cấu Hình Electron
Một số nguyên tố có cấu hình electron không tuân theo quy tắc Aufbau một cách tuyệt đối. Điều này xảy ra do sự ổn định đặc biệt của các cấu hình bán bão hòa (ví dụ: d⁵) và bão hòa (ví dụ: d¹⁰).
5.1. Crom (Cr) và Đồng (Cu)
- Crom (Cr, Z = 24): Cấu hình electron dự kiến là [Ar] 3d⁴ 4s². Tuy nhiên, cấu hình thực tế là [Ar] 3d⁵ 4s¹. Một electron từ orbital 4s chuyển sang orbital 3d để tạo cấu hình bán bão hòa d⁵, làm tăng tính ổn định của nguyên tử.
- Đồng (Cu, Z = 29): Cấu hình electron dự kiến là [Ar] 3d⁹ 4s². Tuy nhiên, cấu hình thực tế là [Ar] 3d¹⁰ 4s¹. Một electron từ orbital 4s chuyển sang orbital 3d để tạo cấu hình bão hòa d¹⁰, làm tăng tính ổn định của nguyên tử.
5.2. Các Nguyên Tố Khác
Các nguyên tố khác trong nhóm d (như Molypden, Bạc, Vàng) cũng có thể có cấu hình electron tương tự như Cr và Cu, do hiệu ứng tương tác giữa các electron.
6. Bài Tập Vận Dụng Về Cấu Hình Electron
Để củng cố kiến thức về cấu hình electron, hãy cùng làm một số bài tập vận dụng.
6.1. Bài Tập Cơ Bản
Bài 1: Viết cấu hình electron của các nguyên tố sau:
- Potassium (K, Z = 19)
- Iron (Fe, Z = 26)
- Bromine (Br, Z = 35)
Bài 2: Xác định số electron hóa trị của các nguyên tố sau:
- Carbon (C, Z = 6)
- Sulfur (S, Z = 16)
- Aluminum (Al, Z = 13)
Bài 3: Cho biết các nguyên tố sau là kim loại, phi kim hay khí hiếm:
- Sodium (Na, Z = 11)
- Chlorine (Cl, Z = 17)
- Argon (Ar, Z = 18)
6.2. Bài Tập Nâng Cao
Bài 1: Một nguyên tố X có cấu hình electron lớp ngoài cùng là ns²np⁴.
- Xác định vị trí của X trong bảng tuần hoàn (chu kỳ, nhóm).
- Cho biết X là kim loại hay phi kim.
- Viết công thức oxide cao nhất của X.
Bài 2: Nguyên tố Y có số hiệu nguyên tử là 25.
- Viết cấu hình electron của Y.
- Cho biết Y thuộc loại nguyên tố s, p, d hay f.
- Y có thể tạo thành các ion nào?
Bài 3: Viết cấu hình electron của ion Fe²⁺ và Fe³⁺ (biết Fe có Z = 26).
7. Tầm Quan Trọng Của Cấu Hình Electron Trong Hóa Học
Cấu hình electron là nền tảng để hiểu nhiều khái niệm và hiện tượng hóa học quan trọng.
7.1. Liên Kết Hóa Học
Cấu hình electron quyết định cách các nguyên tử tương tác với nhau để tạo thành liên kết hóa học. Ví dụ, các nguyên tử có xu hướng đạt cấu hình electron bền vững (giống khí hiếm) bằng cách nhường, nhận hoặc chia sẻ electron. Theo nghiên cứu của Viện Hóa học, Viện Hàn lâm Khoa học và Công nghệ Việt Nam, việc hiểu cấu hình electron giúp phát triển các vật liệu mới với tính chất đặc biệt.
7.2. Tính Chất Hóa Học Của Các Nguyên Tố
Cấu hình electron quyết định tính chất hóa học của các nguyên tố, bao gồm tính khử, tính oxy hóa, khả năng tạo phức chất và tính axit-bazơ.
7.3. Các Phản Ứng Hóa Học
Cấu hình electron giúp dự đoán và giải thích cơ chế của các phản ứng hóa học. Ví dụ, các phản ứng oxy hóa-khử liên quan đến sự chuyển electron giữa các nguyên tử, và cấu hình electron cho biết nguyên tử nào dễ nhường electron (tính khử) và nguyên tử nào dễ nhận electron (tính oxy hóa).
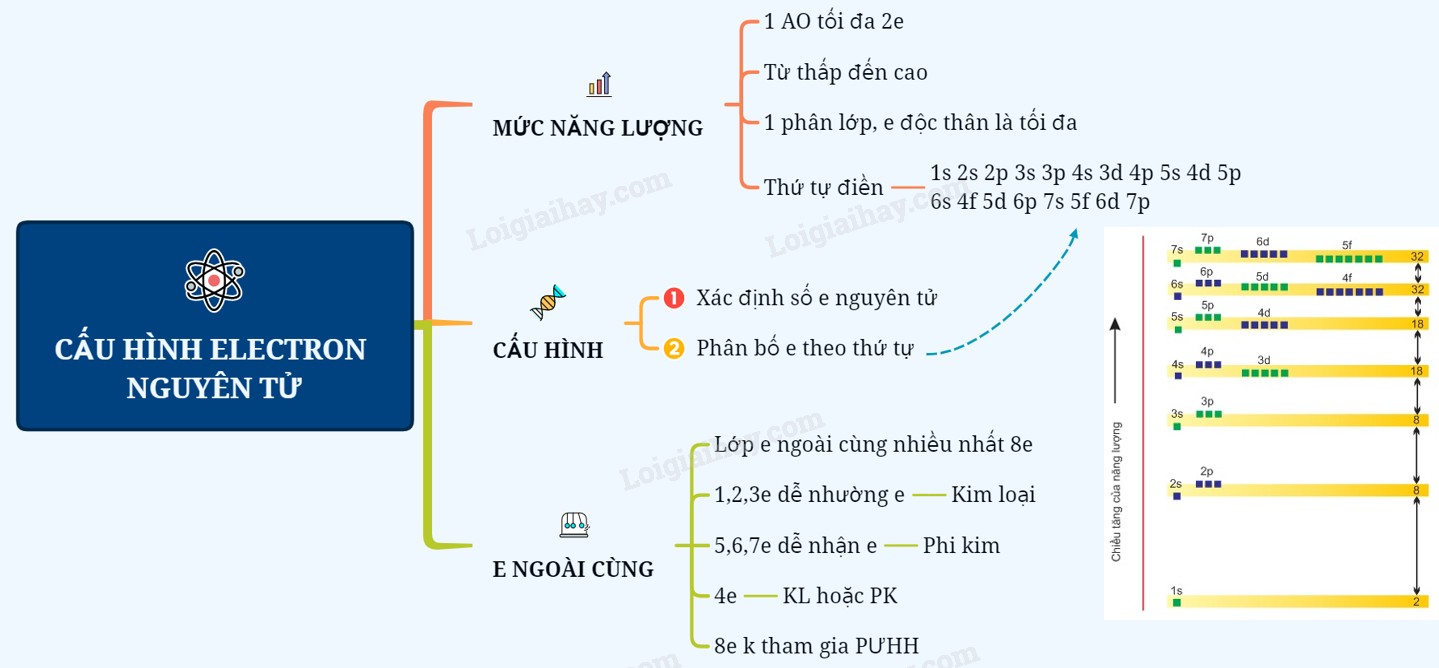 Sơ Đồ Tư Duy Cấu Hình E Nguyên Tử
Sơ Đồ Tư Duy Cấu Hình E Nguyên Tử
8. Câu Hỏi Thường Gặp Về Bảng Cấu Hình Electron (FAQ)
Để giúp bạn hiểu rõ hơn về bảng cấu hình electron, chúng tôi đã tổng hợp một số câu hỏi thường gặp và câu trả lời chi tiết.
8.1. Cấu Hình Electron Là Gì?
Cấu hình electron là sự phân bố các electron trong các lớp và phân lớp electron của một nguyên tử. Nó cho biết số lượng electron trong mỗi lớp và phân lớp.
8.2. Tại Sao Cần Viết Cấu Hình Electron?
Viết cấu hình electron giúp hiểu rõ hơn về tính chất hóa học của nguyên tố, dự đoán khả năng tạo liên kết hóa học và giải thích các hiện tượng hóa học.
8.3. Các Quy Tắc Nào Cần Tuân Thủ Khi Viết Cấu Hình Electron?
Khi viết cấu hình electron, cần tuân thủ nguyên tắc Aufbau, quy tắc Hund và nguyên lý Pauli.
8.4. Số Electron Tối Đa Trong Mỗi Lớp Là Bao Nhiêu?
Số electron tối đa trong mỗi lớp được tính theo công thức 2n², trong đó n là số thứ tự của lớp. Ví dụ, lớp 1 (K) có tối đa 2 electron, lớp 2 (L) có tối đa 8 electron, lớp 3 (M) có tối đa 18 electron.
8.5. Các Phân Lớp s, p, d, f Chứa Tối Đa Bao Nhiêu Electron?
- Phân lớp s chứa tối đa 2 electron.
- Phân lớp p chứa tối đa 6 electron.
- Phân lớp d chứa tối đa 10 electron.
- Phân lớp f chứa tối đa 14 electron.
8.6. Electron Hóa Trị Là Gì?
Electron hóa trị là các electron ở lớp ngoài cùng của nguyên tử. Chúng quyết định tính chất hóa học của nguyên tố.
8.7. Tại Sao Crom (Cr) Và Đồng (Cu) Có Cấu Hình Electron Đặc Biệt?
Crom và đồng có cấu hình electron đặc biệt do sự ổn định của các cấu hình bán bão hòa (d⁵) và bão hòa (d¹⁰).
8.8. Cấu Hình Electron Có Thay Đổi Khi Nguyên Tử Tạo Thành Ion Không?
Có, cấu hình electron thay đổi khi nguyên tử tạo thành ion. Nguyên tử kim loại có xu hướng nhường electron để tạo thành ion dương (cation), trong khi nguyên tử phi kim có xu hướng nhận electron để tạo thành ion âm (anion).
8.9. Làm Thế Nào Để Xác Định Vị Trí Của Một Nguyên Tố Trong Bảng Tuần Hoàn Dựa Vào Cấu Hình Electron?
Số lớp electron cho biết chu kỳ của nguyên tố, và số electron hóa trị cho biết nhóm của nguyên tố (đối với các nguyên tố nhóm A).
8.10. Ứng Dụng Của Cấu Hình Electron Trong Thực Tế Là Gì?
Cấu hình electron được ứng dụng trong nhiều lĩnh vực, bao gồm:
- Nghiên cứu vật liệu mới: Thiết kế và phát triển các vật liệu có tính chất đặc biệt.
- Hóa học phân tích: Xác định thành phần và cấu trúc của các chất.
- Hóa học công nghiệp: Tối ưu hóa các quy trình sản xuất hóa chất.
9. Lời Kết
Hiểu rõ về bảng cấu hình electron là rất quan trọng để nắm vững kiến thức hóa học và ứng dụng vào thực tế. Xe Tải Mỹ Đình hy vọng rằng bài viết này đã cung cấp cho bạn những thông tin hữu ích và giúp bạn tự tin hơn trong học tập và công việc. Nếu bạn có bất kỳ thắc mắc nào hoặc cần tư vấn thêm về xe tải, đừng ngần ngại liên hệ với chúng tôi tại XETAIMYDINH.EDU.VN hoặc qua hotline 0247 309 9988. Địa chỉ của chúng tôi là Số 18 đường Mỹ Đình, phường Mỹ Đình 2, quận Nam Từ Liêm, Hà Nội. Chúng tôi luôn sẵn lòng hỗ trợ bạn!
Bạn đang gặp khó khăn trong việc tìm kiếm thông tin về xe tải? Bạn lo lắng về chi phí vận hành và bảo trì xe? Hãy đến với XETAIMYDINH.EDU.VN để được tư vấn và giải đáp mọi thắc mắc. Chúng tôi cung cấp thông tin chi tiết về các loại xe tải, so sánh giá cả và thông số kỹ thuật, giúp bạn lựa chọn được chiếc xe phù hợp nhất với nhu cầu và ngân sách của mình. Liên hệ ngay để được hỗ trợ!