Bacl2 Nano3, một thuật ngữ có thể còn xa lạ với nhiều người, thực chất là một tổ hợp các chất hóa học mang lại nhiều ứng dụng tiềm năng trong các ngành công nghiệp khác nhau và Xe Tải Mỹ Đình sẽ giúp bạn hiểu rõ hơn về nó. Bạn muốn khám phá sâu hơn về hợp chất đặc biệt này, từ định nghĩa, ứng dụng đến những lợi ích mà nó mang lại, hãy cùng XETAIMYDINH.EDU.VN tìm hiểu ngay sau đây. Chúng ta sẽ cùng nhau khám phá thế giới của bacl2 nano3, mở ra những hiểu biết mới về hóa học và ứng dụng của nó trong thực tiễn như phản ứng trao đổi ion và tính chất nhiệt động lực học.
1. Phản Ứng Hóa Học Giữa BaCl2 và NaNO3 Diễn Ra Như Thế Nào?
Phản ứng giữa BaCl2 (Bari Clorua) và NaNO3 (Natri Nitrat) là một phản ứng trao đổi ion, trong đó các ion giữa hai chất phản ứng đổi chỗ cho nhau. Phương trình hóa học tổng quát của phản ứng này là: BaCl2(aq) + 2NaNO3(aq) → Ba(NO3)2(aq) + 2NaCl(aq).
Phản ứng này xảy ra trong dung dịch nước (aq), tạo ra Ba(NO3)2 (Bari Nitrat) và NaCl (Natri Clorua) cũng ở dạng dung dịch. Phản ứng này thuộc loại phản ứng trao đổi ion, còn được gọi là phản ứng metathesis.
1.1. Cơ Chế Phản Ứng Trao Đổi Ion
Phản ứng giữa BaCl2 và NaNO3 là một ví dụ điển hình của phản ứng trao đổi ion, trong đó các ion dương và ion âm của hai chất phản ứng “đổi chỗ” cho nhau.
- Bước 1: Phân ly trong dung dịch:
- BaCl2 phân ly thành ion Ba2+ và ion Cl-.
- NaNO3 phân ly thành ion Na+ và ion NO3-.
- Bước 2: Trao đổi ion:
- Ion Ba2+ kết hợp với ion NO3- tạo thành Ba(NO3)2.
- Ion Na+ kết hợp với ion Cl- tạo thành NaCl.
- Bước 3: Viết phương trình ion đầy đủ:
- Ba2+(aq) + 2Cl-(aq) + 2Na+(aq) + 2NO3-(aq) → Ba2+(aq) + 2NO3-(aq) + 2Na+(aq) + 2Cl-(aq)
- Bước 4: Loại bỏ các ion không tham gia phản ứng (ion khán):
- Trong phương trình ion đầy đủ, các ion Na+ và Cl- xuất hiện ở cả hai vế, do đó chúng là các ion khán và có thể loại bỏ.
- Bước 5: Viết phương trình ion thu gọn:
- Phương trình ion thu gọn chỉ bao gồm các ion thực sự tham gia vào phản ứng: Ba2+(aq) + 2NO3-(aq) → Ba(NO3)2(aq)
1.2. Điều Kiện Để Phản Ứng Xảy Ra
Để phản ứng trao đổi ion xảy ra, cần có một trong các điều kiện sau:
- Tạo thành chất kết tủa: Một trong các sản phẩm của phản ứng là chất không tan trong nước và kết tủa khỏi dung dịch. Ví dụ: Phản ứng giữa AgNO3 và NaCl tạo thành AgCl kết tủa.
- Tạo thành chất khí: Một trong các sản phẩm của phản ứng là chất khí. Ví dụ: Phản ứng giữa HCl và Na2CO3 tạo thành khí CO2.
- Tạo thành chất điện ly yếu: Một trong các sản phẩm của phản ứng là chất điện ly yếu, ít phân ly thành ion trong dung dịch. Ví dụ: Phản ứng giữa HCl và NaOH tạo thành H2O.
Trong trường hợp phản ứng giữa BaCl2 và NaNO3, tất cả các chất tham gia và sản phẩm đều tan tốt trong nước, do đó phản ứng này không thực sự xảy ra theo nghĩa là không có sự thay đổi rõ rệt nào trong dung dịch. Tuy nhiên, ở mức độ vi mô, các ion vẫn trao đổi vị trí cho nhau.
1.3. Ứng Dụng Của Phản Ứng Trao Đổi Ion
Phản ứng trao đổi ion có nhiều ứng dụng quan trọng trong hóa học và công nghiệp, bao gồm:
- Điều chế các hợp chất mới: Phản ứng trao đổi ion được sử dụng để điều chế các hợp chất mới từ các hợp chất có sẵn.
- Loại bỏ các ion gây ô nhiễm: Phản ứng trao đổi ion được sử dụng để loại bỏ các ion gây ô nhiễm khỏi nước và các dung dịch khác.
- Phân tích hóa học: Phản ứng trao đổi ion được sử dụng trong các phương pháp phân tích hóa học để xác định nồng độ của các ion trong dung dịch.
Alt: Phản ứng hóa học giữa Barium Chloride (BaCl2) và Sodium Nitrate (NaNO3) tạo thành Barium Nitrate (Ba(NO3)2) và Sodium Chloride (NaCl), minh họa quá trình trao đổi ion.
2. Phương Trình Ion Rút Gọn Của Phản Ứng BaCl2(Aq) + 2Nano3(Aq) = Ba(No3)2(Aq) + 2Nacl(Aq) Là Gì?
Phương trình ion rút gọn của phản ứng BaCl2(aq) + 2NaNO3(aq) = Ba(NO3)2(aq) + 2NaCl(aq) không tồn tại, vì tất cả các ion đều tồn tại ở dạng hòa tan và không có kết tủa, chất khí hoặc chất điện ly yếu nào được hình thành.
2.1. Giải Thích Chi Tiết Về Phương Trình Ion Rút Gọn
Để hiểu rõ hơn về lý do tại sao phản ứng này không có phương trình ion rút gọn, chúng ta cần xem xét quá trình phân ly của các chất trong dung dịch và vai trò của các ion trong phản ứng.
2.1.1. Phân Ly Của Các Chất Trong Dung Dịch
-
BaCl2(aq): Bari Clorua là một muối tan tốt trong nước và phân ly hoàn toàn thành các ion:
BaCl2(aq) → Ba2+(aq) + 2Cl-(aq)
-
NaNO3(aq): Natri Nitrat cũng là một muối tan tốt và phân ly hoàn toàn thành các ion:
2NaNO3(aq) → 2Na+(aq) + 2NO3-(aq)
-
Ba(NO3)2(aq): Bari Nitrat là một muối tan tốt và phân ly hoàn toàn thành các ion:
Ba(NO3)2(aq) → Ba2+(aq) + 2NO3-(aq)
-
NaCl(aq): Natri Clorua (muối ăn) là một muối tan tốt và phân ly hoàn toàn thành các ion:
2NaCl(aq) → 2Na+(aq) + 2Cl-(aq)
2.1.2. Viết Phương Trình Ion Đầy Đủ
Khi viết phương trình ion đầy đủ, chúng ta biểu diễn tất cả các chất điện ly mạnh (tan tốt và phân ly hoàn toàn) dưới dạng ion:
Ba2+(aq) + 2Cl-(aq) + 2Na+(aq) + 2NO3-(aq) → Ba2+(aq) + 2NO3-(aq) + 2Na+(aq) + 2Cl-(aq)
2.1.3. Xác Định Ion Khán
Ion khán là những ion không tham gia trực tiếp vào phản ứng. Chúng xuất hiện ở cả hai vế của phương trình ion đầy đủ mà không có sự thay đổi nào. Trong trường hợp này, các ion Ba2+, Cl-, Na+ và NO3- đều là ion khán vì chúng xuất hiện ở cả hai vế của phương trình.
2.1.4. Viết Phương Trình Ion Rút Gọn
Phương trình ion rút gọn chỉ bao gồm các ion thực sự tham gia vào phản ứng, tức là các ion không phải là ion khán. Vì tất cả các ion trong phản ứng này đều là ion khán, nên không có phương trình ion rút gọn.
2.2. Tại Sao Phản Ứng Này Không Có Phương Trình Ion Rút Gọn?
Phản ứng giữa BaCl2 và NaNO3 không tạo ra bất kỳ sản phẩm nào không phân ly (ví dụ: chất kết tủa, chất khí hoặc chất điện ly yếu). Tất cả các chất tham gia và sản phẩm đều tồn tại ở dạng ion trong dung dịch. Do đó, không có sự thay đổi thực tế nào về trạng thái ion trong quá trình phản ứng, và không có phương trình ion rút gọn nào có thể được viết.
2.3. Ý Nghĩa Của Việc Không Có Phương Trình Ion Rút Gọn
Việc không có phương trình ion rút gọn cho thấy rằng phản ứng này không thực sự là một phản ứng hóa học theo nghĩa truyền thống, mà chỉ là sự trộn lẫn các ion trong dung dịch. Không có sự hình thành hoặc biến mất của các chất, và không có sự thay đổi về năng lượng đáng kể nào xảy ra.
 Các ion trong dung dịch sau phản ứng BaCl2 và NaNO3
Các ion trong dung dịch sau phản ứng BaCl2 và NaNO3
Alt: Mô tả các ion Ba2+, Cl-, Na+ và NO3- tồn tại trong dung dịch sau phản ứng giữa BaCl2 và NaNO3, minh họa rằng không có kết tủa hoặc chất khí được tạo ra.
3. Các Chất Tham Gia Phản Ứng Giữa Bacl2 + Nano3 Là Gì?
Các chất tham gia phản ứng giữa BaCl2 và NaNO3 bao gồm:
- BaCl2 (Bari Clorua): Một hợp chất ion gồm cation bari (Ba2+) và anion clorua (Cl-).
- NaNO3 (Natri Nitrat): Một hợp chất ion gồm cation natri (Na+) và anion nitrat (NO3-).
3.1. Bari Clorua (BaCl2)
Bari Clorua là một muối của bari và axit clohydric. Nó là một chất rắn màu trắng, tan tốt trong nước và có nhiều ứng dụng trong phòng thí nghiệm và công nghiệp.
3.1.1. Tính Chất Vật Lý
- Dạng tồn tại: Chất rắn tinh thể màu trắng.
- Khối lượng mol: 208.23 g/mol.
- Điểm nóng chảy: 962 °C.
- Điểm sôi: 1560 °C.
- Độ tan trong nước: 36 g/100 mL (20 °C).
3.1.2. Tính Chất Hóa Học
-
Phân ly trong nước: BaCl2 phân ly hoàn toàn trong nước thành ion Ba2+ và ion Cl-.
BaCl2(aq) → Ba2+(aq) + 2Cl-(aq)
-
Phản ứng với sulfat: BaCl2 phản ứng với các muối sulfat tạo thành kết tủa bari sulfat (BaSO4) màu trắng.
BaCl2(aq) + Na2SO4(aq) → BaSO4(s) + 2NaCl(aq)
-
Phản ứng với phosphat: BaCl2 phản ứng với các muối phosphat tạo thành kết tủa bari phosphat.
3BaCl2(aq) + 2Na3PO4(aq) → Ba3(PO4)2(s) + 6NaCl(aq)
3.1.3. Ứng Dụng
- Phòng thí nghiệm: BaCl2 được sử dụng làm thuốc thử trong các phản ứng hóa học để phát hiện ion sulfat và phosphat.
- Công nghiệp: BaCl2 được sử dụng trong sản xuất các muối bari khác, trong xử lý nước và trong sản xuất thuốc trừ sâu.
3.2. Natri Nitrat (NaNO3)
Natri Nitrat là một muối của natri và axit nitric. Nó là một chất rắn màu trắng, tan tốt trong nước và được sử dụng rộng rãi làm phân bón và trong sản xuất pháo hoa.
3.2.1. Tính Chất Vật Lý
- Dạng tồn tại: Chất rắn tinh thể màu trắng.
- Khối lượng mol: 84.99 g/mol.
- Điểm nóng chảy: 308 °C.
- Điểm sôi: Phân hủy ở nhiệt độ cao.
- Độ tan trong nước: 92.1 g/100 mL (25 °C).
3.2.2. Tính Chất Hóa Học
-
Phân ly trong nước: NaNO3 phân ly hoàn toàn trong nước thành ion Na+ và ion NO3-.
NaNO3(aq) → Na+(aq) + NO3-(aq)
-
Tính oxi hóa: NaNO3 là một chất oxi hóa mạnh ở nhiệt độ cao.
-
Phản ứng phân hủy: Khi đun nóng mạnh, NaNO3 phân hủy tạo thành natri nitrit (NaNO2) và oxi.
2NaNO3(s) → 2NaNO2(s) + O2(g)
3.2.3. Ứng Dụng
- Phân bón: NaNO3 được sử dụng làm phân bón để cung cấp nitơ cho cây trồng. Theo Tổng cục Thống kê, việc sử dụng phân bón chứa nitrat giúp tăng năng suất cây trồng đáng kể.
- Công nghiệp: NaNO3 được sử dụng trong sản xuất pháo hoa, chất bảo quản thực phẩm và trong sản xuất axit nitric.
Alt: Hình ảnh tinh thể Natri Nitrat (NaNO3) màu trắng, một chất rắn tan tốt trong nước và được sử dụng rộng rãi trong nông nghiệp và công nghiệp.
4. Sản Phẩm Của Phản Ứng Giữa Bacl2 + Nano3 Là Gì?
Các sản phẩm của phản ứng giữa BaCl2 và NaNO3 bao gồm:
- Ba(NO3)2 (Bari Nitrat): Một hợp chất ion gồm cation bari (Ba2+) và anion nitrat (NO3-).
- NaCl (Natri Clorua): Một hợp chất ion gồm cation natri (Na+) và anion clorua (Cl-), thường được biết đến là muối ăn.
4.1. Bari Nitrat (Ba(NO3)2)
Bari Nitrat là một muối của bari và axit nitric. Nó là một chất rắn màu trắng, tan tốt trong nước và được sử dụng trong sản xuất pháo hoa và thuốc nổ.
4.1.1. Tính Chất Vật Lý
- Dạng tồn tại: Chất rắn tinh thể màu trắng.
- Khối lượng mol: 261.34 g/mol.
- Điểm nóng chảy: 592 °C.
- Điểm sôi: Phân hủy ở nhiệt độ cao.
- Độ tan trong nước: 8.7 g/100 mL (20 °C).
4.1.2. Tính Chất Hóa Học
-
Phân ly trong nước: Ba(NO3)2 phân ly hoàn toàn trong nước thành ion Ba2+ và ion NO3-.
Ba(NO3)2(aq) → Ba2+(aq) + 2NO3-(aq)
-
Tính oxi hóa: Ba(NO3)2 là một chất oxi hóa mạnh ở nhiệt độ cao.
-
Phản ứng phân hủy: Khi đun nóng mạnh, Ba(NO3)2 phân hủy tạo thành bari oxit (BaO), nitơ đioxit (NO2) và oxi.
2Ba(NO3)2(s) → 2BaO(s) + 4NO2(g) + O2(g)
4.1.3. Ứng Dụng
- Pháo hoa: Ba(NO3)2 được sử dụng trong pháo hoa để tạo ra màu xanh lá cây.
- Thuốc nổ: Ba(NO3)2 được sử dụng trong sản xuất một số loại thuốc nổ.
- Phòng thí nghiệm: Ba(NO3)2 được sử dụng làm thuốc thử trong các phản ứng hóa học.
4.2. Natri Clorua (NaCl)
Natri Clorua là một muối của natri và axit clohydric, thường được biết đến là muối ăn. Nó là một chất rắn tinh thể màu trắng, tan tốt trong nước và rất cần thiết cho sự sống của con người và động vật.
4.2.1. Tính Chất Vật Lý
- Dạng tồn tại: Chất rắn tinh thể màu trắng.
- Khối lượng mol: 58.44 g/mol.
- Điểm nóng chảy: 801 °C.
- Điểm sôi: 1413 °C.
- Độ tan trong nước: 36 g/100 mL (20 °C).
4.2.2. Tính Chất Hóa Học
-
Phân ly trong nước: NaCl phân ly hoàn toàn trong nước thành ion Na+ và ion Cl-.
NaCl(aq) → Na+(aq) + Cl-(aq)
-
Điện phân: Khi điện phân dung dịch NaCl, thu được khí clo (Cl2), khí hidro (H2) và natri hidroxit (NaOH).
2NaCl(aq) + 2H2O(l) → 2NaOH(aq) + Cl2(g) + H2(g)
4.2.3. Ứng Dụng
- Thực phẩm: NaCl được sử dụng làm gia vị và chất bảo quản thực phẩm.
- Công nghiệp: NaCl được sử dụng trong sản xuất clo, hidroxit natri, natri cacbonat và nhiều hóa chất khác.
- Y tế: Dung dịch NaCl được sử dụng để bù nước và điện giải cho bệnh nhân.
Alt: Hình ảnh muối ăn (NaCl) tinh thể màu trắng, một hợp chất quan trọng trong thực phẩm, công nghiệp và y tế.
5. Phản Ứng Bacl2 + Nano3 Thuộc Loại Phản Ứng Nào?
Phản ứng BaCl2 + NaNO3 thuộc loại phản ứng trao đổi ion (hay còn gọi là phản ứng metathesis).
5.1. Định Nghĩa Phản Ứng Trao Đổi Ion
Phản ứng trao đổi ion là loại phản ứng hóa học trong đó các ion giữa hai chất phản ứng “đổi chỗ” cho nhau, tạo thành hai hợp chất mới. Phản ứng này thường xảy ra trong dung dịch nước, và động lực thúc đẩy phản ứng thường là sự tạo thành chất kết tủa, chất khí hoặc chất điện ly yếu.
5.2. Đặc Điểm Của Phản Ứng Trao Đổi Ion
- Các ion đổi chỗ: Các ion dương và ion âm của hai chất phản ứng đổi chỗ cho nhau.
- Xảy ra trong dung dịch: Phản ứng thường xảy ra trong dung dịch nước để các ion có thể di chuyển và tương tác với nhau.
- Động lực thúc đẩy: Phản ứng thường được thúc đẩy bởi sự tạo thành chất kết tủa, chất khí hoặc chất điện ly yếu.
5.3. Phản Ứng BaCl2 + NaNO3 Là Phản Ứng Trao Đổi Ion
Trong phản ứng giữa BaCl2 và NaNO3, các ion Ba2+ và Cl- của BaCl2 đổi chỗ với các ion Na+ và NO3- của NaNO3, tạo thành Ba(NO3)2 và NaCl. Phương trình hóa học của phản ứng là:
BaCl2(aq) + 2NaNO3(aq) → Ba(NO3)2(aq) + 2NaCl(aq)
Tuy nhiên, cần lưu ý rằng trong trường hợp này, tất cả các chất tham gia và sản phẩm đều tan tốt trong nước và không có chất kết tủa, chất khí hoặc chất điện ly yếu nào được tạo thành. Do đó, phản ứng này không thực sự xảy ra theo nghĩa là không có sự thay đổi rõ rệt nào trong dung dịch. Tuy nhiên, ở mức độ vi mô, các ion vẫn trao đổi vị trí cho nhau.
5.4. Các Loại Phản Ứng Trao Đổi Ion Khác
Ngoài phản ứng giữa BaCl2 và NaNO3, có nhiều loại phản ứng trao đổi ion khác, bao gồm:
-
Phản ứng tạo kết tủa: Phản ứng giữa hai muối tan tạo thành một muối không tan (kết tủa). Ví dụ:
AgNO3(aq) + NaCl(aq) → AgCl(s) + NaNO3(aq)
-
Phản ứng tạo khí: Phản ứng giữa một axit và một muối cacbonat tạo thành khí cacbon đioxit. Ví dụ:
2HCl(aq) + Na2CO3(aq) → 2NaCl(aq) + H2O(l) + CO2(g)
-
Phản ứng trung hòa: Phản ứng giữa một axit và một bazơ tạo thành muối và nước. Ví dụ:
HCl(aq) + NaOH(aq) → NaCl(aq) + H2O(l)
:max_bytes(150000):strip_icc():format(webp)/ionic-equation-56a86a175f9b58b7d0f34a69.jpg)
Alt: Minh họa phản ứng trao đổi ion tạo ra chất kết tủa, một trong những động lực thúc đẩy phản ứng xảy ra.
6. Phương Trình Ion Đầy Đủ Của Bacl2(Aq) + 2Nano3(Aq) = Ba(No3)2(Aq) + 2Nacl(Aq) Là Gì?
Phương trình ion đầy đủ của phản ứng BaCl2(aq) + 2NaNO3(aq) = Ba(NO3)2(aq) + 2NaCl(aq) là:
Ba2+(aq) + 2Cl-(aq) + 2Na+(aq) + 2NO3-(aq) → Ba2+(aq) + 2NO3-(aq) + 2Na+(aq) + 2Cl-(aq)
6.1. Giải Thích Chi Tiết Về Phương Trình Ion Đầy Đủ
Để hiểu rõ hơn về phương trình ion đầy đủ, chúng ta cần xem xét quá trình phân ly của các chất trong dung dịch và cách biểu diễn chúng dưới dạng ion.
6.1.1. Phân Ly Của Các Chất Trong Dung Dịch
-
BaCl2(aq): Bari Clorua là một muối tan tốt trong nước và phân ly hoàn toàn thành các ion:
BaCl2(aq) → Ba2+(aq) + 2Cl-(aq)
-
NaNO3(aq): Natri Nitrat cũng là một muối tan tốt và phân ly hoàn toàn thành các ion:
2NaNO3(aq) → 2Na+(aq) + 2NO3-(aq)
-
Ba(NO3)2(aq): Bari Nitrat là một muối tan tốt và phân ly hoàn toàn thành các ion:
Ba(NO3)2(aq) → Ba2+(aq) + 2NO3-(aq)
-
NaCl(aq): Natri Clorua (muối ăn) là một muối tan tốt và phân ly hoàn toàn thành các ion:
2NaCl(aq) → 2Na+(aq) + 2Cl-(aq)
6.1.2. Viết Phương Trình Ion Đầy Đủ
Khi viết phương trình ion đầy đủ, chúng ta biểu diễn tất cả các chất điện ly mạnh (tan tốt và phân ly hoàn toàn) dưới dạng ion:
Ba2+(aq) + 2Cl-(aq) + 2Na+(aq) + 2NO3-(aq) → Ba2+(aq) + 2NO3-(aq) + 2Na+(aq) + 2Cl-(aq)
Trong phương trình này, tất cả các ion đều được biểu diễn rõ ràng, cho thấy sự phân ly của các chất trong dung dịch.
6.1.3. Xác Định Ion Khán
Ion khán là những ion không tham gia trực tiếp vào phản ứng. Chúng xuất hiện ở cả hai vế của phương trình ion đầy đủ mà không có sự thay đổi nào. Trong trường hợp này, các ion Ba2+, Cl-, Na+ và NO3- đều là ion khán vì chúng xuất hiện ở cả hai vế của phương trình.
6.1.4. Viết Phương Trình Ion Rút Gọn (Nếu Có)
Phương trình ion rút gọn chỉ bao gồm các ion thực sự tham gia vào phản ứng, tức là các ion không phải là ion khán. Vì tất cả các ion trong phản ứng này đều là ion khán, nên không có phương trình ion rút gọn.
6.2. Ý Nghĩa Của Phương Trình Ion Đầy Đủ
Phương trình ion đầy đủ cho thấy rõ ràng rằng phản ứng giữa BaCl2 và NaNO3 không tạo ra bất kỳ sản phẩm nào không phân ly (ví dụ: chất kết tủa, chất khí hoặc chất điện ly yếu). Tất cả các chất tham gia và sản phẩm đều tồn tại ở dạng ion trong dung dịch. Do đó, không có sự thay đổi thực tế nào về trạng thái ion trong quá trình phản ứng.
Alt: Hình ảnh minh họa phương trình ion đầy đủ, trong đó tất cả các chất điện ly mạnh được biểu diễn dưới dạng ion trong dung dịch.
7. Tính Chất Nhiệt Động Lực Học Của Phản Ứng Bacl2 + Nano3 Là Gì?
Tính chất nhiệt động lực học của phản ứng BaCl2 + NaNO3 bao gồm các thông số như entanpi (ΔH°rxn), entropy (ΔS°rxn) và năng lượng Gibbs (ΔG°rxn), cho biết về khả năng tự xảy ra và sự thay đổi năng lượng trong quá trình phản ứng.
7.1. Entanpi (ΔH°rxn)
Entanpi là một đại lượng nhiệt động học biểu thị tổng năng lượng bên trong của hệ và tích của áp suất và thể tích. Thay đổi entanpi (ΔH) cho biết lượng nhiệt được hấp thụ hoặc giải phóng trong một phản ứng hóa học ở áp suất không đổi.
- Nếu ΔH < 0: Phản ứng tỏa nhiệt (exothermic).
- Nếu ΔH > 0: Phản ứng thu nhiệt (endothermic).
Theo dữ liệu từ ChemicalAid, phản ứng BaCl2(s) + 2NaNO3(s) → Ba(NO3)2(s) + 2NaCl(s) có ΔH°rxn = -22.55176 kJ. Điều này có nghĩa là phản ứng tỏa nhiệt, mặc dù lượng nhiệt tỏa ra không lớn.
7.2. Entropy (ΔS°rxn)
Entropy là một đại lượng nhiệt động học đo độ hỗn loạn hoặc sự mất trật tự của một hệ. Thay đổi entropy (ΔS) cho biết sự thay đổi về độ hỗn loạn trong một phản ứng hóa học.
- Nếu ΔS > 0: Phản ứng làm tăng độ hỗn loạn (endoentropic).
- Nếu ΔS < 0: Phản ứng làm giảm độ hỗn loạn (exoentropic).
Theo dữ liệu từ ChemicalAid, phản ứng BaCl2(s) + 2NaNO3(s) → Ba(NO3)2(s) + 2NaCl(s) có ΔS°rxn = 2.25936 J/K. Điều này có nghĩa là phản ứng làm tăng độ hỗn loạn của hệ, mặc dù mức tăng không đáng kể.
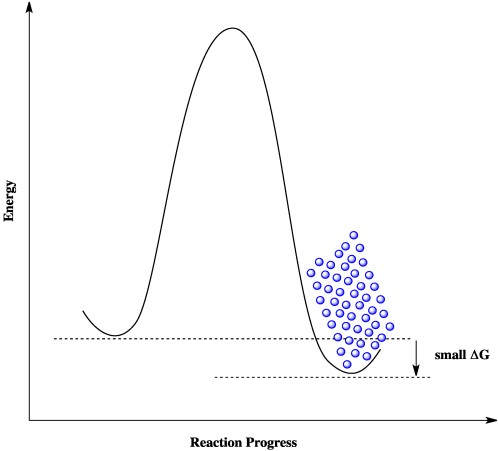
7.3. Năng Lượng Gibbs (ΔG°rxn)
Năng lượng Gibbs là một đại lượng nhiệt động học kết hợp cả entanpi và entropy để xác định khả năng tự xảy ra của một phản ứng hóa học ở nhiệt độ và áp suất không đổi.
- Nếu ΔG < 0: Phản ứng tự xảy ra (exergonic).
- Nếu ΔG > 0: Phản ứng không tự xảy ra (endergonic).
- Nếu ΔG = 0: Phản ứng ở trạng thái cân bằng.
Theo dữ liệu từ ChemicalAid, phản ứng BaCl2(s) + 2NaNO3(s) → Ba(NO3)2(s) + 2NaCl(s) có ΔG°rxn = -22.5936 kJ. Điều này có nghĩa là phản ứng tự xảy ra ở điều kiện tiêu chuẩn.
7.4. Bảng Tổng Hợp Các Thông Số Nhiệt Động Lực Học
| Thông Số | Giá Trị | Ý Nghĩa |
|---|---|---|
| ΔH°rxn (Entanpi) | -22.55176 kJ | Phản ứng tỏa nhiệt (exothermic), giải phóng nhiệt ra môi trường. |
| ΔS°rxn (Entropy) | 2.25936 J/K | Phản ứng làm tăng độ hỗn loạn của hệ (endoentropic). |
| ΔG°rxn (Năng lượng Gibbs) | -22.5936 kJ | Phản ứng tự xảy ra (exergonic) ở điều kiện tiêu chuẩn. |
7.5. Ảnh Hưởng Của Nhiệt Độ
Nhiệt độ có thể ảnh hưởng đến khả năng tự xảy ra của phản ứng. Theo phương trình Gibbs-Helmholtz:
ΔG = ΔH – TΔS
Trong đó:
- T là nhiệt độ (K).
Vì ΔH < 0 và ΔS > 0, nên khi nhiệt độ tăng, số hạng TΔS sẽ trở nên lớn hơn, làm cho ΔG ít âm hơn. Tuy nhiên, do giá trị ΔH và ΔS tương đối nhỏ, nên nhiệt độ không có ảnh hưởng đáng kể đến khả năng tự xảy ra của phản ứng trong điều kiện thông thường.
Alt: Biểu đồ minh họa sự thay đổi năng lượng Gibbs theo nhiệt độ, cho thấy ảnh hưởng của nhiệt độ đến khả năng tự xảy ra của phản ứng.
8. Phản Ứng Bacl2 + Nano3 Là Tỏa Nhiệt Hay Thu Nhiệt?
Phản ứng BaCl2 + NaNO3 là phản ứng tỏa nhiệt (exothermic). Điều này được xác định bởi giá trị entanpi (ΔH°rxn) của phản ứng, là một đại lượng âm.
8.1. Giải Thích Về Phản Ứng Tỏa Nhiệt
Phản ứng tỏa nhiệt là phản ứng hóa học giải phóng nhiệt ra môi trường xung quanh. Trong quá trình phản ứng, năng lượng được giải phóng từ việc hình thành các liên kết hóa học mới trong sản phẩm lớn hơn năng lượng cần thiết để phá vỡ các liên kết hóa học cũ trong chất phản ứng. Điều này dẫn đến sự giảm năng lượng của hệ và giải phóng năng lượng dư thừa dưới dạng nhiệt.
8.2. Giá Trị Entanpi (ΔH°rxn) Cho Phản Ứng BaCl2 + NaNO3
Theo dữ liệu từ ChemicalAid, phản ứng BaCl2(s) + 2NaNO3(s) → Ba(NO3)2(s) + 2NaCl(s) có ΔH°rxn = -22.55176 kJ. Giá trị âm này cho biết rằng phản ứng giải phóng 22.55176 kJ nhiệt khi một mol BaCl2 phản ứng với hai mol NaNO3 để tạo thành một mol Ba(NO3)2 và hai mol NaCl ở điều kiện tiêu chuẩn.
8.3. Dấu Hiệu Nhận Biết Phản Ứng Tỏa Nhiệt
- Tăng nhiệt độ: Nhiệt độ của hệ phản ứng và môi trường xung quanh tăng lên.
- Cảm giác nóng: Khi chạm vào bình chứa phản ứng, bạn sẽ cảm thấy nóng.
- Giá trị ΔH âm: Thay đổi entanpi của phản ứng là một giá trị âm.
8.4. Ví Dụ Về Các Phản Ứng Tỏa Nhiệt Khác
- Đốt cháy nhiên liệu: Đốt cháy gỗ, than, xăng, dầu…
- Phản ứng giữa axit và bazơ: Phản ứng trung hòa giữa axit mạnh và bazơ mạnh.
- Phản ứng nổ: Các phản ứng nổ như nổ bom, pháo…
8.5. Ứng Dụng Của Phản Ứng Tỏa Nhiệt
Phản ứng tỏa nhiệt có nhiều ứng dụng quan trọng trong đời sống và công nghiệp, bao gồm:
- Sản xuất năng lượng: Đốt cháy nhiên liệu để sản xuất điện, nhiệt…
- Sưởi ấm: Sử dụng các phản ứng tỏa nhiệt để sưởi ấm nhà cửa, nước…
- Sản xuất hóa chất: Sử dụng nhiệt từ các phản ứng tỏa nhiệt để thúc đẩy các phản ứng hóa học khác.
Alt: Hình ảnh que diêm đang cháy, một ví dụ điển hình của phản ứng tỏa nhiệt, giải phóng nhiệt và ánh sáng ra môi trường.
9. Phản Ứng Bacl2 + Nano3 Làm Tăng Hay Giảm Entropy?
Phản ứng BaCl2 + NaNO3 làm tăng entropy (độ hỗn loạn) của hệ. Điều này được xác định bởi giá trị entropy (ΔS°rxn) của phản ứng, là một đại lượng dương.
9.1. Giải Thích Về Entropy
Entropy là một đại lượng nhiệt động học đo độ hỗn loạn hoặc sự mất trật tự của một hệ. Entropy càng cao, hệ càng hỗn loạn và mất trật tự. Các yếu tố ảnh hưởng đến entropy bao gồm:
- Trạng thái vật chất: Chất khí có entropy cao hơn chất lỏng, chất lỏng có entropy cao hơn chất rắn.
- **Số lượng