Ba(OH)2 BaCl2 là hai hợp chất hóa học quan trọng của Barium (Ba), được ứng dụng rộng rãi trong nhiều lĩnh vực công nghiệp và nghiên cứu. Hãy cùng Xe Tải Mỹ Đình khám phá chi tiết về định nghĩa, tính chất, ứng dụng và những lưu ý quan trọng khi sử dụng hai hợp chất này. Tại XETAIMYDINH.EDU.VN, chúng tôi cung cấp thông tin chuyên sâu và đáng tin cậy về các hợp chất hóa học liên quan đến ngành vận tải và công nghiệp.
1. Ba(OH)2 BaCl2: Tổng Quan Về Tính Chất Và Ứng Dụng
Ba(OH)2 (Barium Hydroxide) và BaCl2 (Barium Chloride) là hai hợp chất Barium quan trọng với nhiều ứng dụng khác nhau.
1.1 Ba(OH)2 (Barium Hydroxide) Là Gì?
Barium Hydroxide, công thức hóa học Ba(OH)2, là một hợp chất hóa học vô cơ. Nó tồn tại ở dạng tinh thể không màu hoặc màu trắng.
- Tính chất vật lý: Ba(OH)2 có khả năng tan trong nước, tạo thành dung dịch kiềm mạnh. Độ tan của nó tăng theo nhiệt độ.
- Tính chất hóa học: Ba(OH)2 là một bazơ mạnh, có khả năng phản ứng với axit để tạo thành muối và nước. Nó cũng có thể hấp thụ CO2 từ không khí để tạo thành Barium Carbonate (BaCO3).
1.2 BaCl2 (Barium Chloride) Là Gì?
Barium Chloride, công thức hóa học BaCl2, là một muối của Barium. Nó tồn tại ở dạng tinh thể màu trắng, có thể tan trong nước.
- Tính chất vật lý: BaCl2 là chất rắn, không mùi, dễ tan trong nước và tạo thành dung dịch trung tính.
- Tính chất hóa học: BaCl2 có khả năng phản ứng với các muối Sulfate để tạo thành Barium Sulfate (BaSO4), một chất kết tủa trắng không tan trong axit.
2. So Sánh Chi Tiết Ba(OH)2 Và BaCl2
Để hiểu rõ hơn về hai hợp chất này, hãy cùng Xe Tải Mỹ Đình so sánh chi tiết các khía cạnh quan trọng của Ba(OH)2 và BaCl2.
| Đặc Điểm | Ba(OH)2 (Barium Hydroxide) | BaCl2 (Barium Chloride) |
|---|---|---|
| Công thức hóa học | Ba(OH)2 | BaCl2 |
| Ngoại hình | Tinh thể không màu hoặc trắng | Tinh thể màu trắng |
| Độ tan trong nước | Tan tốt trong nước, độ tan tăng theo nhiệt độ | Tan tốt trong nước |
| Tính chất hóa học | Bazơ mạnh, phản ứng với axit, hấp thụ CO2 | Phản ứng với muối Sulfate tạo kết tủa BaSO4 |
| Ứng dụng | Sản xuất Barium, chất làm mềm nước, phòng thí nghiệm hóa học | Sản xuất thuốc trừ sâu, chất xử lý nhiệt, phòng thí nghiệm hóa học |
| Mức độ nguy hiểm | Gây kích ứng da, mắt và đường hô hấp, có thể gây ngộ độc | Độc hại nếu nuốt phải, gây kích ứng da và mắt |
3. Ứng Dụng Thực Tế Của Ba(OH)2 BaCl2 Trong Đời Sống Và Công Nghiệp
Cả Ba(OH)2 và BaCl2 đều có những ứng dụng riêng biệt và quan trọng.
3.1 Ứng Dụng Của Ba(OH)2 (Barium Hydroxide)
- Sản xuất Barium: Ba(OH)2 là một chất trung gian quan trọng trong quá trình sản xuất Barium kim loại.
- Chất làm mềm nước: Ba(OH)2 được sử dụng để loại bỏ các ion Sulfate khỏi nước, làm mềm nước cứng.
- Phòng thí nghiệm hóa học: Ba(OH)2 được sử dụng trong các thí nghiệm hóa học để chuẩn độ axit và bazơ.
3.2 Ứng Dụng Của BaCl2 (Barium Chloride)
- Sản xuất thuốc trừ sâu: BaCl2 được sử dụng trong sản xuất một số loại thuốc trừ sâu.
- Chất xử lý nhiệt: BaCl2 được sử dụng trong quá trình xử lý nhiệt kim loại.
- Phòng thí nghiệm hóa học: BaCl2 được sử dụng để kiểm tra sự hiện diện của ion Sulfate trong dung dịch.
4. Quy Trình Sản Xuất Ba(OH)2 Và BaCl2
Quy trình sản xuất Ba(OH)2 và BaCl2 đòi hỏi sự cẩn trọng và tuân thủ các quy tắc an toàn.
4.1 Sản Xuất Ba(OH)2
Ba(OH)2 thường được sản xuất bằng cách hòa tan Barium Oxide (BaO) trong nước. Phản ứng hóa học diễn ra như sau:
BaO + H2O → Ba(OH)24.2 Sản Xuất BaCl2
BaCl2 có thể được sản xuất bằng cách phản ứng Barium Carbonate (BaCO3) với axit Hydrochloric (HCl):
BaCO3 + 2HCl → BaCl2 + H2O + CO25. Những Lưu Ý Quan Trọng Khi Sử Dụng Ba(OH)2 BaCl2
Ba(OH)2 và BaCl2 đều là những hợp chất có thể gây nguy hiểm nếu không được sử dụng đúng cách.
- Độc tính: Cả hai hợp chất đều độc hại nếu nuốt phải. Cần tránh tiếp xúc trực tiếp với da và mắt.
- An toàn lao động: Khi làm việc với Ba(OH)2 và BaCl2, cần đeo găng tay, kính bảo hộ và áo bảo hộ để tránh tiếp xúc trực tiếp.
- Bảo quản: Cần bảo quản Ba(OH)2 và BaCl2 ở nơi khô ráo, thoáng mát và tránh xa tầm tay trẻ em.
6. Ảnh Hưởng Của Ba(OH)2 BaCl2 Đến Môi Trường
Việc sử dụng và thải bỏ Ba(OH)2 và BaCl2 cần được thực hiện cẩn thận để tránh gây ô nhiễm môi trường.
- Ô nhiễm nguồn nước: Ba(OH)2 và BaCl2 có thể gây ô nhiễm nguồn nước nếu thải trực tiếp ra môi trường.
- Tác động đến hệ sinh thái: Sự tích tụ của Barium trong đất có thể ảnh hưởng đến sự phát triển của thực vật và động vật.
7. Nghiên Cứu Mới Nhất Về Ba(OH)2 BaCl2
Các nhà khoa học liên tục nghiên cứu về các ứng dụng mới của Ba(OH)2 và BaCl2.
- Ứng dụng trong pin: Nghiên cứu gần đây cho thấy Ba(OH)2 có thể được sử dụng trong pin Lithium-ion để cải thiện hiệu suất và tuổi thọ của pin.
- Vật liệu xây dựng: BaCl2 đang được nghiên cứu để sử dụng trong sản xuất vật liệu xây dựng mới, có khả năng chống thấm và chịu lực tốt hơn.
8. Câu Hỏi Thường Gặp Về Ba(OH)2 BaCl2 (FAQ)
8.1 Ba(OH)2 Có Ăn Mòn Không?
Có, Ba(OH)2 là một bazơ mạnh và có tính ăn mòn. Nó có thể gây kích ứng và tổn thương da, mắt và đường hô hấp nếu tiếp xúc trực tiếp.
8.2 BaCl2 Có Độc Không?
Có, BaCl2 là một chất độc hại nếu nuốt phải. Nó có thể gây ra các triệu chứng như buồn nôn, nôn mửa, đau bụng và thậm chí tử vong nếu không được điều trị kịp thời.
8.3 Làm Thế Nào Để Xử Lý Ba(OH)2 Và BaCl2 An Toàn?
Khi làm việc với Ba(OH)2 và BaCl2, cần tuân thủ các biện pháp an toàn sau:
- Đeo găng tay, kính bảo hộ và áo bảo hộ.
- Làm việc trong khu vực thông gió tốt.
- Tránh hít phải bụi hoặc hơi của hóa chất.
- Rửa tay kỹ sau khi sử dụng.
- Bảo quản hóa chất ở nơi khô ráo, thoáng mát và tránh xa tầm tay trẻ em.
8.4 Ba(OH)2 Và BaCl2 Khác Nhau Như Thế Nào?
Ba(OH)2 là một bazơ mạnh, trong khi BaCl2 là một muối. Chúng có các ứng dụng và tính chất hóa học khác nhau. Ba(OH)2 thường được sử dụng để làm mềm nước và sản xuất Barium, trong khi BaCl2 được sử dụng trong sản xuất thuốc trừ sâu và xử lý nhiệt kim loại.
8.5 BaCl2 Có Thể Thay Thế Ba(OH)2 Trong Ứng Dụng Làm Mềm Nước Không?
Không, BaCl2 không thể thay thế Ba(OH)2 trong ứng dụng làm mềm nước. Ba(OH)2 có khả năng kết tủa các ion Sulfate, giúp loại bỏ chúng khỏi nước, trong khi BaCl2 không có tính chất này.
8.6 Ứng Dụng Nào Của Ba(OH)2 Là Quan Trọng Nhất Trong Công Nghiệp?
Một trong những ứng dụng quan trọng nhất của Ba(OH)2 trong công nghiệp là sản xuất Barium kim loại. Barium kim loại được sử dụng trong nhiều ứng dụng khác nhau, bao gồm sản xuất hợp kim và vật liệu chịu lửa.
8.7 BaCl2 Có Ứng Dụng Nào Trong Y Học Không?
Trong quá khứ, BaCl2 đã được sử dụng trong y học như một chất kích thích tim. Tuy nhiên, do độc tính cao, nó không còn được sử dụng phổ biến trong y học hiện đại.
8.8 Làm Thế Nào Để Nhận Biết Sự Hiện Diện Của BaCl2 Trong Dung Dịch?
Sự hiện diện của BaCl2 trong dung dịch có thể được nhận biết bằng cách thêm một lượng nhỏ dung dịch chứa ion Sulfate (ví dụ: Sodium Sulfate). Nếu có BaCl2, một kết tủa trắng của Barium Sulfate (BaSO4) sẽ hình thành.
8.9 Ba(OH)2 Có Tác Dụng Gì Trong Sản Xuất Đường?
Trong sản xuất đường từ củ cải đường, Ba(OH)2 đôi khi được sử dụng để loại bỏ các tạp chất và làm sạch dung dịch đường. Quá trình này giúp cải thiện chất lượng và độ tinh khiết của đường thành phẩm.
8.10 Ba(OH)2 Và BaCl2 Có Gây Ô Nhiễm Không Khí Không?
Ba(OH)2 và BaCl2 không gây ô nhiễm không khí trực tiếp. Tuy nhiên, trong quá trình sản xuất và sử dụng, nếu không được kiểm soát chặt chẽ, chúng có thể phát tán các hạt bụi vào không khí, gây ảnh hưởng đến sức khỏe con người và môi trường.
9. Tìm Hiểu Thêm Về Xe Tải Mỹ Đình Và Các Hợp Chất Liên Quan
Tại Xe Tải Mỹ Đình, chúng tôi không chỉ cung cấp thông tin về xe tải mà còn chia sẻ kiến thức về các hợp chất hóa học liên quan đến ngành công nghiệp và vận tải. Nếu bạn có bất kỳ thắc mắc nào về Ba(OH)2, BaCl2 hoặc các hợp chất khác, đừng ngần ngại liên hệ với chúng tôi.
10. Liên Hệ Với Xe Tải Mỹ Đình Để Được Tư Vấn Chi Tiết
Bạn đang tìm kiếm thông tin chi tiết và đáng tin cậy về xe tải và các hợp chất liên quan? Hãy truy cập XETAIMYDINH.EDU.VN ngay hôm nay để khám phá thêm nhiều kiến thức hữu ích! Đừng quên liên hệ với chúng tôi qua hotline 0247 309 9988 hoặc đến trực tiếp địa chỉ Số 18 đường Mỹ Đình, phường Mỹ Đình 2, quận Nam Từ Liêm, Hà Nội để được tư vấn và giải đáp mọi thắc mắc. Xe Tải Mỹ Đình luôn sẵn sàng đồng hành cùng bạn!
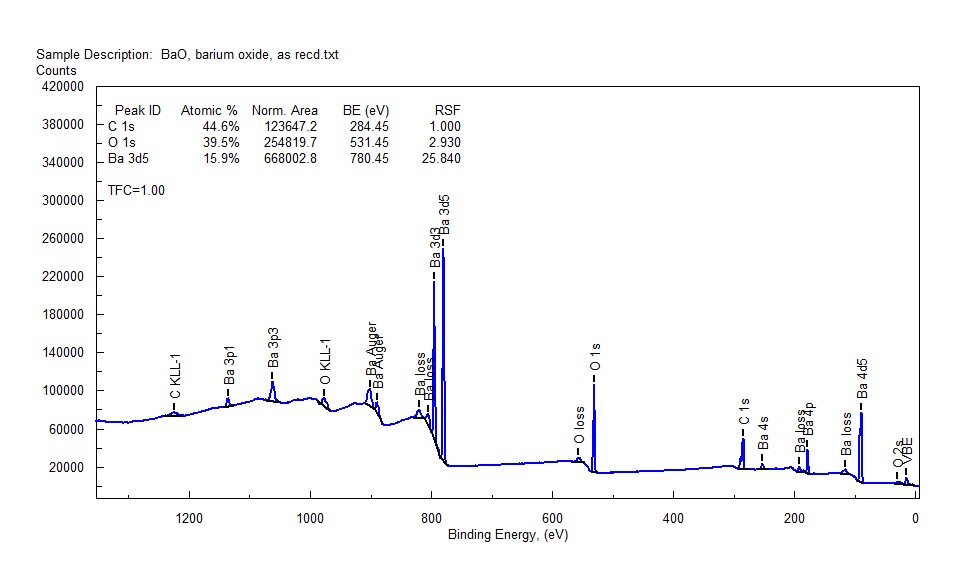 Survey Spectrum from BaO, exposed to Lab Air, which quickly forms BaCO3 surface before XPS analysis starts
Survey Spectrum from BaO, exposed to Lab Air, which quickly forms BaCO3 surface before XPS analysis starts
Hình ảnh: Phổ khảo sát từ BaO, tiếp xúc với không khí trong phòng thí nghiệm, nhanh chóng tạo thành bề mặt BaCO3, minh họa quá trình biến đổi hóa học của Barium Oxide.
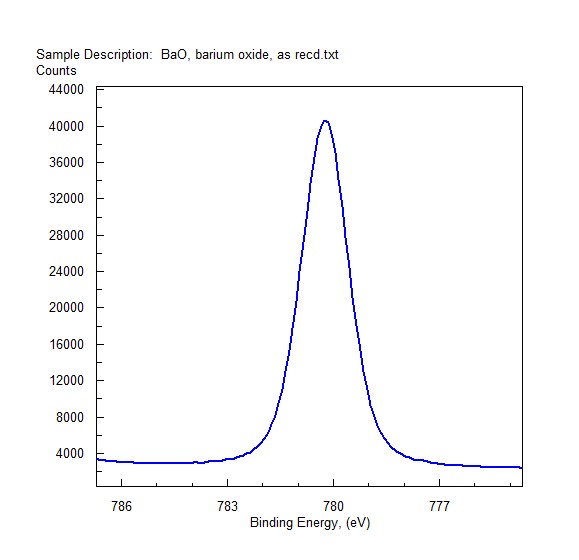 Ba (3d) Spectrum from BaO exposed to Lab Air – Raw
Ba (3d) Spectrum from BaO exposed to Lab Air – Raw
Hình ảnh: Phổ Ba (3d) từ BaO tiếp xúc với không khí trong phòng thí nghiệm, cho thấy sự thay đổi ở trạng thái thô, phản ánh tính chất hóa học của Barium Oxide.
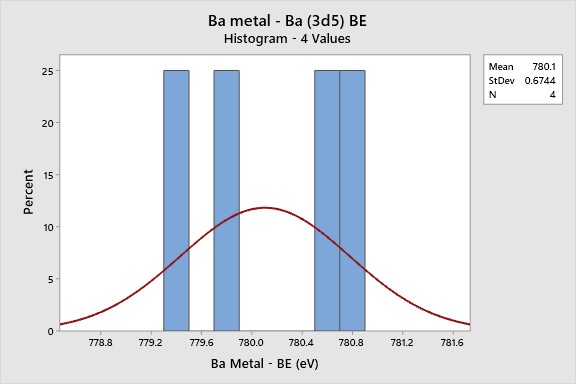 Histogram indicates: 780.1 eV for Bao based on 4 literature BEs
Histogram indicates: 780.1 eV for Bao based on 4 literature BEs
Hình ảnh: Biểu đồ tần suất NIST BEs cho thấy 780.1 eV cho Bao dựa trên 4 tài liệu tham khảo, thể hiện sự phân bố năng lượng liên kết của Barium Oxide.