Anken Công Thức Chung là gì và nó có ý nghĩa như thế nào trong hóa học hữu cơ? Xe Tải Mỹ Đình sẽ cung cấp cho bạn cái nhìn toàn diện về anken, từ định nghĩa cơ bản, công thức tổng quát, đến tính chất hóa học đặc trưng và ứng dụng thực tế. Hãy cùng khám phá để hiểu rõ hơn về loại hợp chất này nhé!
1. Anken Là Gì?
Anken là hydrocarbon không no, mạch hở, chứa ít nhất một liên kết đôi C=C trong phân tử. Nói một cách dễ hiểu, anken là những “người anh em” của ankan, nhưng thay vì chỉ có liên kết đơn, chúng có thêm một liên kết đôi “mạnh mẽ” hơn, tạo nên những tính chất hóa học thú vị.
1.1. Định Nghĩa Chi Tiết Về Anken
Anken, còn được gọi là olefin, là một loại hydrocarbon không no. Điều này có nghĩa là các phân tử anken chứa ít nguyên tử hydro hơn so với ankan tương ứng có cùng số lượng nguyên tử carbon. “Không no” ở đây đề cập đến khả năng cộng thêm các nguyên tử khác (như hydro, halogen) vào liên kết đôi.
1.2. Công Thức Chung Của Anken
Công thức chung của anken là CnH2n (với n ≥ 2). Trong đó, n là số nguyên tử carbon trong phân tử. Công thức này cho thấy rằng số lượng nguyên tử hydro trong anken luôn gấp đôi số lượng nguyên tử carbon.
Ví dụ:
- Eten (etylen): C2H4
- Propen: C3H6
- Buten: C4H8
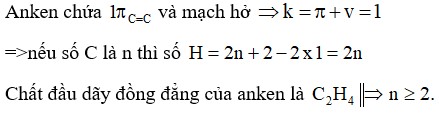 Công thức cấu tạo của Eten (C2H4)
Công thức cấu tạo của Eten (C2H4)
Alt text: Công thức cấu tạo của Eten (C2H4), một anken đơn giản nhất.
2. Đặc Điểm Cấu Tạo Của Anken
Cấu tạo của anken là yếu tố then chốt quyết định tính chất hóa học của chúng. Liên kết đôi C=C bao gồm một liên kết sigma (σ) bền vững và một liên kết pi (π) kém bền hơn.
2.1. Liên Kết Đôi C=C
Liên kết đôi C=C là trung tâm hoạt động của phân tử anken. Liên kết này bao gồm:
- Liên kết sigma (σ): Được hình thành do sự xen phủ trục của hai orbital, tạo nên liên kết bền vững.
- Liên kết pi (π): Được hình thành do sự xen phủ bên của hai orbital p, tạo nên liên kết kém bền và dễ bị phá vỡ trong các phản ứng hóa học.
2.2. Cấu Trúc Hình Học
Do có liên kết đôi, các nguyên tử carbon trong liên kết C=C và các nguyên tử liên kết trực tiếp với chúng nằm trên cùng một mặt phẳng. Góc liên kết xung quanh mỗi nguyên tử carbon này xấp xỉ 120°. Điều này tạo ra cấu trúc phẳng cho phần phân tử chứa liên kết đôi.
3. Tính Chất Vật Lý Của Anken
Tính chất vật lý của anken thay đổi theo số lượng nguyên tử carbon trong phân tử.
3.1. Trạng Thái
- Ở điều kiện thường, các anken từ C2H4 đến C4H8 là chất khí.
- Các anken từ C5H10 trở lên là chất lỏng hoặc chất rắn.
3.2. Nhiệt Độ Sôi, Nhiệt Độ Nóng Chảy
Nhiệt độ sôi và nhiệt độ nóng chảy của anken tăng khi số lượng nguyên tử carbon trong phân tử tăng lên. Điều này là do lực Van der Waals giữa các phân tử tăng lên khi kích thước phân tử tăng.
3.3. Độ Tan
Anken là các hydrocarbon, do đó chúng không tan trong nước (một dung môi phân cực) nhưng tan tốt trong các dung môi hữu cơ (không phân cực) như benzene, ether.
4. Tính Chất Hóa Học Của Anken
Anken nổi tiếng với khả năng tham gia vào các phản ứng cộng, phản ứng oxy hóa và phản ứng trùng hợp.
4.1. Phản Ứng Cộng
Phản ứng cộng là phản ứng đặc trưng của anken, trong đó các nguyên tử hoặc nhóm nguyên tử cộng vào liên kết đôi C=C, phá vỡ liên kết pi (π) kém bền.
4.1.1. Cộng Hydro (Hydro hóa)
Anken cộng với hydro (H2) tạo thành ankan, với sự xúc tác của kim loại như niken (Ni), platin (Pt) hoặc palađi (Pd).
Ví dụ:
CH2=CH2 + H2 → CH3-CH3 (xúc tác Ni, nhiệt độ)
4.1.2. Cộng Halogen (Halogen hóa)
Anken cộng với halogen (như clo Cl2, brom Br2) tạo thành dẫn xuất đihalogen. Phản ứng này thường được sử dụng để nhận biết anken do làm mất màu dung dịch brom.
Ví dụ:
CH2=CH2 + Br2 → CH2Br-CH2Br
4.1.3. Cộng Hydro Halogenua (Hydrohalogen hóa)
Anken cộng với hydro halogenua (như HCl, HBr) tạo thành dẫn xuất halogen. Phản ứng này tuân theo quy tắc Markovnikov: Nguyên tử hydro ưu tiên cộng vào nguyên tử carbon có nhiều hydro hơn, còn nguyên tử halogen cộng vào nguyên tử carbon có ít hydro hơn.
Ví dụ:
CH3-CH=CH2 + HBr → CH3-CHBr-CH3 (sản phẩm chính)
4.1.4. Cộng Nước (Hydrat hóa)
Anken cộng với nước (H2O) tạo thành alcohol, với sự xúc tác của axit (thường là H2SO4). Phản ứng này cũng tuân theo quy tắc Markovnikov.
Ví dụ:
CH2=CH2 + H2O → CH3-CH2-OH (xúc tác H2SO4)
4.2. Phản Ứng Oxy Hóa
Anken có thể bị oxy hóa hoàn toàn (cháy) hoặc oxy hóa không hoàn toàn.
4.2.1. Oxy Hóa Hoàn Toàn (Đốt Cháy)
Khi đốt cháy hoàn toàn, anken tạo ra khí carbon dioxide (CO2) và nước (H2O), đồng thời giải phóng nhiệt.
Phương trình tổng quát:
CnH2n + (3n/2)O2 → nCO2 + nH2O
4.2.2. Oxy Hóa Không Hoàn Toàn
- Oxy hóa bằng dung dịch KMnO4: Anken làm mất màu dung dịch thuốc tím (KMnO4), tạo thành glycol (diol). Phản ứng này được sử dụng để nhận biết anken.
- Oxy hóa bằng ozon (O3): Phản ứng với ozon tạo thành ozonit, sau đó bị phân hủy tạo thành các aldehyde hoặc ketone.
4.3. Phản Ứng Trùng Hợp
Nhiều phân tử anken có thể kết hợp với nhau tạo thành một phân tử lớn hơn gọi là polymer. Quá trình này được gọi là trùng hợp.
Ví dụ:
nCH2=CH2 → (-CH2-CH2-)n (polyetylen)
5. Ứng Dụng Quan Trọng Của Anken
Anken có nhiều ứng dụng quan trọng trong công nghiệp và đời sống.
5.1. Sản Xuất Polyme
Anken là nguyên liệu chính để sản xuất các loại polyme quan trọng như polyetylen (PE), polypropylen (PP), polyvinyl clorua (PVC) và polystyren (PS). Các polyme này được sử dụng rộng rãi trong sản xuất đồ gia dụng, vật liệu xây dựng, bao bì và nhiều ứng dụng khác.
5.2. Sản Xuất Hóa Chất
Anken là nguyên liệu để tổng hợp nhiều hóa chất quan trọng khác như ethanol, etylen glycol (chất chống đông), axeton và các loại hóa chất khác sử dụng trong công nghiệp và nông nghiệp.
5.3. Điều Chế Các Hợp Chất Hữu Cơ Khác
Anken được sử dụng để điều chế các hợp chất hữu cơ khác thông qua các phản ứng cộng, oxy hóa và các phản ứng khác.
5.4. Trong Công Nghiệp Thực Phẩm
Etylen được sử dụng để thúc đẩy quá trình chín của trái cây.
6. Điều Chế Anken
Có nhiều phương pháp điều chế anken trong phòng thí nghiệm và công nghiệp.
6.1. Cracking Ankan
Cracking là quá trình bẻ gãy các phân tử ankan mạch dài thành các phân tử nhỏ hơn, bao gồm anken và ankan. Quá trình này thường được thực hiện ở nhiệt độ cao và có xúc tác.
6.2. Dehydro hóa Ankan
Dehydro hóa là quá trình loại bỏ hydro từ ankan để tạo thành anken. Quá trình này cũng cần nhiệt độ cao và xúc tác.
6.3. Dehydrohalogen hóa Dẫn Xuất Halogen
Dehydrohalogen hóa là quá trình loại bỏ hydro halogenua (HX) từ dẫn xuất halogen bằng cách sử dụng base mạnh.
Ví dụ:
CH3-CH2Cl + KOH → CH2=CH2 + KCl + H2O
6.4. Tách Nước Từ Alcohol
Tách nước từ alcohol bằng cách đun nóng alcohol với axit sulfuric đặc (H2SO4) hoặc axit phosphoric (H3PO4).
Ví dụ:
CH3-CH2-OH → CH2=CH2 + H2O (xúc tác H2SO4, nhiệt độ)
7. Phân Loại Anken
Anken có thể được phân loại dựa trên vị trí của liên kết đôi và cấu trúc mạch carbon.
7.1. Theo Vị Trí Liên Kết Đôi
- Anken α (alpha): Liên kết đôi nằm ở vị trí carbon đầu mạch.
- Anken β (beta): Liên kết đôi nằm ở vị trí carbon thứ hai từ đầu mạch trở đi.
7.2. Theo Cấu Trúc Mạch Carbon
- Anken mạch thẳng: Mạch carbon không phân nhánh.
- Anken mạch nhánh: Mạch carbon có phân nhánh.
- Anken vòng: Mạch carbon tạo thành vòng (cycloanken).
8. Danh Pháp IUPAC Của Anken
Để gọi tên anken theo danh pháp IUPAC, ta thực hiện các bước sau:
- Chọn mạch carbon dài nhất chứa liên kết đôi làm mạch chính.
- Đánh số mạch chính sao cho vị trí liên kết đôi có số nhỏ nhất.
- Gọi tên theo cấu trúc: Số chỉ vị trí nhánh-tên nhánh + tiền tố chỉ số lượng carbon-en + số chỉ vị trí liên kết đôi.
Ví dụ:
- CH2=CH2: Eten
- CH3-CH=CH2: Propen
- CH3-CH=CH-CH3: But-2-en
- CH3-CH(CH3)-CH=CH2: 3-metylbut-1-en
9. So Sánh Ankan Và Anken
| Đặc điểm | Ankan (CnH2n+2) | Anken (CnH2n) |
|---|---|---|
| Liên kết | Chỉ có liên kết đơn C-C, C-H | Có ít nhất một liên kết đôi C=C |
| Độ no | No | Không no |
| Tính chất hóa học | Ít hoạt động hóa học | Hoạt động hóa học hơn |
| Phản ứng đặc trưng | Phản ứng thế, phản ứng cháy | Phản ứng cộng, phản ứng trùng hợp |
| Ứng dụng | Nhiên liệu, dung môi | Sản xuất polyme, hóa chất |
10. Các Câu Hỏi Thường Gặp Về Anken (FAQ)
10.1. Anken Có Phải Là Hợp Chất No Không?
Không, anken là hợp chất không no vì chứa liên kết đôi C=C, có khả năng cộng thêm các nguyên tử khác.
10.2. Anken Có Mấy Loại Liên Kết?
Anken có hai loại liên kết: liên kết sigma (σ) và liên kết pi (π) trong liên kết đôi C=C.
10.3. Anken Có Tan Trong Nước Không?
Anken không tan trong nước vì chúng là các hydrocarbon không phân cực.
10.4. Phản Ứng Nào Là Đặc Trưng Của Anken?
Phản ứng cộng là phản ứng đặc trưng của anken, trong đó các nguyên tử hoặc nhóm nguyên tử cộng vào liên kết đôi C=C.
10.5. Anken Được Điều Chế Bằng Cách Nào?
Anken có thể được điều chế bằng nhiều phương pháp như cracking ankan, dehydro hóa ankan, dehydrohalogen hóa dẫn xuất halogen và tách nước từ alcohol.
10.6. Anken Có Ứng Dụng Gì Trong Công Nghiệp?
Anken có nhiều ứng dụng trong công nghiệp, chủ yếu là sản xuất polyme, hóa chất và điều chế các hợp chất hữu cơ khác.
10.7. Tại Sao Anken Lại Quan Trọng Trong Hóa Học Hữu Cơ?
Anken quan trọng vì chúng là các hợp chất trung gian quan trọng trong nhiều quá trình tổng hợp hữu cơ và có nhiều ứng dụng trong công nghiệp và đời sống.
10.8. Làm Thế Nào Để Nhận Biết Anken?
Anken có thể được nhận biết bằng cách làm mất màu dung dịch brom hoặc dung dịch thuốc tím (KMnO4).
10.9. Anken Có Gây Ô Nhiễm Môi Trường Không?
Một số anken có thể gây ô nhiễm môi trường nếu không được xử lý đúng cách. Ví dụ, việc đốt cháy anken không hoàn toàn có thể tạo ra các chất độc hại.
10.10. Anken Có Độc Hại Không?
Một số anken có thể độc hại, tùy thuộc vào cấu trúc và tính chất hóa học của chúng. Cần tuân thủ các biện pháp an toàn khi làm việc với anken.
11. Kết Luận
Anken là một họ hydrocarbon không no quan trọng với công thức chung CnH2n, chứa liên kết đôi C=C đặc trưng. Chúng có nhiều tính chất hóa học thú vị và ứng dụng rộng rãi trong công nghiệp, từ sản xuất polyme đến điều chế các hóa chất quan trọng. Hy vọng bài viết này của Xe Tải Mỹ Đình đã giúp bạn hiểu rõ hơn về anken và vai trò của chúng trong hóa học hữu cơ.
Nếu bạn đang tìm kiếm thông tin chi tiết và đáng tin cậy về xe tải ở Mỹ Đình, hãy truy cập ngay XETAIMYDINH.EDU.VN để được tư vấn và giải đáp mọi thắc mắc. Chúng tôi cam kết cung cấp những thông tin chính xác và cập nhật nhất, giúp bạn lựa chọn được chiếc xe tải phù hợp nhất với nhu cầu của mình. Đừng ngần ngại liên hệ với chúng tôi qua hotline 0247 309 9988 hoặc đến trực tiếp địa chỉ Số 18 đường Mỹ Đình, phường Mỹ Đình 2, quận Nam Từ Liêm, Hà Nội để được hỗ trợ tốt nhất!
