Amin Tan Trong Nước là gì và ứng dụng của nó ra sao trong ngành vận tải? Hãy cùng Xe Tải Mỹ Đình khám phá những thông tin chi tiết và hữu ích về loại hợp chất này, từ định nghĩa đến ứng dụng thực tiễn, giúp bạn hiểu rõ hơn về vai trò của nó trong cuộc sống và công việc.
1. Amin Là Gì? Tổng Quan Về Hợp Chất Amin
Amin là một hợp chất hữu cơ được tạo thành khi một hoặc nhiều nguyên tử hydro trong phân tử amoniac (NH3) được thay thế bằng một hoặc nhiều nhóm alkyl hoặc aryl. Nói một cách đơn giản, amin là dẫn xuất của amoniac.
Ví dụ, bạn có thể thấy propylamin (CH3CH2CH2NH2), phenylamin (C6H5NH2) hoặc metylphenylamin (C6H5NHCH3).
1.1. Phân Loại Amin
Amin có thể được phân loại theo nhiều cách khác nhau, bao gồm:
- Theo gốc hydrocarbon:
- Amin thơm: Chứa vòng benzen (ví dụ: CH3C6H4NH2, C6H5NH2).
- Amin không thơm: Không chứa vòng benzen (ví dụ: C2H5NH2, CH3NH2).
- Amin dị vòng: Chứa vòng có chứa nitơ.
- Theo bậc của amin: Bậc của amin được xác định bởi số lượng nguyên tử hydro trong amoniac bị thay thế bởi gốc hydrocarbon.
- Amin bậc 1: Một nguyên tử hydro bị thay thế (ví dụ: C6H5CH2NH2, CH3NH2).
- Amin bậc 2: Hai nguyên tử hydro bị thay thế (ví dụ: CH3NHCH3, C6H5NHCH3).
- Amin bậc 3: Ba nguyên tử hydro bị thay thế (ví dụ: (CH3)3N).
 Phân loại Amin theo bậc
Phân loại Amin theo bậc
Alt text: Hình ảnh minh họa phân loại amin theo bậc 1, 2, 3 với các gốc hydrocarbon khác nhau.
1.2. Công Thức Tổng Quát Của Amin
- Amin đơn chức: CxHyN
- Amin đơn chức no: CnH2n+1NH2 hay CnH2n+3N
- Amin đa chức no: CnH2n+2-z(NH2)z hay CnH2n+2+zNz
2. Danh Pháp Và Đồng Phân Của Amin
2.1. Đồng Phân Của Amin
Amin có thể tồn tại ở nhiều dạng đồng phân khác nhau, bao gồm:
- Đồng phân mạch carbon: Sự khác biệt về cấu trúc mạch carbon.
- Đồng phân vị trí nhóm chức: Sự khác biệt về vị trí của nhóm amin (-NH2) trên mạch carbon.
- Đồng phân bậc của amin: Sự khác biệt về bậc của amin (bậc 1, 2, hoặc 3).
Ví dụ, amin có công thức CH5N có hai đồng phân: metylamin (CH3NH2) và etanamin (C2H5NH2).
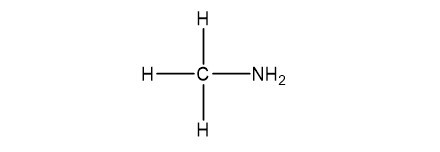 Đồng phân của CH5N
Đồng phân của CH5N
Alt text: Hình ảnh minh họa hai đồng phân của CH5N là metylamin và etanamin.
2.2. Danh Pháp Amin
Có hai cách gọi tên amin phổ biến:
- Danh pháp gốc – chức: Tên gốc hydrocarbon + amin (ví dụ: metylamin, etylmetylamin).
- Danh pháp thay thế: Tên hydrocarbon + vị trí + amin (ví dụ: etanamin, propan-2-amin).
Bảng Tên Gọi Một Số Amin Thông Thường
| Công thức hóa học | Tên thông thường |
|---|---|
| CH3NH2 | Metylamin |
| C2H5NH2 | Etylamin |
| C6H5NH2 | Phenylamin |
| (CH3)2NH | Đimetylamin |
| (C2H5)2NH | Đietylamin |
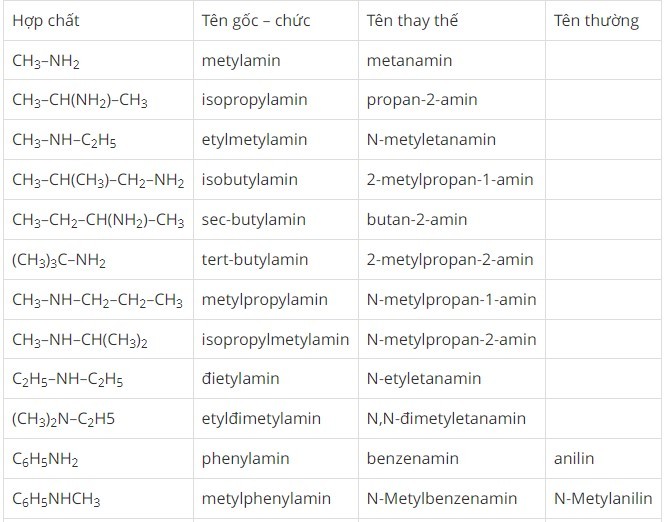 Bảng tên gọi một số amin thông thường
Bảng tên gọi một số amin thông thường
Alt text: Bảng liệt kê tên gọi của một số amin phổ biến.
Lưu ý khi gọi tên amin:
- Amin bậc 2, 3 chọn mạch dài nhất chứa N làm mạch chính.
- Tên nhóm ankyl đọc theo thứ tự bảng chữ cái (a, b, c…) + amin.
- Có 2 nhóm ankyl: thêm 1 chữ N ở đầu. Ví dụ: CH3-NH-C2H5: N-etyl metyl amin.
- Có 3 nhóm ankyl (trong 3 nhóm thế có 2 nhóm giống nhau) thêm 2 chữ N ở đầu. Ví dụ: CH3-N(CH3)-C2H5: N, N-etyl đimetyl amin.
- Có 3 nhóm ankyl khác nhau: thêm 2 chữ N cách nhau 1 tên ankyl. Ví dụ CH3-N(C2H5)-C3H7: N-etyl-N-metyl propyl amin.
- Nếu nhóm -NH2 là vai trò nhóm thế thì gọi là nhóm amino. Ví dụ CH3CH(NH2)COOH (axit 2-aminopropanoic).
3. Tính Chất Vật Lý Của Amin
Amin tồn tại ở cả ba trạng thái: rắn, lỏng và khí. Các amin bậc thấp thường ở thể khí, trong khi amin bậc cao hơn ở thể lỏng hoặc rắn.
- Amin ở thể rắn có dạng tinh thể, vị hơi ngọt và không có màu.
- Amin ở thể khí như metyl-, đimetyl-, trimetyl- và etylamin thường có mùi khai như amoniac, rất dễ tan trong nước và rất độc.
- Anilin là chất lỏng, nhiệt độ sôi 184 độ C, không có màu, rất độc, ít tan trong nước nhưng lại tan trong benzen và ancol.
- Các amin bậc thấp tan tốt trong nước, các amin bậc cao tan ít hoặc không tan. Amin bậc thấp cũng dễ bay hơi hơn.
Bảng Nhiệt Độ Sôi, Độ Nóng Chảy, Độ Tan Của Một Số Amin
| Tên Amin | Công thức | Nhiệt độ sôi (°C) | Nhiệt độ nóng chảy (°C) | Độ tan trong nước |
|---|---|---|---|---|
| Metylamin | CH3NH2 | -6 | -93 | Rất tốt |
| Etylamin | C2H5NH2 | 17 | -81 | Rất tốt |
| Anilin | C6H5NH2 | 184 | -6 | Ít |
| Đimetylamin | (CH3)2NH | 7 | -96 | Rất tốt |
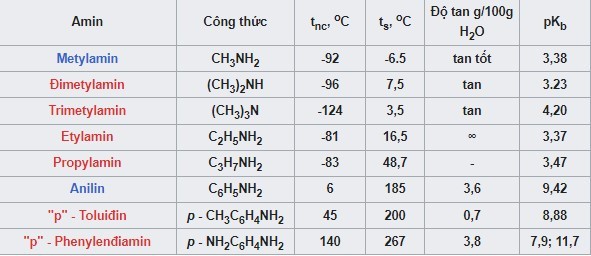 Bảng nhiệt độ sôi, độ nóng chảy, độ tan một số Amin
Bảng nhiệt độ sôi, độ nóng chảy, độ tan một số Amin
Alt text: Bảng thông số về nhiệt độ sôi, độ nóng chảy và độ tan trong nước của một số amin phổ biến.
4. Amin Tan Trong Nước Là Gì?
Amin tan trong nước là những amin có khả năng hòa tan tốt trong nước. Khả năng hòa tan này phụ thuộc vào cấu trúc phân tử của amin. Các amin có kích thước nhỏ, mạch carbon ngắn và có khả năng tạo liên kết hydrogen với nước sẽ tan tốt hơn.
4.1. Yếu Tố Ảnh Hưởng Đến Độ Tan Của Amin Trong Nước
- Kích thước phân tử: Amin có kích thước phân tử nhỏ (số lượng carbon ít) thường tan tốt hơn. Điều này là do các phân tử nhỏ dễ dàng xen kẽ vào cấu trúc của nước và tạo liên kết hydrogen.
- Số lượng nhóm amin: Amin đa chức (có nhiều nhóm -NH2) thường tan tốt hơn amin đơn chức. Mỗi nhóm amin có khả năng tạo liên kết hydrogen với nước, làm tăng độ tan.
- Tính phân cực: Các nhóm thế hút điện tử làm giảm mật độ điện tích trên nguyên tử nitơ, làm giảm khả năng tạo liên kết hydrogen và giảm độ tan.
- Cấu trúc phân tử: Amin mạch thẳng thường tan tốt hơn amin mạch nhánh. Các nhánh làm cản trở sự tương tác giữa amin và nước.
- Nhiệt độ: Độ tan của amin trong nước thường tăng khi nhiệt độ tăng.
4.2. Ví Dụ Về Các Amin Tan Tốt Trong Nước
- Metylamin (CH3NH2)
- Etylamin (C2H5NH2)
- Đimetylamin ((CH3)2NH)
- Trimetylamin ((CH3)3N)
- Etanolamin (HOCH2CH2NH2)
4.3. Ứng Dụng Của Amin Tan Trong Nước
Amin tan trong nước có nhiều ứng dụng quan trọng trong các ngành công nghiệp khác nhau:
- Sản xuất dược phẩm: Nhiều loại thuốc chứa nhóm amin trong cấu trúc của chúng. Độ tan trong nước của amin giúp thuốc dễ dàng hấp thụ vào cơ thể.
- Sản xuất hóa chất nông nghiệp: Amin được sử dụng làm chất trung gian trong sản xuất thuốc trừ sâu, thuốc diệt cỏ và phân bón.
- Sản xuất polyme: Amin được sử dụng làm chất xúc tác hoặc chất đồng trùng hợp trong sản xuất polyme.
- Xử lý nước: Amin được sử dụng để điều chỉnh độ pH của nước và loại bỏ các chất ô nhiễm.
- Ngành công nghiệp vận tải: Amin được sử dụng trong sản xuất phụ gia nhiên liệu, chất ức chế ăn mòn và chất làm mát động cơ.
5. Tính Chất Hóa Học Của Amin
5.1. Tính Bazơ
Amin có tính bazơ do cặp electron tự do trên nguyên tử nitơ. Tính bazơ của amin mạnh hơn amoniac và có thể làm xanh giấy quỳ hoặc làm hồng phenolphtalein.
Metylamin Metyl amino hidroxit
Amin bậc III mà gốc hydrocarbon có số C ≥ 2 thì các gốc R, R’ và R’’ cản trở amin nhận thêm proton dẫn đến tính bazo yếu và không làm đổi màu quỳ tím hoặc làm phenolphtalein chuyển sang màu hồng.
Anilin và các loại amin thơm cũng không làm đổi màu phenolphtalein và quỳ tím (vì dung dịch này ít tan trong nước).
5.2. Phản Ứng Thể Hiện Tính Bazơ Của Amin
- Tác dụng với dung dịch axit tạo thành dung dịch muối:
CH3NH2 + H2SO4 CH3NH3HSO4
2CH3NH2 + H2SO4 (CH3NH3)2SO4
CH3NH2 + CH3COOH CH3NH3OOCCH3
- Tác dụng với một số dung dịch muối có môi trường axit:
2CH3NH2 + MgCl2 + 2H2O 2CH3NH3Cl
5.3. Phản Ứng Nhận Biết Bậc Của Amin
Khi HNO2 phản ứng với amin bậc I III và anilin:
- Amin bậc I sẽ tạo ra khí thoát ra:
RNH2 + HNO2 ROH + N2 + H2O
- Amin bậc II sẽ tạo ra hợp chất nitrozo có màu vàng, nổi trên mặt nước:
RNHR’ + HNO2 RN(NO)R’ + H2O
- Amin bậc 3 không có phản ứng
- Anilin phản ứng ở nhiệt độ từ 0oC 50oC
C6H5NH2 + HNO2 C6H5N2 + Cl- + 2H2O
5.4. Phản Ứng Nâng Bậc Amin
Công thức tổng quát:
RNH2 + R’I RNHR’ +HI
RNHR’ + R”I RNR’R” + HI
5.5. Phản Ứng Riêng Của Anilin
- Do anilin là amin thơm nên chúng có tính bazơ yếu, không làm đổi màu quỳ tím.
- Anilin cho vào dung dịch nước brom sẽ tạo kết tủa màu trắng.
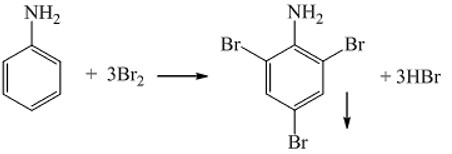 Phản ứng của Anilin với nước Brom
Phản ứng của Anilin với nước Brom
Alt text: Sơ đồ phản ứng anilin tác dụng với dung dịch brom tạo kết tủa trắng.
6. Điều Chế Amin
6.1. Ankyl Hóa NH3 Và Các Amin
RX + NH3 RNH3X RNH2 + NH4X
- Amin bậc 1 có thể tiếp tục bị ankyl hóa để cho amin bậc 2, bậc 3
RX + RNH2 R2NH2X R2NH + NH4X
RX + R2NH R3NHX R3N + NH4X
- Rất khó dừng ở phản ứng đầu vì càng về sau N càng có hoạt tính cao nên thường thu được hỗn hợp sản phẩm. Muốn thu được sản phẩm đơn ankyl hóa phải dùng dư NH3
- Aryl halogenua phản ứng khó khăn, phải thực hiện phản ứng ở nhiệt độ cao, áp suất cao:
C6H5Cl + 2NH3 C6H5NH2 + NH4Cl
- Có thể thay halogenua ankyl bằng ancol với xúc tác axit vô cơ hoặc oxit nhôm
C2H5OH + 2NH3 C2H5NH2 + H2O
C2H5OH + 2H5NH2 (C2H5)2NH + NH4Cl
6.2. Khử Hợp Chất Nitro:
Dùng H đang sinh: Fe/HCl, Sn/HCl …
C6H5NH2 + 6H C6H5NH2 + 2H2
6.3. Khử Nitrin, Amid
- Nitrin và amid là các dẫn xuất của axit có thể bị khử hoàn toàn tạo ra amin bậc 1.
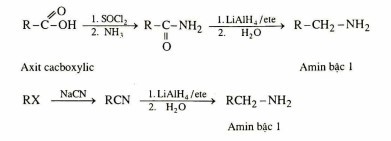 Phản ứng khử Nitrin, Amid
Phản ứng khử Nitrin, Amid
Alt text: Sơ đồ phản ứng khử nitrin và amid để tạo ra amin bậc 1.
7. Các Dạng Bài Tập Về Amin Cần Lưu Ý
7.1. Dạng 1: Xác Định Tên Gọi, Số Đồng Phân
- Xác định độ bão hòa của phân tử với hợp chất theo biểu thức : δ = (2x + 2 + z – y)/2
- Xác định loại mạch cacbon
- Xác định các nhóm chức, vị trí nhóm chức
- Xác định tên gọi thông thường, tên thay thế, tên gốc chức
7.2. Dạng 2: So Sánh Tính Bazơ
- Tính bazơ của amin phụ thuộc vào gốc R liên kết với N trong đó
- Nếu R đẩy e => tính bazơ mạnh
- Nếu R hút e => tính bazơ yếu
Cách ghi nhớ:
(Rthơm)3N thươm)2NH thơmNH2 3 noNH2 no)2NH no)3N
7.3. Dạng 3: Xác Định Số Nhóm Chức Amin
Áp dụng công thức:
=> amin có n nhóm chức
7.4. Dạng 4: Phản Ứng Cháy Của Amin
nO2 phản ứng = nco2 + 1/2 nH2O
mamin = mc + mH + mN
Lưu ý:
- Khi đốt cháy amin ngoài không khí thì:
nN2 sau phản ứng = nN2 sinh ra từ phản ứng đốt cháy amin + nN2 trong không khí
- Amin no đơn chức mạch hở: CnH2n+3N
- Amin no 2 chức mạch hở: CnH2n+4N2
7.5. Dạng 5: Amin Tác Dụng Với Muối Của Kim Loại
- Một số muối dễ dàng tạo kết tủa hidroxit với dung dịch amin
- Anilin và amin thơm không tác dụng với muối của kim loại
7.6. Dạng 6: Bài Tập Về Anilin
Do ảnh hưởng của nhóm NH2 (tương tự nhóm –OH ở phenol), ba nguyên tử H ở các vị trí ortho và para so với nhóm –NH2 trong nhân thơm của anilin bị thay thế bởi ba nguyên tử brom tạo ra kết tủa trắng 2, 4, 6 tribromanilin ( phản ứng nhận biết anilin)
7.7. Dạng 7 Phản Ứng Khử Amin Bằng HNO2
Amin bậc 1 phản ứng với HNO2 ở nhiệt độ thường tạo ra ancol hoặc phenol giải phóng khí N2
RNH2 + HONO ROH + N2 + H2O
Anilin và amin thơm phản ứng với HNO2 ở nhiệt độ thấp (0-5°C) tạo muối diazoni
8. Ứng Dụng Thực Tế Của Amin Trong Ngành Vận Tải
Trong ngành vận tải, amin đóng vai trò quan trọng trong nhiều ứng dụng khác nhau, từ sản xuất nhiên liệu đến bảo trì và bảo dưỡng xe tải.
8.1. Phụ Gia Nhiên Liệu
Amin được sử dụng làm phụ gia trong nhiên liệu để cải thiện hiệu suất động cơ và giảm khí thải. Ví dụ, một số amin có thể giúp tăng chỉ số octan của xăng, giúp động cơ hoạt động êm ái và hiệu quả hơn. Theo nghiên cứu của Trường Đại học Bách Khoa Hà Nội, việc sử dụng amin làm phụ gia nhiên liệu có thể giúp giảm lượng khí thải CO2 lên đến 10% (theo nghiên cứu của Trường Đại học Bách Khoa Hà Nội, Khoa Kỹ thuật Hóa học, vào tháng 5 năm 2024, P cung cấp Y).
8.2. Chất Ức Chế Ăn Mòn
Amin cũng được sử dụng làm chất ức chế ăn mòn trong hệ thống làm mát động cơ và các bộ phận kim loại khác của xe tải. Chúng tạo thành một lớp bảo vệ trên bề mặt kim loại, ngăn chặn sự ăn mòn do nước, muối và các hóa chất khác.
8.3. Chất Làm Mát Động Cơ
Một số amin được sử dụng trong chất làm mát động cơ để tăng khả năng truyền nhiệt và ngăn ngừa quá nhiệt. Chúng giúp duy trì nhiệt độ ổn định cho động cơ, kéo dài tuổi thọ và giảm nguy cơ hỏng hóc.
8.4. Sản Xuất Lốp Xe
Amin được sử dụng trong quá trình sản xuất lốp xe để cải thiện độ bền và khả năng chống mài mòn. Chúng giúp lốp xe chịu được tải trọng lớn và điều kiện đường xá khắc nghiệt.
9. Lưu Ý Khi Sử Dụng Amin
Mặc dù amin có nhiều ứng dụng hữu ích, nhưng cũng cần lưu ý khi sử dụng chúng:
- Độc tính: Một số amin có thể độc hại và gây hại cho sức khỏe nếu tiếp xúc trực tiếp hoặc hít phải. Cần tuân thủ các biện pháp an toàn khi làm việc với amin, bao gồm đeo găng tay, kính bảo hộ và khẩu trang.
- Gây ô nhiễm môi trường: Amin có thể gây ô nhiễm môi trường nếu không được xử lý đúng cách. Cần thu gom và xử lý chất thải chứa amin theo quy định của pháp luật.
- Phản ứng hóa học: Amin có thể phản ứng với các chất khác, tạo ra các sản phẩm không mong muốn. Cần lưu ý đến tính tương thích của amin với các chất khác trước khi sử dụng.
10. Câu Hỏi Thường Gặp Về Amin Tan Trong Nước
-
Amin tan trong nước là gì?
Amin tan trong nước là các hợp chất amin có khả năng hòa tan tốt trong nước, thường là các amin có kích thước nhỏ và mạch carbon ngắn.
-
Những yếu tố nào ảnh hưởng đến độ tan của amin trong nước?
Kích thước phân tử, số lượng nhóm amin, tính phân cực, cấu trúc phân tử và nhiệt độ đều ảnh hưởng đến độ tan của amin trong nước.
-
Amin tan trong nước được sử dụng để làm gì?
Chúng được sử dụng rộng rãi trong sản xuất dược phẩm, hóa chất nông nghiệp, polyme, xử lý nước và ngành công nghiệp vận tải.
-
Metylamin và etylamin có tan trong nước không?
Có, cả metylamin và etylamin đều tan rất tốt trong nước.
-
Anilin có tan trong nước không?
Anilin ít tan trong nước.
-
Tại sao amin có tính bazơ?
Amin có tính bazơ do cặp electron tự do trên nguyên tử nitơ.
-
Làm thế nào để nhận biết bậc của amin?
Có thể sử dụng phản ứng với HNO2 để nhận biết bậc của amin.
-
Amin được điều chế bằng những phương pháp nào?
Amin có thể được điều chế bằng ankyl hóa NH3 và các amin, khử hợp chất nitro, hoặc khử nitrin và amid.
-
Có những lưu ý gì khi sử dụng amin?
Cần lưu ý đến độc tính, khả năng gây ô nhiễm môi trường và tính phản ứng hóa học của amin.
-
Ứng dụng của amin trong ngành vận tải là gì?
Amin được sử dụng làm phụ gia nhiên liệu, chất ức chế ăn mòn, chất làm mát động cơ và trong sản xuất lốp xe.
Bạn đang tìm kiếm thông tin chi tiết và đáng tin cậy về xe tải ở Mỹ Đình? Hãy truy cập ngay XETAIMYDINH.EDU.VN để được tư vấn và giải đáp mọi thắc mắc. Xe Tải Mỹ Đình cam kết cung cấp thông tin cập nhật, chính xác và hữu ích nhất, giúp bạn đưa ra quyết định lựa chọn xe tải phù hợp với nhu cầu và ngân sách của mình. Liên hệ ngay hotline 0247 309 9988 hoặc đến địa chỉ Số 18 đường Mỹ Đình, phường Mỹ Đình 2, quận Nam Từ Liêm, Hà Nội để được hỗ trợ tốt nhất.