Quy Tắc Octet là nguyên lý quan trọng trong hóa học, giúp dự đoán khả năng hình thành liên kết hóa học giữa các nguyên tử. Tại XETAIMYDINH.EDU.VN, chúng tôi sẽ cung cấp thông tin chi tiết về quy tắc này, từ định nghĩa, cách áp dụng đến những trường hợp ngoại lệ và vai trò của nó trong việc hiểu các phản ứng hóa học. Hãy cùng khám phá sâu hơn về quy tắc Octet và những ứng dụng thực tế của nó trong đời sống và công nghiệp, đồng thời tìm hiểu các yếu tố ảnh hưởng đến tính bền vững của các hợp chất, cũng như cách mà quy tắc này giúp chúng ta dự đoán và giải thích các hiện tượng hóa học một cách dễ dàng và chính xác.
1. Quy Tắc Octet Là Gì? Định Nghĩa Chi Tiết Nhất
Quy tắc Octet, còn được gọi là quy tắc bát tử, là một nguyên tắc hóa học cơ bản, theo đó các nguyên tử có xu hướng liên kết với nhau để đạt được cấu hình electron bền vững với 8 electron ở lớp vỏ ngoài cùng, tương tự như khí hiếm.
1.1 Giải Thích Cặn Kẽ Về Quy Tắc Octet
Quy tắc Octet xuất phát từ việc các khí hiếm (Neon, Argon, Krypton, Xenon) rất trơ về mặt hóa học. Điều này là do chúng có 8 electron ở lớp vỏ ngoài cùng (trừ Heli chỉ có 2), tạo nên cấu hình electron bền vững. Các nguyên tử khác có xu hướng đạt được cấu hình này bằng cách nhường, nhận hoặc góp chung electron. Theo nghiên cứu của Trường Đại học Khoa học Tự nhiên Hà Nội, Khoa Hóa học, vào tháng 5 năm 2024, các nguyên tố tuân theo quy tắc Octet có xu hướng tạo thành các hợp chất ổn định hơn.
1.2. Lịch Sử Hình Thành Và Phát Triển Của Quy Tắc Octet
Gilbert N. Lewis là người đầu tiên đưa ra khái niệm về quy tắc Octet vào năm 1916. Ông nhận thấy rằng các nguyên tử có xu hướng đạt được cấu hình electron giống như các khí hiếm để trở nên bền vững hơn. Sau đó, Irving Langmuir phát triển thêm lý thuyết này và đưa ra thuật ngữ “octet” để chỉ 8 electron ở lớp vỏ ngoài cùng.
1.3. Tại Sao Quy Tắc Octet Lại Quan Trọng?
Quy tắc Octet đóng vai trò quan trọng trong việc dự đoán và giải thích sự hình thành các liên kết hóa học. Nó giúp chúng ta hiểu tại sao một số nguyên tử lại liên kết với nhau và tạo ra các hợp chất ổn định, trong khi các nguyên tử khác lại không.
2. Các Loại Liên Kết Hóa Học Tuân Theo Quy Tắc Octet
Quy tắc Octet chi phối nhiều loại liên kết hóa học khác nhau, bao gồm liên kết ion, liên kết cộng hóa trị và liên kết kim loại.
2.1. Liên Kết Ion: Sự Chuyển Giao Electron
Liên kết ion được hình thành khi một hoặc nhiều electron được chuyển từ một nguyên tử sang nguyên tử khác, tạo ra các ion mang điện tích trái dấu hút nhau. Ví dụ, trong phân tử NaCl, nguyên tử Natri (Na) nhường 1 electron cho nguyên tử Clo (Cl), tạo thành ion Na+ và ion Cl-. Cả hai ion này đều đạt được cấu hình electron bền vững với 8 electron ở lớp vỏ ngoài cùng.
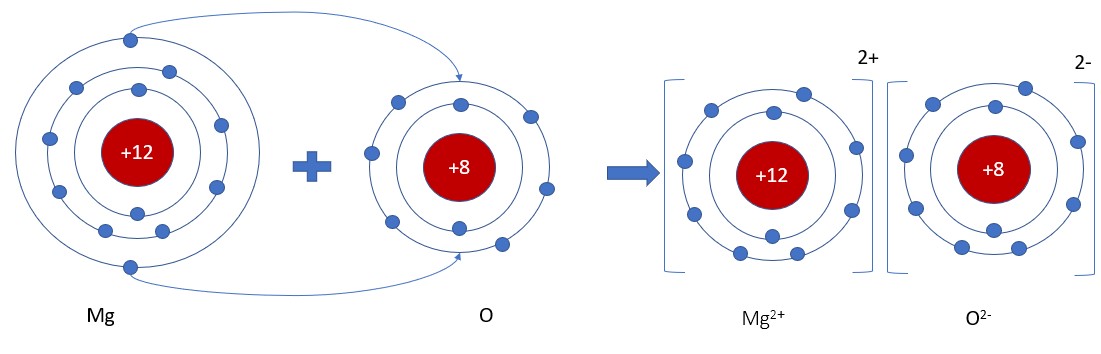 Ion natri và clo liên kết tạo thành muối ăn theo quy tắc octet
Ion natri và clo liên kết tạo thành muối ăn theo quy tắc octet
2.2. Liên Kết Cộng Hóa Trị: Sự Góp Chung Electron
Liên kết cộng hóa trị được hình thành khi hai hoặc nhiều nguyên tử góp chung electron để đạt được cấu hình electron bền vững. Ví dụ, trong phân tử nước (H2O), mỗi nguyên tử Hydro (H) góp chung 1 electron với nguyên tử Oxy (O). Nguyên tử Oxy có 6 electron ở lớp vỏ ngoài cùng, cần thêm 2 electron để đạt được cấu hình Octet. Mỗi nguyên tử Hydro có 1 electron, góp chung với Oxy, tạo thành 2 cặp electron dùng chung, giúp Oxy đạt Octet và mỗi Hydro có 2 electron (cấu hình bền vững của Heli).
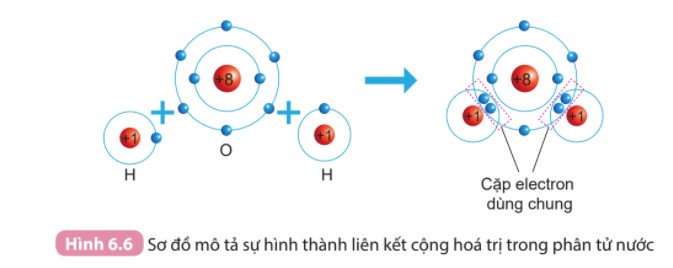 Liên kết cộng hóa trị trong phân tử nước tuân theo quy tắc octet
Liên kết cộng hóa trị trong phân tử nước tuân theo quy tắc octet
2.3. Liên Kết Kim Loại: Sự Chia Sẻ Electron Trong Mạng Lưới Kim Loại
Liên kết kim loại là loại liên kết đặc biệt, trong đó các electron hóa trị của các nguyên tử kim loại được tự do di chuyển trong toàn bộ mạng lưới tinh thể kim loại, tạo thành “biển electron”. Các ion kim loại dương được giữ với nhau bởi lực hút tĩnh điện với biển electron này. Mặc dù không tuân thủ quy tắc Octet một cách trực tiếp, liên kết kim loại vẫn đảm bảo tính bền vững của cấu trúc kim loại.
3. Các Bước Áp Dụng Quy Tắc Octet Để Viết Công Thức Lewis
Công thức Lewis là một cách biểu diễn trực quan sự phân bố electron trong phân tử, giúp chúng ta hiểu rõ hơn về liên kết hóa học và cấu trúc phân tử.
3.1. Xác Định Tổng Số Electron Hóa Trị Của Tất Cả Các Nguyên Tử
Bước đầu tiên là xác định số electron hóa trị của mỗi nguyên tử trong phân tử. Electron hóa trị là các electron ở lớp vỏ ngoài cùng của nguyên tử, tham gia vào quá trình hình thành liên kết hóa học. Ví dụ, trong phân tử CO2, Carbon (C) có 4 electron hóa trị và Oxy (O) có 6 electron hóa trị. Vì vậy, tổng số electron hóa trị trong CO2 là 4 + (2 x 6) = 16.
3.2. Vẽ Cấu Trúc Khung Của Phân Tử
Vẽ cấu trúc khung của phân tử, với nguyên tử có độ âm điện thấp hơn thường nằm ở trung tâm. Trong CO2, Carbon có độ âm điện thấp hơn nên nằm ở trung tâm, và hai nguyên tử Oxy liên kết với Carbon.
3.3. Nối Các Nguyên Tử Bằng Liên Kết Đơn (Một Cặp Electron)
Nối các nguyên tử bằng liên kết đơn, mỗi liên kết đơn biểu thị một cặp electron dùng chung. Trong CO2, nối Carbon với mỗi Oxy bằng một liên kết đơn.
3.4. Điền Đầy Các Electron Vào Các Nguyên Tử Xung Quanh Để Đạt Octet
Điền đầy các electron vào các nguyên tử xung quanh (thường là các nguyên tử có độ âm điện cao hơn) để đạt được cấu hình Octet. Trong CO2, mỗi nguyên tử Oxy cần thêm 6 electron để đạt Octet.
3.5. Nếu Nguyên Tử Trung Tâm Chưa Đạt Octet, Chuyển Các Electron Từ Nguyên Tử Xung Quanh Tạo Liên Kết Bội
Nếu nguyên tử trung tâm chưa đạt Octet, chuyển các electron từ các nguyên tử xung quanh để tạo thành liên kết bội (liên kết đôi hoặc liên kết ba). Trong CO2, sau khi điền electron cho Oxy, Carbon vẫn còn thiếu 2 electron để đạt Octet. Vì vậy, chuyển một cặp electron từ mỗi Oxy để tạo thành hai liên kết đôi giữa Carbon và Oxy.
3.6. Kiểm Tra Lại Cấu Trúc Lewis Đã Vẽ
Kiểm tra lại cấu trúc Lewis đã vẽ để đảm bảo rằng tất cả các nguyên tử (trừ Hydro) đều đạt Octet và tổng số electron trong cấu trúc bằng với tổng số electron hóa trị đã tính ở bước đầu tiên.
4. Các Trường Hợp Ngoại Lệ Của Quy Tắc Octet
Mặc dù quy tắc Octet rất hữu ích, nhưng nó không phải là quy tắc tuyệt đối và có một số trường hợp ngoại lệ.
4.1. Phân Tử Thiếu Electron
Một số phân tử, đặc biệt là các hợp chất của Beryllium (Be) và Boron (B), có số electron hóa trị ít hơn 8 ở nguyên tử trung tâm. Ví dụ, trong phân tử Boron trifluoride (BF3), Boron chỉ có 6 electron xung quanh nó (3 từ 3 liên kết với Fluorine).
4.2. Phân Tử Có Số Lẻ Electron
Các phân tử có số lẻ electron, được gọi là gốc tự do, không thể tuân theo quy tắc Octet. Ví dụ, Nitrogen monoxide (NO) có 11 electron hóa trị, vì vậy không có cách nào để tất cả các nguyên tử đều đạt Octet.
4.3. Phân Tử Với Nguyên Tử Trung Tâm Mở Rộng Octet
Các nguyên tử từ chu kỳ 3 trở xuống (ví dụ: Phosphorus, Sulfur, Chlorine) có thể mở rộng lớp vỏ hóa trị của chúng để chứa hơn 8 electron. Ví dụ, trong Phosphorus pentachloride (PCl5), Phosphorus có 10 electron xung quanh nó (5 từ 5 liên kết với Chlorine). Trong Sulfur hexafluoride (SF6), Sulfur có 12 electron xung quanh nó (6 từ 6 liên kết với Fluorine).
 Cấu trúc phân tử PCl5 vi phạm quy tắc octet
Cấu trúc phân tử PCl5 vi phạm quy tắc octet
4.4. Giải Thích Về Sự Mở Rộng Octet
Sự mở rộng Octet được giải thích bằng sự tham gia của các orbital d vào quá trình hình thành liên kết. Các nguyên tử từ chu kỳ 3 trở xuống có orbital d trống, cho phép chúng tạo thành nhiều liên kết hơn và chứa nhiều electron hơn so với quy tắc Octet.
5. Ứng Dụng Thực Tế Của Quy Tắc Octet Trong Đời Sống Và Công Nghiệp
Quy tắc Octet không chỉ là một lý thuyết hóa học mà còn có nhiều ứng dụng thực tế trong đời sống và công nghiệp.
5.1. Dự Đoán Tính Chất Hóa Học Của Các Chất
Quy tắc Octet giúp chúng ta dự đoán tính chất hóa học của các chất, chẳng hạn như khả năng phản ứng, độ bền và tính phân cực.
5.2. Thiết Kế Thuốc Và Vật Liệu Mới
Trong ngành dược phẩm, quy tắc Octet được sử dụng để thiết kế các phân tử thuốc có khả năng tương tác với các protein và enzyme trong cơ thể. Trong ngành vật liệu, nó giúp tạo ra các vật liệu mới với tính chất mong muốn, chẳng hạn như độ bền cao, khả năng dẫn điện tốt hoặc khả năng chịu nhiệt.
5.3. Giải Thích Các Hiện Tượng Hóa Học Trong Tự Nhiên
Quy tắc Octet giúp chúng ta hiểu rõ hơn về các hiện tượng hóa học xảy ra trong tự nhiên, chẳng hạn như quá trình quang hợp, hô hấp và sự hình thành các khoáng chất.
6. Các Yếu Tố Ảnh Hưởng Đến Sự Tuân Thủ Quy Tắc Octet
Không phải tất cả các nguyên tử và phân tử đều tuân thủ quy tắc Octet một cách tuyệt đối. Có một số yếu tố ảnh hưởng đến sự tuân thủ này.
6.1. Độ Âm Điện
Độ âm điện là khả năng của một nguyên tử hút electron về phía nó trong một liên kết hóa học. Các nguyên tử có độ âm điện cao có xu hướng hút electron mạnh hơn, làm cho liên kết trở nên phân cực hơn và ảnh hưởng đến sự phân bố electron xung quanh nguyên tử.
6.2. Kích Thước Nguyên Tử
Kích thước nguyên tử cũng ảnh hưởng đến sự tuân thủ quy tắc Octet. Các nguyên tử lớn hơn có lớp vỏ electron ngoài cùng xa hạt nhân hơn, làm cho các electron dễ bị phân cực và ảnh hưởng đến khả năng đạt được cấu hình Octet.
6.3. Điện Tích Hình Thức
Điện tích hình thức là điện tích mà một nguyên tử sẽ có nếu tất cả các electron trong liên kết được chia đều cho các nguyên tử liên kết. Các cấu trúc Lewis với điện tích hình thức nhỏ hơn hoặc bằng không thường ổn định hơn.
7. So Sánh Quy Tắc Octet Với Các Quy Tắc Liên Kết Hóa Học Khác
Quy tắc Octet không phải là quy tắc duy nhất để dự đoán sự hình thành liên kết hóa học. Có một số quy tắc khác, chẳng hạn như quy tắc Duet và quy tắc mở rộng Octet.
7.1. Quy Tắc Duet
Quy tắc Duet áp dụng cho các nguyên tử nhỏ như Hydro và Heli. Theo quy tắc này, các nguyên tử có xu hướng đạt được cấu hình electron bền vững với 2 electron ở lớp vỏ ngoài cùng, tương tự như Heli.
7.2. Quy Tắc Mở Rộng Octet
Quy tắc mở rộng Octet áp dụng cho các nguyên tử từ chu kỳ 3 trở xuống, như đã đề cập ở trên. Các nguyên tử này có thể mở rộng lớp vỏ hóa trị của chúng để chứa hơn 8 electron.
7.3. Ưu Nhược Điểm Của Các Quy Tắc
Mỗi quy tắc có ưu và nhược điểm riêng. Quy tắc Octet đơn giản và dễ áp dụng, nhưng không áp dụng được cho tất cả các trường hợp. Quy tắc Duet áp dụng cho các nguyên tử nhỏ, nhưng không áp dụng cho các nguyên tử lớn hơn. Quy tắc mở rộng Octet áp dụng cho các nguyên tử từ chu kỳ 3 trở xuống, nhưng phức tạp hơn và khó áp dụng hơn.
8. Ví Dụ Minh Họa Về Quy Tắc Octet Trong Các Phân Tử Phổ Biến
Để hiểu rõ hơn về quy tắc Octet, chúng ta hãy xem xét một số ví dụ minh họa trong các phân tử phổ biến.
8.1. Methane (CH4)
Trong phân tử Methane, Carbon (C) liên kết với bốn nguyên tử Hydro (H). Carbon có 4 electron hóa trị và mỗi Hydro có 1 electron hóa trị. Mỗi Hydro góp chung 1 electron với Carbon, tạo thành 4 liên kết đơn. Carbon đạt được cấu hình Octet với 8 electron xung quanh nó, và mỗi Hydro đạt được cấu hình Duet với 2 electron.
8.2. Ammonia (NH3)
Trong phân tử Ammonia, Nitrogen (N) liên kết với ba nguyên tử Hydro (H). Nitrogen có 5 electron hóa trị và mỗi Hydro có 1 electron hóa trị. Mỗi Hydro góp chung 1 electron với Nitrogen, tạo thành 3 liên kết đơn. Nitrogen còn lại một cặp electron không liên kết. Nitrogen đạt được cấu hình Octet với 8 electron xung quanh nó, và mỗi Hydro đạt được cấu hình Duet với 2 electron.
8.3. Carbon Dioxide (CO2)
Trong phân tử Carbon Dioxide, Carbon (C) liên kết với hai nguyên tử Oxy (O). Carbon có 4 electron hóa trị và mỗi Oxy có 6 electron hóa trị. Carbon liên kết với mỗi Oxy bằng một liên kết đôi. Carbon đạt được cấu hình Octet với 8 electron xung quanh nó, và mỗi Oxy cũng đạt được cấu hình Octet với 8 electron xung quanh nó.
9. Những Lưu Ý Khi Áp Dụng Quy Tắc Octet
Khi áp dụng quy tắc Octet, cần lưu ý một số điểm sau để tránh sai sót.
9.1. Xác Định Đúng Số Electron Hóa Trị
Xác định đúng số electron hóa trị của mỗi nguyên tử là bước quan trọng đầu tiên. Số electron hóa trị có thể được xác định bằng cách nhìn vào vị trí của nguyên tố trong bảng tuần hoàn.
9.2. Vẽ Cấu Trúc Lewis Đúng Cách
Vẽ cấu trúc Lewis đúng cách là rất quan trọng để hiểu rõ về sự phân bố electron trong phân tử. Cần đảm bảo rằng tất cả các nguyên tử (trừ Hydro) đều đạt Octet (hoặc Duet) và tổng số electron trong cấu trúc bằng với tổng số electron hóa trị đã tính.
9.3. Nhận Biết Các Trường Hợp Ngoại Lệ
Nhận biết các trường hợp ngoại lệ của quy tắc Octet là rất quan trọng để tránh những kết luận sai lầm. Cần nhớ rằng không phải tất cả các phân tử đều tuân thủ quy tắc Octet một cách tuyệt đối.
10. FAQ – Câu Hỏi Thường Gặp Về Quy Tắc Octet
Dưới đây là một số câu hỏi thường gặp về quy tắc Octet, cùng với câu trả lời chi tiết.
10.1. Quy Tắc Octet Có Phải Lúc Nào Cũng Đúng Không?
Không, quy tắc Octet không phải lúc nào cũng đúng. Có một số trường hợp ngoại lệ, như phân tử thiếu electron, phân tử có số lẻ electron và phân tử với nguyên tử trung tâm mở rộng Octet.
10.2. Tại Sao Các Khí Hiếm Lại Bền Vững?
Các khí hiếm bền vững vì chúng có 8 electron ở lớp vỏ ngoài cùng (trừ Heli chỉ có 2), tạo nên cấu hình electron bền vững.
10.3. Làm Thế Nào Để Vẽ Cấu Trúc Lewis Đúng Cách?
Để vẽ cấu trúc Lewis đúng cách, cần xác định tổng số electron hóa trị, vẽ cấu trúc khung của phân tử, nối các nguyên tử bằng liên kết đơn, điền đầy các electron vào các nguyên tử xung quanh để đạt Octet, và chuyển các electron từ nguyên tử xung quanh tạo liên kết bội nếu cần thiết.
10.4. Quy Tắc Octet Có Ứng Dụng Gì Trong Thực Tế?
Quy tắc Octet có nhiều ứng dụng trong thực tế, như dự đoán tính chất hóa học của các chất, thiết kế thuốc và vật liệu mới, và giải thích các hiện tượng hóa học trong tự nhiên.
10.5. Điện Tích Hình Thức Là Gì?
Điện tích hình thức là điện tích mà một nguyên tử sẽ có nếu tất cả các electron trong liên kết được chia đều cho các nguyên tử liên kết.
10.6. Độ Âm Điện Ảnh Hưởng Đến Quy Tắc Octet Như Thế Nào?
Độ âm điện ảnh hưởng đến sự phân bố electron trong phân tử. Các nguyên tử có độ âm điện cao có xu hướng hút electron mạnh hơn, làm cho liên kết trở nên phân cực hơn và ảnh hưởng đến sự phân bố electron xung quanh nguyên tử.
10.7. Quy Tắc Duet Áp Dụng Cho Nguyên Tố Nào?
Quy tắc Duet áp dụng cho các nguyên tử nhỏ như Hydro và Heli.
10.8. Sự Mở Rộng Octet Xảy Ra Ở Nguyên Tố Nào?
Sự mở rộng Octet xảy ra ở các nguyên tử từ chu kỳ 3 trở xuống, như Phosphorus, Sulfur và Chlorine.
10.9. Làm Thế Nào Để Nhận Biết Các Trường Hợp Ngoại Lệ Của Quy Tắc Octet?
Để nhận biết các trường hợp ngoại lệ của quy tắc Octet, cần xem xét cấu trúc phân tử, số electron hóa trị và vị trí của nguyên tố trong bảng tuần hoàn.
10.10. Tại Sao Cần Nắm Vững Quy Tắc Octet?
Nắm vững quy tắc Octet giúp chúng ta hiểu rõ hơn về sự hình thành liên kết hóa học, dự đoán tính chất của các chất và giải thích các hiện tượng hóa học trong tự nhiên và trong phòng thí nghiệm.
Bạn đang gặp khó khăn trong việc tìm hiểu về xe tải và các vấn đề liên quan? Đừng lo lắng, XETAIMYDINH.EDU.VN luôn sẵn sàng hỗ trợ bạn. Hãy truy cập trang web của chúng tôi để tìm hiểu thông tin chi tiết về các loại xe tải, so sánh giá cả, thông số kỹ thuật và nhận tư vấn từ các chuyên gia hàng đầu.
Liên hệ ngay với Xe Tải Mỹ Đình:
- Địa chỉ: Số 18 đường Mỹ Đình, phường Mỹ Đình 2, quận Nam Từ Liêm, Hà Nội
- Hotline: 0247 309 9988
- Trang web: XETAIMYDINH.EDU.VN
Chúng tôi cam kết cung cấp thông tin chính xác, đáng tin cậy và giải đáp mọi thắc mắc của bạn một cách nhanh chóng và hiệu quả.