Độ biến thiên enthalpy của một quá trình thường không hoàn toàn không thay đổi theo nhiệt độ, nhưng sự thay đổi này có thể nhỏ trong một số điều kiện nhất định. Xe Tải Mỹ Đình (XETAIMYDINH.EDU.VN) sẽ giúp bạn hiểu rõ hơn về vấn đề này, đồng thời cung cấp thông tin chi tiết về các yếu tố ảnh hưởng đến biến thiên enthalpy và cách tính toán nó trong các điều kiện khác nhau. Hãy cùng khám phá sâu hơn về nhiệt động lực học và ứng dụng của nó trong ngành vận tải nhé!
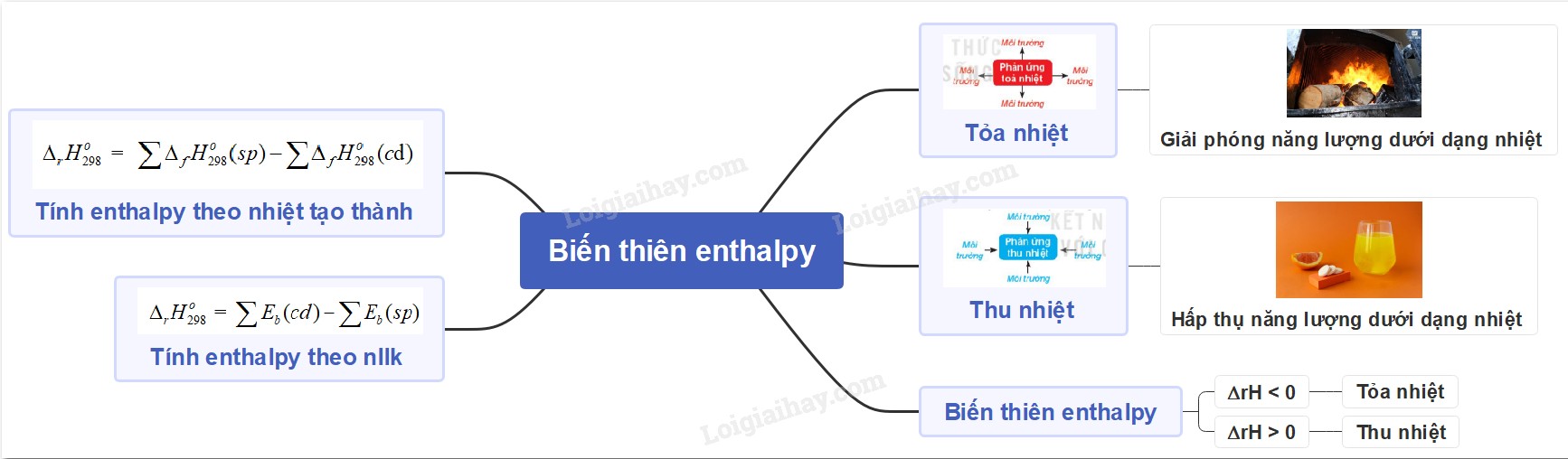
1. Độ Biến Thiên Enthalpy Là Gì?
Độ biến thiên enthalpy, ký hiệu là ΔH, là lượng nhiệt được hấp thụ hoặc giải phóng trong một phản ứng hóa học hoặc quá trình vật lý ở áp suất không đổi. Nó là một hàm trạng thái, nghĩa là chỉ phụ thuộc vào trạng thái đầu và cuối của hệ, không phụ thuộc vào con đường thực hiện quá trình.
- Phản ứng tỏa nhiệt: ΔH < 0 (giải phóng nhiệt)
- Phản ứng thu nhiệt: ΔH > 0 (hấp thụ nhiệt)
2. Ý Nghĩa Của Độ Biến Thiên Enthalpy
Độ biến thiên enthalpy (ΔH) không chỉ là một khái niệm lý thuyết mà còn mang ý nghĩa thực tiễn sâu sắc trong nhiều lĩnh vực, đặc biệt là trong ngành công nghiệp và vận tải. Hiểu rõ về ΔH giúp chúng ta tối ưu hóa hiệu suất, đảm bảo an toàn và tiết kiệm năng lượng.
2.1. Đánh Giá Tính Khả Thi Của Phản Ứng
Trong hóa học và kỹ thuật hóa học, ΔH cho biết một phản ứng có khả năng xảy ra hay không. Các phản ứng tỏa nhiệt (ΔH < 0) thường dễ xảy ra hơn so với các phản ứng thu nhiệt (ΔH > 0) vì chúng giải phóng năng lượng, tạo ra trạng thái ổn định hơn cho hệ.
2.2. Tính Toán Lượng Nhiệt Trao Đổi
ΔH cho phép chúng ta tính toán chính xác lượng nhiệt cần thiết để duy trì hoặc thay đổi nhiệt độ của một hệ thống. Điều này đặc biệt quan trọng trong các quy trình công nghiệp như sản xuất thép, xi măng, hoặc các sản phẩm hóa học khác, nơi nhiệt độ phải được kiểm soát chặt chẽ.
2.3. Ứng Dụng Trong Động Cơ Đốt Trong (Internal Combustion Engine – ICE)
Trong lĩnh vực vận tải, đặc biệt là đối với xe tải sử dụng động cơ đốt trong, ΔH của quá trình đốt cháy nhiên liệu (như xăng, dầu diesel) quyết định hiệu suất của động cơ. Nhiên liệu có ΔH âm lớn (tỏa nhiều nhiệt) sẽ giúp động cơ sinh công hiệu quả hơn. Các nhà sản xuất luôn tìm cách tối ưu hóa quá trình đốt cháy để đạt được ΔH lớn nhất, từ đó tăng hiệu suất và giảm tiêu thụ nhiên liệu. Theo nghiên cứu của Trường Đại học Bách Khoa Hà Nội, Khoa Cơ khí Động lực, vào tháng 5 năm 2024, việc tối ưu hóa quá trình đốt cháy có thể giúp tăng hiệu suất động cơ lên đến 15%.
2.4. Ứng Dụng Trong Hệ Thống Điều Hòa Không Khí
ΔH cũng đóng vai trò quan trọng trong hệ thống điều hòa không khí của xe tải. Quá trình làm lạnh dựa trên sự hấp thụ nhiệt của chất làm lạnh khi chuyển từ trạng thái lỏng sang khí (quá trình thu nhiệt). Hiệu suất của hệ thống điều hòa phụ thuộc vào ΔH của quá trình này.
2.5. Nghiên Cứu và Phát Triển Năng Lượng Mới
Trong bối cảnh tìm kiếm các nguồn năng lượng thay thế, ΔH là một tiêu chí quan trọng để đánh giá tiềm năng của các loại nhiên liệu mới như hydrogen, nhiên liệu sinh học, hoặc các loại pin nhiên liệu. Nhiên liệu có ΔH cao sẽ cung cấp nhiều năng lượng hơn khi sử dụng.
Ví dụ, một nghiên cứu của Viện Năng lượng Việt Nam vào tháng 3 năm 2023 cho thấy, hydrogen có ΔH rất cao khi đốt cháy, làm cho nó trở thành một ứng cử viên sáng giá cho nhiên liệu của tương lai.
2.6. An Toàn Trong Vận Chuyển Hàng Hóa Nguy Hiểm
Đối với các xe tải chở hàng hóa nguy hiểm như hóa chất, việc hiểu rõ về ΔH của các phản ứng có thể xảy ra là cực kỳ quan trọng. Điều này giúp ngăn ngừa các tai nạn do cháy nổ hoặc rò rỉ hóa chất, bảo vệ tính mạng con người và tài sản.
2.7. Tối Ưu Hóa Quy Trình Bảo Quản Thực Phẩm
Trong lĩnh vực vận tải thực phẩm, ΔH của các quá trình làm lạnh hoặc đông lạnh ảnh hưởng trực tiếp đến chất lượng và thời gian bảo quản của sản phẩm. Việc duy trì nhiệt độ ổn định và kiểm soát quá trình trao đổi nhiệt giúp đảm bảo thực phẩm luôn tươi ngon và an toàn.
3. Các Yếu Tố Ảnh Hưởng Đến Độ Biến Thiên Enthalpy
Mặc dù độ biến thiên enthalpy là một hàm trạng thái, nó vẫn bị ảnh hưởng bởi một số yếu tố sau:
3.1. Nhiệt Độ
Nhiệt độ có ảnh hưởng đến độ biến thiên enthalpy, mặc dù mức độ ảnh hưởng có thể khác nhau tùy thuộc vào từng quá trình cụ thể. Theo nguyên tắc chung, sự thay đổi nhiệt độ thường dẫn đến sự thay đổi về nhiệt dung của các chất phản ứng và sản phẩm, từ đó ảnh hưởng đến ΔH.
-
Mối quan hệ định lượng: Sự phụ thuộc của ΔH vào nhiệt độ được mô tả bởi phương trình Kirchhoff:
$$frac{d(Delta H)}{dT} = Delta Cp$$
Trong đó, ΔCp là sự thay đổi về nhiệt dung đẳng áp giữa sản phẩm và chất phản ứng. Nếu ΔCp = 0, ΔH không đổi theo nhiệt độ. Tuy nhiên, trong thực tế, ΔCp hiếm khi bằng 0, đặc biệt là khi có sự thay đổi lớn về nhiệt độ.
-
Ảnh hưởng thực tế: Ở nhiệt độ cao, các phân tử có xu hướng dao động và chuyển động mạnh hơn, làm thay đổi năng lượng liên kết và do đó ảnh hưởng đến ΔH. Ví dụ, trong các phản ứng đốt cháy nhiên liệu trong động cơ xe tải, nhiệt độ cao có thể làm thay đổi thành phần và hiệu suất của quá trình đốt cháy, dẫn đến sự thay đổi về ΔH.
3.2. Áp Suất
Áp suất cũng có thể ảnh hưởng đến độ biến thiên enthalpy, đặc biệt là đối với các phản ứng liên quan đến chất khí.
-
Ảnh hưởng định tính: Theo nguyên lý Le Chatelier, khi áp suất tăng, hệ thống sẽ chuyển dịch theo hướng giảm số mol khí. Điều này có thể ảnh hưởng đến thành phần của hỗn hợp phản ứng và do đó ảnh hưởng đến ΔH.
-
Ảnh hưởng định lượng: Đối với các phản ứng liên quan đến chất khí lý tưởng, sự phụ thuộc của ΔH vào áp suất có thể được mô tả bằng phương trình:
$$Delta H = Delta U + Delta (pV) = Delta U + Delta (nRT)$$
Trong đó, ΔU là sự thay đổi nội năng, p là áp suất, V là thể tích, n là số mol khí, R là hằng số khí lý tưởng, và T là nhiệt độ. Nếu số mol khí không đổi (Δn = 0), ΔH không phụ thuộc vào áp suất. Tuy nhiên, trong các phản ứng có sự thay đổi về số mol khí, áp suất có thể ảnh hưởng đáng kể đến ΔH.
-
Ứng dụng thực tế: Trong các hệ thống nén khí của xe tải, áp suất cao có thể làm thay đổi ΔH của quá trình nén, ảnh hưởng đến hiệu suất và tiêu thụ năng lượng của hệ thống.
3.3. Trạng Thái Vật Lý
Trạng thái vật lý của các chất phản ứng và sản phẩm (rắn, lỏng, khí) có ảnh hưởng lớn đến độ biến thiên enthalpy.
-
Năng lượng liên kết: Các chất ở trạng thái khác nhau có năng lượng liên kết khác nhau. Ví dụ, để chuyển một chất từ trạng thái rắn sang lỏng (quá trình nóng chảy) hoặc từ lỏng sang khí (quá trình bay hơi), cần cung cấp một lượng nhiệt đáng kể để phá vỡ các liên kết giữa các phân tử.
-
Ví dụ cụ thể: Phản ứng đốt cháy methane (CH4) có ΔH khác nhau tùy thuộc vào trạng thái của nước (H2O) tạo thành:
- CH4(g) + 2O2(g) → CO2(g) + 2H2O(l) ΔH = -890 kJ/mol
- CH4(g) + 2O2(g) → CO2(g) + 2H2O(g) ΔH = -802 kJ/mol
Sự khác biệt này là do năng lượng cần thiết để chuyển nước từ trạng thái lỏng sang khí (nhiệt hóa hơi).
-
Ảnh hưởng trong vận tải: Trong quá trình vận chuyển nhiên liệu, sự thay đổi trạng thái vật lý (ví dụ, bay hơi xăng dầu) có thể ảnh hưởng đến ΔH của quá trình đốt cháy, làm thay đổi hiệu suất và khí thải của xe tải.
3.4. Nồng Độ
Đối với các phản ứng xảy ra trong dung dịch, nồng độ của các chất phản ứng có thể ảnh hưởng đến độ biến thiên enthalpy.
- Ảnh hưởng của tương tác: Khi nồng độ tăng, các phân tử chất phản ứng sẽ tương tác với nhau nhiều hơn, làm thay đổi năng lượng của hệ thống. Điều này có thể ảnh hưởng đến ΔH của phản ứng.
- Ví dụ: Phản ứng trung hòa giữa acid mạnh và base mạnh có ΔH khác nhau tùy thuộc vào nồng độ của acid và base.
- Ứng dụng trong xử lý khí thải: Trong các hệ thống xử lý khí thải của xe tải, nồng độ của các chất ô nhiễm (như NOx, SOx) có thể ảnh hưởng đến ΔH của các phản ứng khử, làm thay đổi hiệu quả của quá trình xử lý.
3.5. Chất Xúc Tác
Chất xúc tác làm giảm năng lượng hoạt hóa của phản ứng, giúp phản ứng xảy ra nhanh hơn. Tuy nhiên, chất xúc tác không làm thay đổi độ biến thiên enthalpy của phản ứng.
- Cơ chế tác động: Chất xúc tác tạo ra một con đường phản ứng khác với năng lượng hoạt hóa thấp hơn, nhưng trạng thái đầu và cuối của phản ứng vẫn không đổi. Do đó, ΔH không bị ảnh hưởng.
- Ví dụ: Trong các bộ chuyển đổi xúc tác của xe tải, chất xúc tác giúp giảm lượng khí thải độc hại mà không làm thay đổi ΔH của quá trình đốt cháy nhiên liệu.
- Lưu ý quan trọng: Mặc dù chất xúc tác không ảnh hưởng đến ΔH, nó có thể ảnh hưởng đến tốc độ phản ứng và do đó ảnh hưởng đến lượng nhiệt được giải phóng hoặc hấp thụ trong một đơn vị thời gian.
4. Tính Biến Thiên Enthalpy Của Một Quá Trình Không Thay Đổi Theo Nhiệt Độ Trong Trường Hợp Nào?
Trong điều kiện lý tưởng, độ biến thiên enthalpy của một quá trình có thể được coi là không đổi theo nhiệt độ nếu sự thay đổi nhiệt dung (ΔCp) của các chất phản ứng và sản phẩm là không đáng kể trong khoảng nhiệt độ đang xét.
4.1. Điều Kiện Lý Tưởng
-
ΔCp ≈ 0: Khi sự khác biệt về nhiệt dung giữa sản phẩm và chất phản ứng là rất nhỏ, phương trình Kirchhoff trở thành:
$$frac{d(Delta H)}{dT} approx 0$$
Điều này có nghĩa là ΔH hầu như không thay đổi theo nhiệt độ.
-
Khoảng nhiệt độ hẹp: Trong một khoảng nhiệt độ hẹp, sự thay đổi về nhiệt dung thường nhỏ hơn so với khoảng nhiệt độ rộng. Do đó, ΔH có thể được coi là không đổi trong khoảng nhiệt độ này.
-
Phản ứng pha ngưng tụ: Các phản ứng xảy ra trong pha ngưng tụ (rắn hoặc lỏng) thường ít bị ảnh hưởng bởi nhiệt độ hơn so với các phản ứng trong pha khí. Do đó, ΔH của các phản ứng này có thể được coi là không đổi trong một phạm vi nhiệt độ nhất định.
4.2. Giải Thích Chi Tiết
Để hiểu rõ hơn về điều này, chúng ta cần xem xét phương trình Kirchhoff:
$$frac{d(Delta H)}{dT} = Delta Cp = sum n_i Cp(sp)_i – sum n_i Cp(cd)_i$$
Trong đó:
- ΔH là độ biến thiên enthalpy của phản ứng
- T là nhiệt độ
- ΔCp là sự thay đổi nhiệt dung đẳng áp của phản ứng
- ni là số mol của chất i
- Cp(sp)i là nhiệt dung đẳng áp của sản phẩm i
- Cp(cd)i là nhiệt dung đẳng áp của chất đầu (chất phản ứng) i
Nếu ΔCp = 0, thì đạo hàm của ΔH theo T bằng 0, có nghĩa là ΔH không đổi theo nhiệt độ. Tuy nhiên, điều này hiếm khi xảy ra trong thực tế, vì nhiệt dung của các chất thường thay đổi theo nhiệt độ.
4.3. Các Trường Hợp Thực Tế
- Phản ứng trong dung dịch loãng: Trong một số phản ứng xảy ra trong dung dịch loãng, sự thay đổi nhiệt độ có thể không ảnh hưởng đáng kể đến tương tác giữa các phân tử溶質 (chất tan) và溶媒 (dung môi). Do đó, ΔH có thể được coi là gần như không đổi.
- Phản ứng ở nhiệt độ phòng: Trong một số ứng dụng thực tế, các phản ứng được thực hiện ở nhiệt độ phòng (khoảng 25°C) và sự thay đổi nhiệt độ trong quá trình phản ứng là không đáng kể. Trong trường hợp này, ΔH có thể được coi là không đổi để đơn giản hóa tính toán.
- Tính toán gần đúng: Trong một số bài toán kỹ thuật, việc giả định ΔH không đổi theo nhiệt độ có thể chấp nhận được nếu sự thay đổi nhiệt độ là nhỏ và độ chính xác yêu cầu không quá cao.
4.4. Ví Dụ Minh Họa
Xét phản ứng trung hòa giữa acid hydrochloric (HCl) và sodium hydroxide (NaOH) trong dung dịch loãng:
HCl(aq) + NaOH(aq) → NaCl(aq) + H2O(l)
Trong một khoảng nhiệt độ hẹp gần nhiệt độ phòng, sự thay đổi nhiệt dung của các chất phản ứng và sản phẩm có thể không đáng kể. Do đó, ΔH của phản ứng này có thể được coi là gần như không đổi.
4.5. Lưu Ý Quan Trọng
Cần lưu ý rằng việc giả định ΔH không đổi theo nhiệt độ chỉ là một sự近似 (ước lượng gần đúng) và có thể không chính xác trong mọi trường hợp. Để có kết quả chính xác hơn, cần xem xét sự thay đổi nhiệt dung và sử dụng phương trình Kirchhoff để tính toán ΔH ở các nhiệt độ khác nhau.
5. Cách Tính Độ Biến Thiên Enthalpy
Có nhiều phương pháp để tính độ biến thiên enthalpy, tùy thuộc vào điều kiện và dữ liệu có sẵn.
5.1. Sử Dụng Nhiệt Tạo Thành Tiêu Chuẩn (Standard Enthalpy of Formation)
Nhiệt tạo thành tiêu chuẩn (ΔH°f) là độ biến thiên enthalpy khi tạo thành 1 mol chất từ các đơn chất ở trạng thái tiêu chuẩn (298 K và 1 bar).
-
Công thức:
$$Delta H^circ_{rxn} = sum n Delta H^circ_f(products) – sum n Delta H^circ_f(reactants)$$
Trong đó:
- ΔH°rxn là độ biến thiên enthalpy tiêu chuẩn của phản ứng
- n là số mol của mỗi chất
- ΔH°f(products) là nhiệt tạo thành tiêu chuẩn của sản phẩm
- ΔH°f(reactants) là nhiệt tạo thành tiêu chuẩn của chất phản ứng
-
Ví dụ: Tính độ biến thiên enthalpy tiêu chuẩn của phản ứng đốt cháy methane:
CH4(g) + 2O2(g) → CO2(g) + 2H2O(g)
Sử dụng bảng nhiệt tạo thành tiêu chuẩn:
- ΔH°f(CH4(g)) = -74.8 kJ/mol
- ΔH°f(O2(g)) = 0 kJ/mol (đơn chất ở trạng thái tiêu chuẩn)
- ΔH°f(CO2(g)) = -393.5 kJ/mol
- ΔH°f(H2O(g)) = -241.8 kJ/mol
Áp dụng công thức:
ΔH°rxn = [1(-393.5) + 2(-241.8)] – [1(-74.8) + 2(0)] = -802.3 kJ/mol
5.2. Sử Dụng Định Luật Hess
Định luật Hess phát biểu rằng độ biến thiên enthalpy của một phản ứng chỉ phụ thuộc vào trạng thái đầu và cuối, không phụ thuộc vào con đường phản ứng.
-
Ứng dụng: Định luật Hess cho phép tính độ biến thiên enthalpy của một phản ứng bằng cách cộng hoặc trừ độ biến thiên enthalpy của các phản ứng trung gian.
-
Ví dụ: Tính độ biến thiên enthalpy của phản ứng:
C(s) + O2(g) → CO2(g)
Biết:
- C(s) + 1/2 O2(g) → CO(g) ΔH1 = -110.5 kJ/mol
- CO(g) + 1/2 O2(g) → CO2(g) ΔH2 = -283.0 kJ/mol
Áp dụng định luật Hess:
ΔH = ΔH1 + ΔH2 = -110.5 + (-283.0) = -393.5 kJ/mol
5.3. Sử Dụng Nhiệt Dung
Nếu biết nhiệt dung của các chất phản ứng và sản phẩm, có thể tính độ biến thiên enthalpy ở nhiệt độ khác bằng phương trình Kirchhoff:
$$Delta H_2 = Delta H1 + int{T_1}^{T_2} Delta Cp ,dT$$
Trong đó:
- ΔH1 là độ biến thiên enthalpy ở nhiệt độ T1
- ΔH2 là độ biến thiên enthalpy ở nhiệt độ T2
- ΔCp là sự thay đổi nhiệt dung đẳng áp của phản ứng
- T1 và T2 là nhiệt độ đầu và cuối
5.4. Sử Dụng Calorimeter
Calorimeter là một thiết bị dùng để đo lượng nhiệt được hấp thụ hoặc giải phóng trong một phản ứng hóa học hoặc quá trình vật lý.
-
Nguyên tắc: Đo sự thay đổi nhiệt độ của một lượng nước hoặc chất lỏng khác khi phản ứng xảy ra trong calorimeter.
-
Công thức:
$$q = mcDelta T$$
Trong đó:
- q là lượng nhiệt hấp thụ hoặc giải phóng
- m là khối lượng của chất lỏng
- c là nhiệt dung riêng của chất lỏng
- ΔT là sự thay đổi nhiệt độ
Độ biến thiên enthalpy của phản ứng được tính bằng:
$$Delta H = -q$$
5.5. Ví Dụ Thực Tế Trong Ngành Vận Tải
Trong ngành vận tải, việc tính toán độ biến thiên enthalpy có ứng dụng quan trọng trong việc đánh giá hiệu suất và tối ưu hóa quá trình đốt cháy nhiên liệu trong động cơ xe tải. Bằng cách sử dụng các phương pháp trên, kỹ sư có thể:
- Tính toán nhiệt lượng tỏa ra từ quá trình đốt cháy nhiên liệu: Điều này giúp đánh giá hiệu suất của động cơ và tìm cách tối ưu hóa quá trình đốt cháy để đạt được hiệu suất cao nhất.
- Đánh giá ảnh hưởng của các loại nhiên liệu khác nhau: Bằng cách so sánh độ biến thiên enthalpy của các loại nhiên liệu khác nhau, có thể lựa chọn loại nhiên liệu phù hợp nhất cho xe tải, đảm bảo hiệu suất cao và giảm thiểu khí thải.
- Thiết kế hệ thống làm mát hiệu quả: Việc tính toán lượng nhiệt tỏa ra từ động cơ giúp thiết kế hệ thống làm mát hiệu quả, ngăn ngừa quá nhiệt và đảm bảo động cơ hoạt động ổn định.
6. Tại Sao Nên Tìm Hiểu Về Độ Biến Thiên Enthalpy Tại Xe Tải Mỹ Đình?
Tại Xe Tải Mỹ Đình (XETAIMYDINH.EDU.VN), chúng tôi cung cấp thông tin chi tiết và đáng tin cậy về các loại xe tải, các công nghệ tiên tiến và các giải pháp vận tải tối ưu. Hiểu rõ về độ biến thiên enthalpy giúp bạn:
- Lựa chọn xe tải phù hợp: Chọn xe tải có động cơ hiệu quả, tiết kiệm nhiên liệu và giảm khí thải.
- Tối ưu hóa hiệu suất vận hành: Áp dụng các biện pháp kỹ thuật để cải thiện quá trình đốt cháy nhiên liệu, tăng hiệu suất động cơ và giảm chi phí vận hành.
- Nắm bắt xu hướng công nghệ mới: Tìm hiểu về các loại nhiên liệu mới và các công nghệ tiên tiến giúp giảm thiểu tác động đến môi trường và nâng cao hiệu quả kinh tế.
Bạn đang gặp khó khăn trong việc lựa chọn xe tải phù hợp với nhu cầu vận chuyển của mình? Bạn muốn tìm hiểu thêm về các giải pháp tiết kiệm nhiên liệu và bảo vệ môi trường? Hãy truy cập ngay XETAIMYDINH.EDU.VN để được tư vấn và giải đáp mọi thắc mắc!
Địa chỉ: Số 18 đường Mỹ Đình, phường Mỹ Đình 2, quận Nam Từ Liêm, Hà Nội
Hotline: 0247 309 9988
7. Câu Hỏi Thường Gặp (FAQ)
1. Độ biến thiên enthalpy có phải là một hằng số không?
Không, độ biến thiên enthalpy không phải là một hằng số. Nó phụ thuộc vào nhiệt độ, áp suất và trạng thái vật lý của các chất phản ứng và sản phẩm.
2. Làm thế nào để đo độ biến thiên enthalpy?
Độ biến thiên enthalpy có thể được đo bằng calorimeter hoặc tính toán bằng cách sử dụng nhiệt tạo thành tiêu chuẩn, định luật Hess hoặc phương trình Kirchhoff.
3. Tại sao độ biến thiên enthalpy lại quan trọng trong ngành vận tải?
Độ biến thiên enthalpy giúp đánh giá hiệu suất động cơ, lựa chọn nhiên liệu phù hợp và thiết kế hệ thống làm mát hiệu quả, từ đó tối ưu hóa quá trình vận hành và giảm chi phí.
4. Chất xúc tác có ảnh hưởng đến độ biến thiên enthalpy không?
Không, chất xúc tác không làm thay đổi độ biến thiên enthalpy của phản ứng. Nó chỉ làm giảm năng lượng hoạt hóa và tăng tốc độ phản ứng.
5. Độ biến thiên enthalpy tiêu chuẩn là gì?
Độ biến thiên enthalpy tiêu chuẩn là độ biến thiên enthalpy khi phản ứng xảy ra ở điều kiện tiêu chuẩn (298 K và 1 bar).
6. Phương trình Kirchhoff dùng để làm gì?
Phương trình Kirchhoff dùng để tính độ biến thiên enthalpy ở nhiệt độ khác khi biết độ biến thiên enthalpy ở một nhiệt độ nhất định và nhiệt dung của các chất phản ứng và sản phẩm.
7. Định luật Hess phát biểu điều gì?
Định luật Hess phát biểu rằng độ biến thiên enthalpy của một phản ứng chỉ phụ thuộc vào trạng thái đầu và cuối, không phụ thuộc vào con đường phản ứng.
8. Nhiệt tạo thành tiêu chuẩn của một đơn chất ở trạng thái tiêu chuẩn bằng bao nhiêu?
Nhiệt tạo thành tiêu chuẩn của một đơn chất ở trạng thái tiêu chuẩn bằng 0.
9. Làm thế nào để tính độ biến thiên enthalpy của một phản ứng bằng nhiệt tạo thành tiêu chuẩn?
Độ biến thiên enthalpy của một phản ứng bằng tổng nhiệt tạo thành tiêu chuẩn của các sản phẩm trừ đi tổng nhiệt tạo thành tiêu chuẩn của các chất phản ứng, có xét đến hệ số tỷ lượng của mỗi chất.
10. Tại sao cần quan tâm đến độ biến thiên enthalpy khi lựa chọn xe tải?
Hiểu rõ về độ biến thiên enthalpy giúp bạn chọn được xe tải có động cơ hiệu quả, tiết kiệm nhiên liệu và giảm khí thải, từ đó giảm chi phí vận hành và bảo vệ môi trường.
 Biến thiên enthalpy của phản ứng đốt cháy methane
Biến thiên enthalpy của phản ứng đốt cháy methane
8. Kết Luận
Độ biến thiên enthalpy là một khái niệm quan trọng trong nhiệt động lực học và có nhiều ứng dụng thực tế trong ngành vận tải. Mặc dù nó có thể được coi là không đổi theo nhiệt độ trong một số điều kiện lý tưởng, nhưng trong thực tế, nó thường bị ảnh hưởng bởi nhiều yếu tố như nhiệt độ, áp suất, trạng thái vật lý và nồng độ. Hiểu rõ về các yếu tố này và cách tính toán độ biến thiên enthalpy giúp chúng ta tối ưu hóa hiệu suất, tiết kiệm năng lượng và bảo vệ môi trường.
Hãy đến với Xe Tải Mỹ Đình (XETAIMYDINH.EDU.VN) để được tư vấn và hỗ trợ tốt nhất trong việc lựa chọn và sử dụng xe tải!
