Độ tan của muối là một yếu tố quan trọng trong nhiều lĩnh vực, từ hóa học đến đời sống hàng ngày. Hãy cùng Xe Tải Mỹ Đình tìm hiểu chi tiết về độ tan, công thức tính và các yếu tố ảnh hưởng đến độ Tan Của Muối để hiểu rõ hơn về tính chất này.
1. Độ Tan Là Gì?
1.1. Khái niệm về độ tan
Độ tan, hay còn gọi là độ hòa tan, là đại lượng đặc trưng cho khả năng hòa tan của một chất (rắn, lỏng hoặc khí) vào một dung môi để tạo thành một dung dịch đồng nhất. Hiểu một cách đơn giản, đó là số gam chất tan hòa tan trong 100g dung môi (thường là nước) để tạo ra một dung dịch bão hòa ở một điều kiện nhiệt độ nhất định.
Theo nghiên cứu của Trường Đại học Khoa học Tự nhiên Hà Nội, Khoa Hóa học, vào tháng 5 năm 2024, độ tan của một chất phụ thuộc vào bản chất của chất tan và dung môi, nhiệt độ, áp suất (đối với chất khí) và các yếu tố khác.
Dựa vào đặc trưng này, người ta phân loại chất tan như sau:
- Chất tan nhiều: Nếu 100g nước hòa tan được trên 10g chất.
- Chất tan ít: Nếu 100g nước hòa tan được dưới 1g chất.
- Chất không tan: Nếu 100g nước chỉ hòa tan được dưới 0,01g chất.
1.2. Tính tan của muối, axit, bazơ trong nước
-
Axit: Hầu hết các axit đều tan trong nước, trừ axit silixic (H2SiO3).
-
Bazơ: Phần lớn các bazơ không tan trong nước, trừ NaOH, Ba(OH)2, KOH và Ca(OH)2 ít tan.
-
Muối:
- Tất cả các muối của Na, K và muối nitrat (-NO3) đều tan trong nước.
- Đa số các muối clorua và sunfat đều tan.
- Phần lớn muối cacbonat không tan.
Thông tin này được trích dẫn từ Sách giáo khoa Hóa học lớp 9, Nhà xuất bản Giáo dục Việt Nam, trang 25, cung cấp một cái nhìn tổng quan về tính tan của các hợp chất hóa học.
 Độ tan của muối là gì
Độ tan của muối là gì
1.3. Độ tan của muối và ứng dụng thực tiễn trong đời sống
Độ tan của muối không chỉ là một khái niệm hóa học khô khan, mà còn có nhiều ứng dụng thiết thực trong đời sống hàng ngày. Dưới đây là một số ví dụ điển hình:
1.3.1. Trong nấu ăn
- Nêm nếm gia vị: Độ tan của muối ăn (NaCl) trong nước giúp chúng ta dễ dàng nêm nếm gia vị cho món ăn, đảm bảo hương vị hài hòa và vừa miệng.
- Ướp thực phẩm: Muối tan trong nước sẽ thấm sâu vào thực phẩm, giúp bảo quản và tăng hương vị cho món ăn. Ví dụ, ướp thịt bằng muối giúp thịt săn chắc và đậm đà hơn.
- Làm nước muối sinh lý: Nước muối sinh lý được pha chế từ muối ăn và nước cất theo tỷ lệ nhất định, dựa trên độ tan của muối để tạo ra dung dịch có nồng độ phù hợp với cơ thể.
1.3.2. Trong y học
- Truyền dịch: Các dung dịch truyền tĩnh mạch thường chứa muối và các chất điện giải khác, được pha chế dựa trên độ tan của chúng trong nước để đảm bảo an toàn và hiệu quả cho người bệnh.
- Điều trị mất nước: Oresol là một loại thuốc dùng để bù nước và điện giải cho người bị tiêu chảy hoặc mất nước, thành phần chính là muối và đường, được pha chế theo tỷ lệ chính xác dựa trên độ tan của chúng.
- Sản xuất thuốc: Độ tan của các hoạt chất trong dược phẩm là yếu tố quan trọng ảnh hưởng đến khả năng hấp thụ và hiệu quả điều trị của thuốc.
1.3.3. Trong công nghiệp
- Sản xuất muối: Quá trình sản xuất muối từ nước biển dựa trên độ tan của muối trong nước, khi nước bay hơi, độ tan vượt quá giới hạn, muối sẽ kết tinh và được thu hoạch.
- Xử lý nước thải: Độ tan của các chất ô nhiễm trong nước thải là yếu tố cần xem xét khi lựa chọn phương pháp xử lý phù hợp, ví dụ, sử dụng các chất kết tủa để làm giảm độ tan của các chất ô nhiễm, giúp loại bỏ chúng dễ dàng hơn.
- Sản xuất phân bón: Nhiều loại phân bón chứa các muối hòa tan, giúp cây trồng dễ dàng hấp thụ các chất dinh dưỡng cần thiết.
1.3.4. Trong đời sống hàng ngày
- Vệ sinh nhà cửa: Nước muối có tính sát khuẩn nhẹ, được sử dụng để lau nhà, rửa rau quả, giúp loại bỏ vi khuẩn và bụi bẩn.
- Bảo quản thực phẩm: Ngâm rau quả trong nước muối giúp kéo dài thời gian bảo quản, ngăn ngừa sự phát triển của vi khuẩn và nấm mốc.
- Chăm sóc cá cảnh: Muối được sử dụng trong hồ cá để điều chỉnh độ pH, khử trùng và phòng ngừa bệnh tật cho cá.
Như vậy, độ tan của muối có vai trò quan trọng trong nhiều lĩnh vực của đời sống, từ những việc nhỏ nhặt hàng ngày đến các ứng dụng công nghiệp và y học phức tạp. Hiểu rõ về độ tan giúp chúng ta ứng dụng hiệu quả hơn các kiến thức hóa học vào thực tế, nâng cao chất lượng cuộc sống.
2. Công Thức Tính Độ Tan Là Gì?
Độ tan được xác định theo công thức:
S = (mct/mdm) x 100
Trong đó:
- S là ký hiệu của độ tan.
- mct là khối lượng của chất tan (gam).
- mdm là khối lượng của dung môi (gam).
Ví dụ: Xác định độ tan của muối Na2CO3 trong nước ở 18 độ C. Biết rằng, ở nhiệt độ này, nếu hòa tan hết 53g Na2CO3 trong 250g nước thì thu được dung dịch bão hòa.
Độ tan của muối Na2CO3 là: SNa2CO3 = 53 x 100 / 250 = 21,2g.
Từ công thức trên, ta cũng có thể suy ra mối quan hệ giữa độ tan của một chất và nồng độ phần trăm dung dịch bão hòa của chúng ở một nhiệt độ xác định:
C% = 100 x S / (100 + S)
Độ tan càng nhỏ tương ứng với chất càng ít tan và ngược lại.
3. Các Yếu Tố Ảnh Hưởng Đến Độ Tan Của Một Chất
3.1. Nhiệt độ
-
Đối với chất khí, độ tan của nó trong dung môi tỉ lệ nghịch với nhiệt độ. Do đó, có thể loại bỏ các chất khí như O2, CO2 ra khỏi dung môi bằng cách đun nóng mà không làm biến đổi hay phân hủy các chất, đồng thời giữ được độ ổn định cho dược chất.
-
Đối với chất rắn thu nhiệt, nhiệt độ càng cao thì độ tan càng lớn. Còn đối với chất rắn tỏa nhiệt khi hòa tan thì nhiệt độ càng cao độ tan sẽ càng giảm.
Theo nghiên cứu của PGS.TS Nguyễn Văn Nội, Khoa Hóa học, Đại học Sư phạm Hà Nội, nhiệt độ ảnh hưởng lớn đến độ tan của chất rắn và chất khí. Đối với chất rắn, độ tan thường tăng khi nhiệt độ tăng, nhưng với chất khí thì ngược lại.
 Độ tan của muối là gì
Độ tan của muối là gì
3.2. Áp suất (đối với chất khí)
Theo định luật Henry, các chất khí với độ tan nhỏ và áp suất không quá cao thì lượng chất khí hòa tan trong một thể tích chất lỏng xác định sẽ tỉ lệ thuận với áp suất của nó trên bề mặt chất lỏng ở nhiệt độ không đổi. Vì vậy, nếu tăng áp suất, độ tan của chất khí sẽ tăng lên và ngược lại.
3.3. Độ phân cực của chất tan và dung môi
-
Các chất phân cực dễ tan trong những dung môi phân cực như nước, kiềm, axit vô cơ, dung dịch muối.
-
Những chất ít phân cực dễ tan trong các dung môi hữu cơ kém phân cực như chloroform, toluene, benzene, dicloromethan.
3.4. Dạng thù hình
Các chất rắn dạng vô định hình sẽ có độ tan lớn hơn so với chất rắn dạng tinh thể. Nguyên nhân là do dạng kết tinh có cấu trúc mạng lưới tinh thể tương đối bền vững. Do vậy, cần nhiều năng lượng để phá vỡ cấu trúc hơn. Tuy nhiên, chất rắn dưới dạng vô định hình không ổn định như dạng tinh thể và thường có xu hướng chuyển sang dạng tinh thể.
3.5. Hiện tượng hydrat hóa
Trong quá trình kết tinh, chất rắn có thể tồn tại dưới dạng khan hoặc ngậm nước. So với dạng ngậm nước, chất rắn ở dạng khan có độ tan lớn hơn.
3.6. Hiện tượng đa hình
Tùy vào điều kiện xảy ra kết tinh mà một chất rắn có thể có các dạng tinh thể khác nhau như đồng kết tinh, hydrat, cùng với các tính chất vật lý và độ tan trong dung môi là không giống nhau. Đối với những tinh thể kém bền sẽ cần ít năng lượng hơn trong việc phá vỡ cấu trúc nên dễ tan hơn.
3.7. Độ pH của dung dịch
-
Khi kiềm hóa dung môi, độ tan của axit yếu sẽ tăng lên.
-
Nếu axit hóa dung môi, các chất kiềm yếu sẽ có độ tan tăng lên.
-
Đối với những chất lưỡng tính, độ pH càng gần điểm đẳng điện thì độ tan sẽ càng giảm và ngược lại.
3.8. Chất điện ly
Chất điện ly trong dung dịch có khả năng làm giảm độ tan của các chất tan nên cần lưu ý pha loãng chất điện ly trước khi hòa vào dung dịch.
3.9. Các ion cùng tên
Khi nồng độ của các ion cùng tên tăng lên, cân bằng điện ly của chất tan sẽ dần chuyển dịch về hướng phân tử ít tan và làm giảm đi độ tan của chất. Vì vậy, để thực hiện việc hòa tan, cần tiến hành với những chất ít tan trước, sau đó mới là các chất dễ tan.
3.10. Hỗn hợp dung môi
Khi kết hợp các hỗn hợp dung môi đồng tan cùng với nước như glycerin-ethanol-nước thì độ tan của những chất khó tan sẽ tăng lên.
4. Bảng Tính Tan Hóa Học Của Một Số Chất
Bảng tính tan hóa học là một công cụ hữu ích giúp chúng ta dự đoán khả năng hòa tan của các chất trong nước. Bảng này thường được trình bày dưới dạng một ma trận, trong đó các hàng biểu thị các cation (ion dương) và các cột biểu thị các anion (ion âm). Tại giao điểm của hàng và cột, ta có thông tin về độ tan của hợp chất được tạo thành từ cation và anion đó.
Ký hiệu thường dùng trong bảng tính tan:
- T: Chất dễ tan (tan tốt trong nước).
- I: Chất ít tan (tan một phần trong nước).
- K: Chất không tan (hầu như không tan trong nước).
- B: Chất bay hơi (dễ chuyển từ trạng thái lỏng hoặc rắn sang trạng thái khí).
- (-): Chất không tồn tại hoặc bị nước phân hủy.
Bảng tính tan của một số muối, axit, bazơ phổ biến:
| Ion | OH- | Cl- | Br- | I- | SO42- | NO3- | CO32- | S2- | PO43- |
|---|---|---|---|---|---|---|---|---|---|
| H+ | T | T | T | T | T | T | T | T | T |
| Li+ | T | T | T | T | T | T | T | T | T |
| Na+ | T | T | T | T | T | T | T | T | T |
| K+ | T | T | T | T | T | T | T | T | T |
| NH4+ | T | T | T | T | T | T | T | T | T |
| Ag+ | K | K | K | K | I | T | K | K | K |
| Mg2+ | K | T | T | T | T | T | K | T | K |
| Ca2+ | I | T | T | T | I | T | K | T | K |
| Ba2+ | T | T | T | T | K | T | K | T | K |
| Pb2+ | K | I | I | I | K | T | K | K | K |
| Zn2+ | K | T | T | T | T | T | K | T | K |
| Fe2+ | K | T | T | T | T | T | K | K | K |
| Fe3+ | K | T | T | T | T | T | K | B | K |
| Cu2+ | K | T | T | T | T | T | K | K | K |
| Al3+ | K | T | T | T | T | T | K | B | K |
Nguồn: Tham khảo từ nhiều nguồn hóa học uy tín và sách giáo khoa.
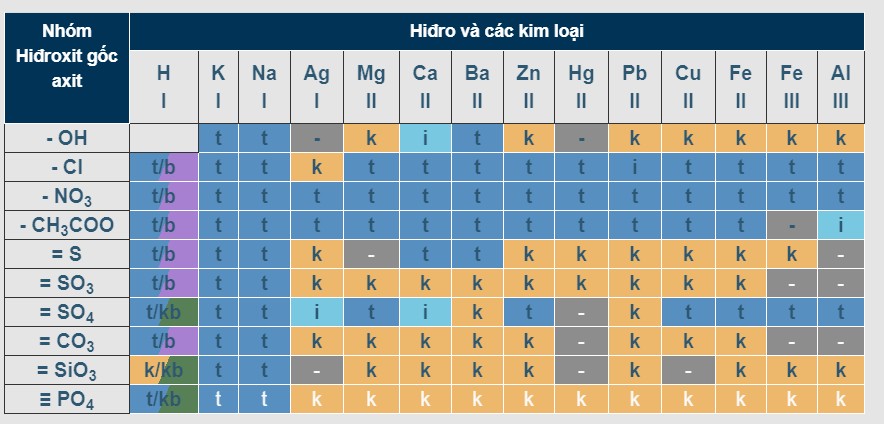 Bảng tính tan của hidro cùng các kim loại
Bảng tính tan của hidro cùng các kim loại
5. Hướng Dẫn Cách Đọc Bảng Tính Tan Đơn Giản Nhất
Bảng tính tan bao gồm các hàng là các anion (gốc axit) và các cột là các cation (kim loại). Với tùy từng chất cụ thể, xác định ion dương và âm, sau đó gióng theo hàng và cột tương ứng để biết trạng thái của chất đó tại ô giao nhau.
Ví dụ, để xác định độ tan của muối NaCl (natri clorua), ta tìm cột Na+ và hàng Cl-. Tại giao điểm của cột và hàng này, ta thấy chữ “T”, nghĩa là NaCl tan tốt trong nước.
Có thể tham khảo cách học bảng tính tan thông qua bài thơ:
Cách ghi nhớ bảng tính tan:
| Hợp chất | Tính chất | Trừ |
|---|---|---|
| Axit (xem ở cột ion H+ cùng anion gốc axit tương ứng) | Tan | H2SiO3 |
| Bazơ (xem ở hàng ion OH- cùng các cation tương ứng) | Không tan | NaOH, KOH, LiOH, Ca(OH)2, NH4OH, Ba(OH)2 |
| – Muối liti – Muối natri – Muối Kali – Muối amoni | Tan | |
| – Muối bạc | Không tan | AgNO3, CH3COOAg |
| – Muối nitrat – Muối axetat | Tan | |
| – Muối clorua – Muối bromua – Muối iotua | Tan | – AgCl: kết tủa trắng – AgBr: kết tủa vàng nhạt – Agl: kết tủa vàng – PbCl2, PbBr2, Pbl2 |
| – Muối sunfat | Tan | – BaSO4, PbSO4, CaSO4: kết tủa trắng – Ag2SO4: ít tan |
| – Muối sunfit – Muối cacbonat | Không tan | Muối của kim loại kiềm cùng amoni NH4+ |
| – Muối sunfua | Không tan | Muối của kim loại kiềm, kiềm thổ cùng amoni NH4+ |
| – Muối photphat | Không tan | Muối, Na+, K+ và amoni NH4+ |
6. Câu Hỏi Thường Gặp (FAQ) Về Độ Tan Của Muối
1. Độ tan của muối có quan trọng không?
Có, độ tan của muối rất quan trọng vì nó ảnh hưởng đến nhiều quá trình hóa học, sinh học và công nghiệp. Nó quyết định khả năng hòa tan của muối trong nước, ảnh hưởng đến nồng độ dung dịch và các phản ứng hóa học xảy ra trong dung dịch đó.
2. Tại sao độ tan của một số muối lại tăng khi nhiệt độ tăng, trong khi một số khác lại giảm?
Độ tan của muối tăng hay giảm khi nhiệt độ thay đổi phụ thuộc vào nhiệt của quá trình hòa tan. Nếu quá trình hòa tan là thu nhiệt (endothermic), độ tan sẽ tăng khi nhiệt độ tăng. Ngược lại, nếu quá trình hòa tan là tỏa nhiệt (exothermic), độ tan sẽ giảm khi nhiệt độ tăng.
3. Độ tan của muối có thể bị ảnh hưởng bởi áp suất không?
Áp suất ảnh hưởng đáng kể đến độ tan của chất khí, nhưng ảnh hưởng rất ít đến độ tan của chất rắn và chất lỏng, bao gồm cả muối.
4. Làm thế nào để tăng độ tan của một muối trong nước?
Có một số cách để tăng độ tan của muối trong nước:
- Tăng nhiệt độ của dung dịch (đối với muối có quá trình hòa tan thu nhiệt).
- Khuấy hoặc lắc dung dịch để tăng tốc độ hòa tan.
- Sử dụng dung môi khác có độ phân cực phù hợp hơn với muối.
- Thêm các chất phụ gia có khả năng tạo phức với ion của muối.
5. Độ tan của muối ăn (NaCl) trong nước biển có khác so với trong nước tinh khiết không?
Có, độ tan của muối ăn trong nước biển có thể khác so với trong nước tinh khiết. Nước biển chứa nhiều ion khác nhau, có thể ảnh hưởng đến độ tan của NaCl do hiệu ứng ion chung.
6. Tại sao một số muối lại được gọi là “không tan” mặc dù chúng vẫn tan một lượng rất nhỏ trong nước?
Các muối được gọi là “không tan” thực tế vẫn tan một lượng rất nhỏ trong nước, nhưng lượng này quá nhỏ để có thể quan sát bằng mắt thường hoặc sử dụng trong các ứng dụng thông thường. Thuật ngữ “không tan” được sử dụng để chỉ các muối có độ tan rất thấp, thường dưới 0,01 g/100 g nước.
7. Độ tan của muối có ứng dụng gì trong sản xuất thực phẩm?
Độ tan của muối có nhiều ứng dụng quan trọng trong sản xuất thực phẩm, bao gồm:
- Bảo quản thực phẩm: Muối có thể làm giảm hoạt độ của nước trong thực phẩm, ngăn chặn sự phát triển của vi khuẩn và kéo dài thời gian bảo quản.
- Tạo hương vị: Muối là một gia vị quan trọng, giúp tăng cường hương vị của nhiều món ăn.
- Điều chỉnh độ đặc: Muối có thể ảnh hưởng đến độ đặc của một số sản phẩm thực phẩm, chẳng hạn như phô mai và thịt chế biến.
8. Làm thế nào để xác định độ tan của một muối trong phòng thí nghiệm?
Độ tan của một muối có thể được xác định bằng cách hòa tan một lượng muối đã biết trong một lượng dung môi đã biết ở một nhiệt độ nhất định, cho đến khi dung dịch bão hòa. Sau đó, xác định nồng độ của muối trong dung dịch bão hòa bằng các phương pháp phân tích hóa học.
9. Độ tan của muối có vai trò gì trong cơ thể con người?
Độ tan của muối có vai trò quan trọng trong nhiều chức năng sinh lý của cơ thể con người, bao gồm:
- Điều hòa cân bằng nước và điện giải: Các ion muối như natri, kali và clorua giúp duy trì cân bằng nước và điện giải trong cơ thể.
- Truyền xung thần kinh: Các ion muối tham gia vào quá trình truyền xung thần kinh, cho phép các tế bào thần kinh giao tiếp với nhau.
- Co cơ: Các ion muối cần thiết cho quá trình co cơ, cho phép chúng ta vận động.
10. Có những loại muối nào có độ tan đặc biệt cao hoặc thấp?
- Muối có độ tan cao: Các muối của kim loại kiềm (như natri, kali) và amoni thường có độ tan cao trong nước. Ví dụ, natri clorua (NaCl) và kali nitrat (KNO3) là những muối có độ tan rất cao.
- Muối có độ tan thấp: Nhiều muối của kim loại chuyển tiếp (như bạc, chì) và các muối chứa anion phức tạp (như cacbonat, phosphat) thường có độ tan thấp trong nước. Ví dụ, bạc clorua (AgCl) và chì sunfat (PbSO4) là những muối có độ tan rất thấp.
Hy vọng những thông tin trên sẽ giúp bạn hiểu rõ hơn về độ tan của muối và các ứng dụng của nó trong đời sống và công nghiệp.
Bạn đang tìm kiếm thông tin chi tiết và đáng tin cậy về xe tải ở Mỹ Đình? Bạn lo ngại về chi phí vận hành, bảo trì và các vấn đề pháp lý liên quan đến xe tải? Hãy truy cập ngay XETAIMYDINH.EDU.VN để được tư vấn và giải đáp mọi thắc mắc. Chúng tôi cung cấp thông tin chi tiết và cập nhật về các loại xe tải có sẵn ở Mỹ Đình, Hà Nội, so sánh giá cả và thông số kỹ thuật giữa các dòng xe, giúp bạn lựa chọn xe phù hợp với nhu cầu và ngân sách của mình. Liên hệ ngay với Xe Tải Mỹ Đình qua hotline 0247 309 9988 hoặc đến địa chỉ Số 18 đường Mỹ Đình, phường Mỹ Đình 2, quận Nam Từ Liêm, Hà Nội để được hỗ trợ tốt nhất.