Mol là một khái niệm quan trọng trong hóa học, và Xe Tải Mỹ Đình sẽ giúp bạn hiểu rõ về nó. Bài viết này cung cấp định nghĩa chi tiết về mol, cách tính toán và ứng dụng thực tế của nó trong các bài toán hóa học. Cùng XETAIMYDINH.EDU.VN khám phá sâu hơn về mol và những điều thú vị liên quan đến nó nhé!
1. Mol Là Gì?
Mol là đơn vị đo lường số lượng chất trong hóa học, tương tự như việc sử dụng “tá” để chỉ 12 đối tượng. Một mol chứa chính xác 6.02214076 × 10^23 đơn vị cấu thành, có thể là nguyên tử, phân tử, ion hoặc các hạt khác. Số lượng này được gọi là số Avogadro, ký hiệu là Nᴀ.
Ví dụ, 1 mol nguyên tử sắt (Fe) chứa 6.02214076 × 10^23 nguyên tử Fe. Tương tự, 1 mol phân tử nước (H₂O) chứa 6.02214076 × 10^23 phân tử H₂O.
1.1. Số Avogadro Là Gì?
Số Avogadro (Nᴀ) là một hằng số vật lý, biểu thị số lượng hạt (nguyên tử, phân tử, ion,…) có trong một mol chất. Giá trị chính xác của số Avogadro là 6.02214076 × 10^23. Số Avogadro được đặt theo tên nhà khoa học người Ý Amedeo Avogadro, người đã có những đóng góp quan trọng trong việc phát triển khái niệm về mol.
1.2. Tại Sao Cần Sử Dụng Mol?
Trong hóa học, các phản ứng xảy ra ở cấp độ nguyên tử và phân tử. Tuy nhiên, việc đếm trực tiếp số lượng nguyên tử hoặc phân tử là không thể thực hiện được do kích thước quá nhỏ bé của chúng. Do đó, mol được sử dụng như một đơn vị đo lường thuận tiện để biểu thị số lượng lớn các hạt này.
Theo nghiên cứu của Trường Đại học Khoa học Tự nhiên Hà Nội, việc sử dụng mol giúp đơn giản hóa các phép tính hóa học và cho phép các nhà khoa học dễ dàng dự đoán và kiểm soát lượng chất cần thiết cho các phản ứng.
1.3. Mối Liên Hệ Giữa Mol Và Các Đơn Vị Khác
Mol có mối liên hệ mật thiết với các đơn vị đo lường khác trong hóa học, bao gồm:
- Khối lượng mol (M): Khối lượng của một mol chất, tính bằng gram (g/mol). Khối lượng mol có giá trị bằng với khối lượng nguyên tử hoặc phân tử của chất đó, được biểu thị bằng đơn vị amu (atomic mass unit).
- Thể tích mol (Vₘ): Thể tích của một mol chất khí ở điều kiện tiêu chuẩn (0°C và 1 atm), có giá trị khoảng 22.4 lít/mol.
- Nồng độ mol (Cₘ): Số mol chất tan có trong một lít dung dịch, tính bằng mol/L hoặc M.
Hiểu rõ mối liên hệ giữa mol và các đơn vị này giúp chúng ta dễ dàng chuyển đổi giữa các đại lượng và giải quyết các bài toán hóa học một cách hiệu quả.
2. Khối Lượng Mol Là Gì?
Khối lượng mol (M) là khối lượng của một mol chất, được biểu thị bằng đơn vị gram trên mol (g/mol). Khối lượng mol của một nguyên tố bằng với khối lượng nguyên tử của nguyên tố đó, còn khối lượng mol của một hợp chất bằng tổng khối lượng nguyên tử của tất cả các nguyên tố có trong công thức hóa học của hợp chất đó.
2.1. Cách Tính Khối Lượng Mol
Để tính khối lượng mol của một chất, chúng ta cần biết công thức hóa học của chất đó và khối lượng nguyên tử của từng nguyên tố có trong công thức. Khối lượng nguyên tử của các nguyên tố thường được cung cấp trong bảng tuần hoàn hóa học.
Ví dụ: Tính khối lượng mol của nước (H₂O)
- Khối lượng nguyên tử của H (Hydrogen) là 1.008 g/mol
- Khối lượng nguyên tử của O (Oxygen) là 16.00 g/mol
Vậy, khối lượng mol của H₂O là: M(H₂O) = 2 × 1.008 + 16.00 = 18.016 g/mol
2.2. Ứng Dụng Của Khối Lượng Mol
Khối lượng mol là một đại lượng quan trọng trong hóa học, được sử dụng để:
- Chuyển đổi giữa khối lượng và số mol của một chất.
- Tính toán lượng chất cần thiết cho một phản ứng hóa học.
- Xác định công thức hóa học của một hợp chất.
Ví dụ, nếu chúng ta biết khối lượng của một mẫu chất và khối lượng mol của chất đó, chúng ta có thể tính được số mol của chất trong mẫu. Ngược lại, nếu chúng ta biết số mol của một chất và khối lượng mol của chất đó, chúng ta có thể tính được khối lượng của chất đó.
2.3. Bảng Khối Lượng Mol Của Một Số Chất Phổ Biến
Dưới đây là bảng khối lượng mol của một số chất phổ biến:
| Chất | Công thức hóa học | Khối lượng mol (g/mol) |
|---|---|---|
| Nước | H₂O | 18.016 |
| Natri clorua | NaCl | 58.44 |
| Glucose | C₆H₁₂O₆ | 180.16 |
| Axit sulfuric | H₂SO₄ | 98.08 |
| Amoniac | NH₃ | 17.031 |
| Methane | CH₄ | 16.043 |
| Ethanol | C₂H₅OH | 46.069 |
| Carbon dioxide | CO₂ | 44.009 |
| Oxygen | O₂ | 31.999 |
| Nitrogen | N₂ | 28.013 |
 Bảng Khối Lượng Mol Của Một Số Chất Phổ Biến
Bảng Khối Lượng Mol Của Một Số Chất Phổ Biến
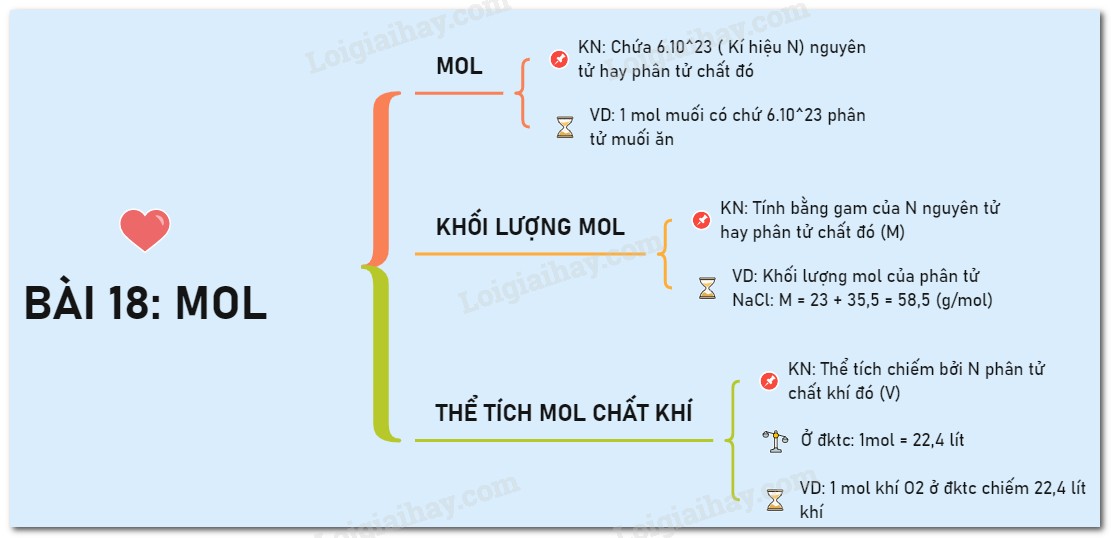
Sơ đồ tư duy về mol, bao gồm khái niệm, khối lượng mol và thể tích mol
3. Thể Tích Mol Chất Khí Là Gì?
Thể tích mol chất khí (Vₘ) là thể tích chiếm bởi một mol chất khí ở một điều kiện nhiệt độ và áp suất nhất định. Ở điều kiện tiêu chuẩn (đktc), tức là 0°C (273.15 K) và 1 atm (101.325 kPa), thể tích mol của mọi chất khí đều gần bằng 22.4 lít/mol.
3.1. Điều Kiện Tiêu Chuẩn (Đktc) Là Gì?
Điều kiện tiêu chuẩn (đktc) là một tập hợp các điều kiện nhiệt độ và áp suất được sử dụng làm chuẩn để so sánh thể tích của các chất khí. Theo định nghĩa hiện hành của IUPAC (Liên minh Quốc tế về Hóa học Thuần túy và Ứng dụng), điều kiện tiêu chuẩn là 0°C (273.15 K) và 100 kPa (0.986 atm). Tuy nhiên, trong nhiều tài liệu và bài tập hóa học, điều kiện tiêu chuẩn vẫn được hiểu là 0°C và 1 atm.
3.2. Cách Tính Thể Tích Mol Chất Khí
Để tính thể tích của một lượng chất khí ở một điều kiện nhiệt độ và áp suất bất kỳ, chúng ta có thể sử dụng phương trình trạng thái khí lý tưởng:
PV = nRT
Trong đó:
- P là áp suất của khí (Pa hoặc atm)
- V là thể tích của khí (m³ hoặc L)
- n là số mol của khí (mol)
- R là hằng số khí lý tưởng (8.314 J/(mol·K) hoặc 0.0821 L·atm/(mol·K))
- T là nhiệt độ của khí (K)
Từ phương trình này, ta có thể suy ra công thức tính thể tích mol chất khí:
Vₘ = V/n = RT/P
3.3. Ứng Dụng Của Thể Tích Mol Chất Khí
Thể tích mol chất khí được sử dụng để:
- Tính toán thể tích của một lượng chất khí ở một điều kiện nhất định.
- Chuyển đổi giữa thể tích và số mol của một chất khí.
- Xác định khối lượng mol của một chất khí.
Ví dụ, nếu chúng ta biết thể tích của một mẫu khí ở điều kiện tiêu chuẩn, chúng ta có thể tính được số mol của khí trong mẫu bằng cách chia thể tích cho 22.4 L/mol.
3.4. Thể Tích Mol Của Hỗn Hợp Khí
Đối với hỗn hợp khí, thể tích mol của hỗn hợp bằng tổng thể tích của các khí thành phần, với điều kiện là các khí không phản ứng với nhau.
Vₘ(hỗn hợp) = Vₘ(khí 1) + Vₘ(khí 2) + …
4. Công Thức Tính Mol Và Các Bài Tập Vận Dụng
Để giải các bài toán liên quan đến mol, chúng ta cần nắm vững các công thức tính mol và biết cách áp dụng chúng một cách linh hoạt.
4.1. Các Công Thức Tính Mol
- Tính mol từ khối lượng:
n = m/M
Trong đó:
-
n là số mol (mol)
-
m là khối lượng (g)
-
M là khối lượng mol (g/mol)
-
Tính mol từ thể tích (đối với chất khí ở đktc):
n = V/22.4
Trong đó:
-
n là số mol (mol)
-
V là thể tích (lít)
-
Tính mol từ số lượng hạt:
n = N/Nᴀ
Trong đó:
-
n là số mol (mol)
-
N là số lượng hạt (nguyên tử, phân tử,…)
-
Nᴀ là số Avogadro (6.022 × 10²³)
-
Tính mol từ nồng độ (đối với dung dịch):
n = C × V
Trong đó:
- n là số mol (mol)
- C là nồng độ mol (mol/L)
- V là thể tích dung dịch (L)
4.2. Bài Tập Vận Dụng
Bài tập 1: Tính số mol của 54 gam nước (H₂O).
Giải:
- Khối lượng mol của H₂O là 18 g/mol.
- Số mol của H₂O là: n = m/M = 54/18 = 3 mol
Bài tập 2: Tính thể tích của 2 mol khí CO₂ ở điều kiện tiêu chuẩn.
Giải:
- Ở điều kiện tiêu chuẩn, 1 mol khí chiếm thể tích 22.4 lít.
- Thể tích của 2 mol khí CO₂ là: V = n × 22.4 = 2 × 22.4 = 44.8 lít
Bài tập 3: Tính số phân tử có trong 0.5 mol đường glucose (C₆H₁₂O₆).
Giải:
- Số Avogadro là 6.022 × 10²³.
- Số phân tử glucose là: N = n × Nᴀ = 0.5 × 6.022 × 10²³ = 3.011 × 10²³ phân tử
Bài tập 4: Tính nồng độ mol của dung dịch chứa 0.1 mol NaCl trong 200 ml dung dịch.
Giải:
- Thể tích dung dịch là 200 ml = 0.2 lít.
- Nồng độ mol của dung dịch là: C = n/V = 0.1/0.2 = 0.5 mol/L
4.3. Lưu Ý Khi Giải Bài Tập Về Mol
- Đọc kỹ đề bài: Xác định rõ chất cần tính, đại lượng đã cho và yêu cầu của bài toán.
- Chuyển đổi đơn vị: Đảm bảo các đại lượng có cùng đơn vị trước khi thực hiện phép tính.
- Sử dụng công thức phù hợp: Lựa chọn công thức tính mol phù hợp với dữ kiện đã cho.
- Kiểm tra kết quả: Đảm bảo kết quả tính toán hợp lý và có đơn vị đúng.
5. Ứng Dụng Thực Tế Của Mol Trong Đời Sống Và Sản Xuất
Mol không chỉ là một khái niệm lý thuyết trong hóa học, mà còn có nhiều ứng dụng thực tế quan trọng trong đời sống và sản xuất.
5.1. Trong Nông Nghiệp
- Tính toán lượng phân bón: Mol được sử dụng để tính toán lượng phân bón cần thiết cho cây trồng, đảm bảo cung cấp đủ dưỡng chất cho sự phát triển của cây. Ví dụ, người nông dân cần biết lượng nitơ (N), photpho (P) và kali (K) cần thiết cho một hecta đất trồng lúa.
- Kiểm soát độ pH của đất: Mol cũng được sử dụng để kiểm soát độ pH của đất, tạo điều kiện thuận lợi cho cây trồng hấp thụ dưỡng chất.
5.2. Trong Y Học
- Pha chế thuốc: Mol được sử dụng để pha chế thuốc với nồng độ chính xác, đảm bảo hiệu quả điều trị và tránh tác dụng phụ. Ví dụ, dược sĩ cần tính toán lượng hoạt chất cần thiết để pha chế một loại thuốc tiêm.
- Xét nghiệm máu: Mol được sử dụng để đo nồng độ các chất trong máu, giúp chẩn đoán bệnh và theo dõi quá trình điều trị.
5.3. Trong Công Nghiệp
- Sản xuất hóa chất: Mol được sử dụng để tính toán lượng nguyên liệu cần thiết cho các phản ứng hóa học, tối ưu hóa quá trình sản xuất và giảm thiểu chất thải. Ví dụ, trong sản xuất axit sulfuric (H₂SO₄), các kỹ sư cần tính toán lượng lưu huỳnh (S), oxy (O₂) và nước (H₂O) cần thiết để phản ứng.
- Kiểm soát chất lượng sản phẩm: Mol được sử dụng để kiểm tra chất lượng sản phẩm, đảm bảo sản phẩm đạt tiêu chuẩn và an toàn cho người sử dụng.
5.4. Trong Nghiên Cứu Khoa Học
- Xác định thành phần hóa học: Mol được sử dụng để xác định thành phần hóa học của các chất, giúp các nhà khoa học hiểu rõ hơn về cấu trúc và tính chất của chúng.
- Nghiên cứu phản ứng hóa học: Mol được sử dụng để nghiên cứu cơ chế phản ứng hóa học, giúp các nhà khoa học tìm ra các phương pháp mới để tổng hợp các chất có giá trị.
6. Các Lỗi Thường Gặp Khi Học Về Mol Và Cách Khắc Phục
Trong quá trình học về mol, học sinh thường mắc phải một số lỗi sau:
6.1. Nhầm Lẫn Giữa Khối Lượng Mol Và Khối Lượng Riêng
- Lỗi: Học sinh thường nhầm lẫn giữa khối lượng mol (khối lượng của 1 mol chất) và khối lượng riêng (khối lượng của 1 đơn vị thể tích chất).
- Cách khắc phục: Hiểu rõ định nghĩa và đơn vị của từng khái niệm. Khối lượng mol có đơn vị là g/mol, còn khối lượng riêng có đơn vị là g/cm³ hoặc kg/m³.
6.2. Sai Sót Trong Tính Toán Khối Lượng Mol
- Lỗi: Học sinh thường tính sai khối lượng mol của một chất do không nhớ công thức hóa học hoặc tính sai khối lượng nguyên tử của các nguyên tố.
- Cách khắc phục: Học thuộc công thức hóa học của các chất phổ biến và sử dụng bảng tuần hoàn hóa học để tra cứu khối lượng nguyên tử của các nguyên tố.
6.3. Không Nhớ Số Avogadro
- Lỗi: Học sinh không nhớ hoặc nhớ sai số Avogadro (6.022 × 10²³), dẫn đến sai sót trong tính toán số lượng hạt.
- Cách khắc phục: Ghi nhớ số Avogadro và sử dụng nó một cách chính xác trong các bài toán.
6.4. Không Hiểu Điều Kiện Tiêu Chuẩn
- Lỗi: Học sinh không hiểu rõ điều kiện tiêu chuẩn (đktc) và sử dụng sai thể tích mol chất khí ở đktc.
- Cách khắc phục: Nắm vững định nghĩa của điều kiện tiêu chuẩn (0°C và 1 atm) và sử dụng thể tích mol chất khí ở đktc (22.4 lít/mol) một cách chính xác.
6.5. Không Chuyển Đổi Đơn Vị
- Lỗi: Học sinh không chuyển đổi đơn vị trước khi thực hiện phép tính, dẫn đến kết quả sai.
- Cách khắc phục: Kiểm tra kỹ đơn vị của các đại lượng và chuyển đổi chúng về cùng một đơn vị trước khi thực hiện phép tính.
7. Mẹo Học Tốt Về Mol
Để học tốt về mol, bạn có thể áp dụng các mẹo sau:
- Học thuộc định nghĩa và công thức: Ghi nhớ định nghĩa của mol, số Avogadro, khối lượng mol, thể tích mol chất khí và các công thức tính mol.
- Làm nhiều bài tập: Thực hành giải nhiều bài tập khác nhau để làm quen với các dạng bài và rèn luyện kỹ năng tính toán.
- Sử dụng sơ đồ tư duy: Vẽ sơ đồ tư duy để hệ thống hóa kiến thức về mol và các khái niệm liên quan.
- Học nhóm: Trao đổi kiến thức và giải bài tập cùng bạn bè để học hỏi kinh nghiệm và giải đáp thắc mắc.
- Tìm kiếm sự giúp đỡ: Nếu gặp khó khăn, đừng ngần ngại hỏi thầy cô giáo hoặc các bạn học giỏi hơn.
8. Các Câu Hỏi Thường Gặp Về Mol (FAQ)
8.1. Mol Có Phải Là Một Đơn Vị Đo Lường Quốc Tế (SI) Không?
Có, mol là một trong bảy đơn vị cơ bản của hệ đo lường quốc tế (SI). Nó được sử dụng để đo lượng chất.
8.2. Tại Sao Số Avogadro Lại Có Giá Trị Lớn Như Vậy?
Số Avogadro có giá trị lớn như vậy vì nó biểu thị số lượng hạt (nguyên tử, phân tử,…) có trong một mol chất. Các hạt này có kích thước rất nhỏ, do đó cần một số lượng lớn để tạo thành một lượng chất có thể cân đo được.
8.3. Mol Có Thể Được Sử Dụng Để Đo Lượng Chất Rắn, Lỏng Và Khí Không?
Có, mol có thể được sử dụng để đo lượng chất ở cả ba trạng thái: rắn, lỏng và khí.
8.4. Sự Khác Biệt Giữa Mol Và Gram Là Gì?
Mol là đơn vị đo lượng chất, trong khi gram là đơn vị đo khối lượng. Mol cho biết số lượng hạt (nguyên tử, phân tử,…) có trong một lượng chất, còn gram cho biết khối lượng của lượng chất đó.
8.5. Làm Thế Nào Để Chuyển Đổi Giữa Mol Và Số Lượng Hạt?
Để chuyển đổi giữa mol và số lượng hạt, bạn có thể sử dụng công thức:
Số lượng hạt = Số mol × Số Avogadro
8.6. Thể Tích Mol Của Chất Rắn Và Chất Lỏng Có Phải Luôn Bằng 22.4 Lít/Mol Không?
Không, thể tích mol chỉ áp dụng cho chất khí ở điều kiện tiêu chuẩn (0°C và 1 atm). Thể tích mol của chất rắn và chất lỏng phụ thuộc vào nhiều yếu tố, như bản chất của chất, nhiệt độ và áp suất.
8.7. Tại Sao Việc Hiểu Về Mol Lại Quan Trọng Trong Hóa Học?
Việc hiểu về mol là rất quan trọng trong hóa học vì nó giúp chúng ta:
- Định lượng các chất tham gia và sản phẩm trong phản ứng hóa học.
- Tính toán lượng chất cần thiết cho một phản ứng.
- Xác định công thức hóa học của các hợp chất.
- Nghiên cứu cơ chế phản ứng hóa học.
8.8. Có Cách Nào Để Ước Lượng Số Mol Mà Không Cần Tính Toán Chính Xác Không?
Có, bạn có thể ước lượng số mol bằng cách so sánh khối lượng của chất với khối lượng mol gần đúng của nó. Ví dụ, nếu bạn có 20 gam NaOH và bạn biết khối lượng mol của NaOH là khoảng 40 g/mol, bạn có thể ước lượng số mol của NaOH là khoảng 0.5 mol.
8.9. Làm Thế Nào Để Áp Dụng Khái Niệm Mol Vào Các Phản Ứng Hóa Học?
Để áp dụng Khái Niệm Mol vào các phản ứng hóa học, bạn cần:
- Viết phương trình hóa học cân bằng của phản ứng.
- Xác định tỉ lệ mol giữa các chất tham gia và sản phẩm.
- Sử dụng tỉ lệ mol để tính toán lượng chất cần thiết hoặc lượng chất tạo thành trong phản ứng.
8.10. Có Những Tài Liệu Nào Có Thể Giúp Tôi Học Tốt Hơn Về Mol?
Có rất nhiều tài liệu có thể giúp bạn học tốt hơn về mol, bao gồm:
- Sách giáo khoa hóa học
- Sách bài tập hóa học
- Các trang web và video hướng dẫn về hóa học
- Các khóa học trực tuyến về hóa học
9. Xe Tải Mỹ Đình – Nơi Giải Đáp Mọi Thắc Mắc Về Xe Tải
Bạn đang tìm kiếm thông tin chi tiết và đáng tin cậy về các loại xe tải ở Mỹ Đình, Hà Nội? Bạn muốn so sánh giá cả và thông số kỹ thuật giữa các dòng xe? Bạn cần tư vấn lựa chọn xe phù hợp với nhu cầu và ngân sách của mình? Hãy đến với XETAIMYDINH.EDU.VN, nơi bạn sẽ tìm thấy mọi thông tin cần thiết và được giải đáp mọi thắc mắc về xe tải.
Xe Tải Mỹ Đình cam kết cung cấp:
- Thông tin chi tiết và cập nhật về các loại xe tải có sẵn ở Mỹ Đình, Hà Nội.
- So sánh giá cả và thông số kỹ thuật giữa các dòng xe.
- Tư vấn lựa chọn xe phù hợp với nhu cầu và ngân sách.
- Giải đáp các thắc mắc liên quan đến thủ tục mua bán, đăng ký và bảo dưỡng xe tải.
- Thông tin về các dịch vụ sửa chữa xe tải uy tín trong khu vực.
Đừng ngần ngại liên hệ với chúng tôi để được tư vấn và hỗ trợ tốt nhất:
- Địa chỉ: Số 18 đường Mỹ Đình, phường Mỹ Đình 2, quận Nam Từ Liêm, Hà Nội
- Hotline: 0247 309 9988
- Trang web: XETAIMYDINH.EDU.VN
Chúng tôi luôn sẵn sàng đồng hành cùng bạn trên mọi nẻo đường!
