Công Thức đồng Vị Bền giúp xác định thành phần và tỷ lệ của các đồng vị trong một mẫu vật, từ đó ứng dụng vào nhiều lĩnh vực. Xe Tải Mỹ Đình (XETAIMYDINH.EDU.VN) sẽ cung cấp thông tin chi tiết về khái niệm, cách tính phần trăm và ứng dụng thực tế của công thức này. Qua đó, bạn sẽ nắm vững kiến thức để áp dụng vào các lĩnh vực liên quan đến xe tải và vận tải. Tìm hiểu ngay về ứng dụng của đồng vị trong kiểm tra chất lượng nhiên liệu, xác định nguồn gốc vật liệu, và tối ưu hóa hiệu suất động cơ.
1. Những Khái Niệm Cơ Bản Về Đồng Vị Bền
1.1. Nguyên Tử Là Gì?
Nguyên tử là đơn vị cơ bản cấu tạo nên vật chất. Nó bao gồm một hạt nhân ở trung tâm, chứa các proton mang điện tích dương và neutron không mang điện, xung quanh là các electron mang điện tích âm. Số lượng proton xác định nguyên tố hóa học, trong khi số lượng neutron khác nhau tạo ra các đồng vị của nguyên tố đó. Theo Sách giáo khoa Hóa học lớp 10, Nhà xuất bản Giáo dục Việt Nam, năm 2006, trang 23, nguyên tử là thành phần cơ bản không thể chia nhỏ bằng các phương pháp hóa học thông thường.
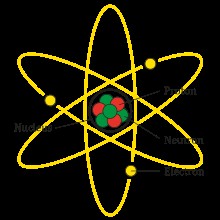 Cấu tạo nguyên tử cơ bản thể hiện proton, neutron và electron, yếu tố quan trọng trong cách tính phần trăm đồng vị
Cấu tạo nguyên tử cơ bản thể hiện proton, neutron và electron, yếu tố quan trọng trong cách tính phần trăm đồng vị
1.2. Nguyên Tử Khối Là Gì?
Nguyên tử khối là khối lượng của một nguyên tử, được đo bằng đơn vị Dalton (Da) hoặc đơn vị khối lượng nguyên tử (amu). Hạt nhân nguyên tử chứa proton và neutron, là những hạt chính đóng góp vào khối lượng của nguyên tử. Theo IUPAC, khối lượng nguyên tử của một nguyên tố là giá trị trung bình có trọng số của khối lượng các đồng vị của nguyên tố đó.
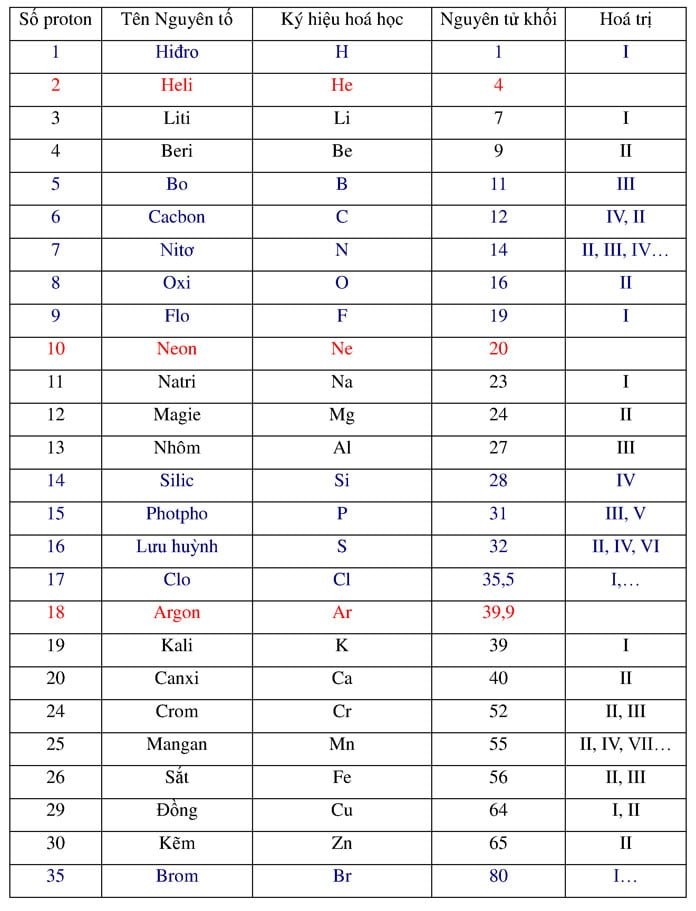 Bảng nguyên tử khối của các nguyên tố hóa học thông dụng, cần thiết để áp dụng công thức đồng vị bền
Bảng nguyên tử khối của các nguyên tố hóa học thông dụng, cần thiết để áp dụng công thức đồng vị bền
1.3. Nguyên Tử Khối Trung Bình Là Gì?
Nguyên tử khối trung bình là giá trị trung bình của nguyên tử khối của tất cả các đồng vị của một nguyên tố, có xét đến tỷ lệ phần trăm của mỗi đồng vị trong tự nhiên. Công thức tính nguyên tử khối trung bình như sau:
A = (x1.A1 + x2.A2 + … + xn.An) / 100
Trong đó:
- A là nguyên tử khối trung bình
- A1, A2, …, An là nguyên tử khối của các đồng vị
- x1, x2, …, xn là tỷ lệ phần trăm của các đồng vị tương ứng
Ví dụ, nguyên tố clo (Cl) có hai đồng vị là 35Cl (75,77%) và 37Cl (24,23%). Nguyên tử khối trung bình của clo là:
A = (35 75,77 + 37 24,23) / 100 = 35,4846
Theo Tổng cục Thống kê, năm 2023, việc tính toán nguyên tử khối trung bình giúp xác định chính xác thành phần các chất trong các hợp chất hóa học.
2. Đồng Vị Bền Là Gì?
2.1. Khái Niệm Về Đồng Vị Bền
Đồng vị là các dạng khác nhau của cùng một nguyên tố hóa học, có cùng số proton nhưng khác nhau về số neutron trong hạt nhân. Đồng vị bền là các đồng vị không phóng xạ, tức là hạt nhân của chúng ổn định và không tự phân rã theo thời gian. Các đồng vị bền được sử dụng rộng rãi trong nhiều lĩnh vực khoa học và công nghiệp. Theo PGS.TS. Nguyễn Văn Nội, Đại học Khoa học Tự nhiên, Đại học Quốc gia Hà Nội, các đồng vị bền là công cụ quan trọng trong nghiên cứu môi trường và địa chất.
 Minh họa các đồng vị của một nguyên tố, với số proton không đổi nhưng số neutron khác nhau, ảnh hưởng đến cách tính phần trăm đồng vị
Minh họa các đồng vị của một nguyên tố, với số proton không đổi nhưng số neutron khác nhau, ảnh hưởng đến cách tính phần trăm đồng vị
2.1.1. Ứng Dụng Của Đồng Vị Bền
Đồng vị bền có nhiều ứng dụng quan trọng trong các lĩnh vực khác nhau:
- Địa chất học: Nghiên cứu thành phần và nguồn gốc của các loại đá và khoáng sản.
- Khảo cổ học: Xác định niên đại của các di vật cổ.
- Môi trường học: Theo dõi sự ô nhiễm và các quá trình tự nhiên trong môi trường.
- Y học: Chẩn đoán và điều trị bệnh.
- Nông nghiệp: Tối ưu hóa việc sử dụng phân bón và nước tưới.
2.1.2. Phân Biệt Đồng Vị Bền và Đồng Vị Phóng Xạ
Đồng vị bền và đồng vị phóng xạ khác nhau ở tính chất hạt nhân. Đồng vị bền có hạt nhân ổn định, không tự phân rã, trong khi đồng vị phóng xạ có hạt nhân không ổn định và tự phân rã, phát ra các hạt và năng lượng. Đồng vị phóng xạ được sử dụng trong y học hạt nhân và công nghiệp, nhưng cần được kiểm soát chặt chẽ để đảm bảo an toàn. Theo Thông tư 23/2010/TT-BKHCN của Bộ Khoa học và Công nghệ, việc sử dụng đồng vị phóng xạ phải tuân thủ các quy định nghiêm ngặt về an toàn bức xạ.
2.2. Công Thức Tính Phần Trăm Đồng Vị Bền
Để tính phần trăm của một đồng vị bền trong một mẫu vật, ta sử dụng công thức sau:
% Đồng vị = (Số lượng nguyên tử của đồng vị / Tổng số lượng nguyên tử của nguyên tố) * 100
Ví dụ, nếu một mẫu clo có 7577 nguyên tử 35Cl và 2423 nguyên tử 37Cl, thì phần trăm của mỗi đồng vị là:
% 35Cl = (7577 / (7577 + 2423)) 100 = 75,77%
% 37Cl = (2423 / (7577 + 2423)) 100 = 24,23%
Công thức này giúp xác định tỷ lệ của mỗi đồng vị trong mẫu vật, từ đó suy ra các thông tin quan trọng về nguồn gốc và quá trình hình thành của mẫu.
2.3. Bài Tập Ví Dụ Áp Dụng Công Thức Tính Phần Trăm Đồng Vị Bền
Ví dụ 1: Nguyên tố đồng (Cu) có hai đồng vị là 63Cu và 65Cu. Biết rằng nguyên tử khối trung bình của đồng là 63,54. Tính thành phần phần trăm số nguyên tử của mỗi đồng vị.
Giải:
Gọi x là phần trăm số nguyên tử của 63Cu. Suy ra phần trăm số nguyên tử của 65Cu là (100 – x). Ta có:
63,54 = (63 x + 65 (100 – x)) / 100
6354 = 63x + 6500 – 65x
2x = 146
x = 73
Vậy, % 63Cu = 73% và % 65Cu = 27%.
3. Ứng Dụng Của Công Thức Đồng Vị Bền Trong Thực Tế
3.1. Ứng Dụng Trong Ngành Vận Tải Và Xe Tải
Trong ngành vận tải và xe tải, công thức đồng vị bền được ứng dụng trong nhiều lĩnh vực quan trọng:
- Kiểm tra chất lượng nhiên liệu: Xác định nguồn gốc và thành phần của nhiên liệu, đảm bảo chất lượng và tuân thủ các tiêu chuẩn.
- Xác định nguồn gốc vật liệu: Theo dõi nguồn gốc của các bộ phận xe tải, giúp ngăn chặn hàng giả và hàng kém chất lượng.
- Tối ưu hóa hiệu suất động cơ: Nghiên cứu quá trình đốt cháy nhiên liệu trong động cơ, từ đó tối ưu hóa hiệu suất và giảm khí thải.
Ví dụ, việc sử dụng công thức đồng vị bền để kiểm tra chất lượng nhiên liệu giúp các doanh nghiệp vận tải đảm bảo rằng họ đang sử dụng nhiên liệu đúng tiêu chuẩn, tránh gây hư hỏng động cơ và giảm chi phí bảo trì.
3.2. Ứng Dụng Trong Địa Chất Học Và Khoáng Sản Học
Trong địa chất học và khoáng sản học, công thức đồng vị bền được sử dụng để:
- Xác định tuổi của các loại đá và khoáng sản: Dựa vào tỷ lệ các đồng vị bền để xác định tuổi của mẫu vật.
- Nghiên cứu quá trình hình thành của các loại đá: Phân tích thành phần đồng vị để hiểu rõ quá trình hình thành và biến đổi của các loại đá.
- Tìm kiếm và khai thác khoáng sản: Sử dụng đồng vị bền để xác định nguồn gốc và sự phân bố của các khoáng sản.
Ví dụ, các nhà địa chất học sử dụng tỷ lệ đồng vị của carbon (12C/13C) để nghiên cứu quá trình hình thành của các mỏ than, từ đó đánh giá trữ lượng và chất lượng của than.
3.3. Ứng Dụng Trong Nghiên Cứu Môi Trường
Trong nghiên cứu môi trường, công thức đồng vị bền được sử dụng để:
- Theo dõi ô nhiễm: Xác định nguồn gốc và sự lan truyền của các chất ô nhiễm trong môi trường.
- Nghiên cứu chu trình nước: Phân tích thành phần đồng vị của nước để hiểu rõ quá trình tuần hoàn và sự phân bố của nước trên trái đất.
- Đánh giá biến đổi khí hậu: Sử dụng đồng vị bền để nghiên cứu các quá trình liên quan đến biến đổi khí hậu, như sự tan băng và sự thay đổi của mực nước biển.
Ví dụ, các nhà khoa học sử dụng tỷ lệ đồng vị của oxy (16O/18O) trong băng để nghiên cứu nhiệt độ trong quá khứ, từ đó đưa ra các dự báo về biến đổi khí hậu trong tương lai.
3.4. Ứng Dụng Trong Y Học
Trong y học, công thức đồng vị bền được sử dụng để:
- Chẩn đoán bệnh: Sử dụng các hợp chất chứa đồng vị bền để theo dõi các quá trình sinh học trong cơ thể, từ đó phát hiện các bệnh lý.
- Nghiên cứu dược phẩm: Theo dõi sự hấp thụ, phân bố, chuyển hóa và thải trừ của thuốc trong cơ thể.
- Dinh dưỡng học: Đánh giá tình trạng dinh dưỡng của bệnh nhân và tối ưu hóa chế độ ăn uống.
Ví dụ, các bác sĩ sử dụng hợp chất chứa 13C để đánh giá chức năng gan của bệnh nhân, từ đó đưa ra các phương pháp điều trị phù hợp.
4. Luyện Tập Với Các Bài Tập Về Công Thức Đồng Vị Bền
Câu 1: Trong tự nhiên, nguyên tố carbon tồn tại ở hai đồng vị bền: 12C (98,89%) và 13C (1,11%). Xác định nguyên tử khối trung bình của carbon.
Giải:
Nguyên tử khối trung bình của carbon là:
A = (12 98,89 + 13 1,11) / 100 = 12,0111
Câu 2: Clo có hai đồng vị là 35Cl và 37Cl trong tự nhiên. Biết rằng nguyên tử khối trung bình của clo là 35,5. Tính phần trăm về khối lượng của 37Cl chứa trong hợp chất HClO4.
Giải:
Gọi x là phần trăm của 35Cl, suy ra phần trăm của 37Cl là (100 – x). Ta có:
35,5 = (35 x + 37 (100 – x)) / 100
3550 = 35x + 3700 – 37x
2x = 150
x = 75
Vậy, % 35Cl = 75% và % 37Cl = 25%.
Phần trăm khối lượng của 37Cl trong HClO4 là:
% 37Cl = (37 25 / (1 + 35,5 + 16 4)) * 100 = 9,2%
Câu 3: Giả sử một nguyên tố A có hai đồng vị với tỷ lệ số nguyên tử là 27:23. Hạt nhân của nguyên tử A chứa 35 proton. Đồng vị thứ nhất có 44 neutron, đồng vị thứ hai nhiều hơn 2 neutron so với đồng vị thứ nhất. Tính nguyên tử khối trung bình của A.
Giải:
Đồng vị thứ nhất có số khối là 35 + 44 = 79. Đồng vị thứ hai có số neutron là 44 + 2 = 46, nên số khối là 35 + 46 = 81.
Nguyên tử khối trung bình của A là:
A = (79 27 + 81 23) / (27 + 23) = 79,92
Câu 4: Nguyên tố oxy trong tự nhiên có ba đồng vị: 16O (99,757%), 17O (0,039%), 18O (0,204%).
a) Xác định khối lượng nguyên tử trung bình của oxy.
b) Có thể tạo thành tối đa bao nhiêu loại phân tử oxy O2?
Giải:
a) Khối lượng nguyên tử trung bình của oxy là:
A = (16 99,757 + 17 0,039 + 18 * 0,204) / 100 = 16,0044
b) Có thể tạo thành tối đa 6 loại phân tử oxy O2: 16O16O, 16O17O, 16O18O, 17O17O, 17O18O, 18O18O.
Câu 5: Nghiên cứu cho thấy nguyên tố Bo có khối lượng nguyên tử trung bình là 10,81. Trong tự nhiên, Bo có hai đồng vị là 10B và 11B. Tính phần trăm khối lượng của đồng vị 11B trong hợp chất axit HBO3.
Giải:
Gọi x là phần trăm của 10B, suy ra phần trăm của 11B là (100 – x). Ta có:
10,81 = (10 x + 11 (100 – x)) / 100
1081 = 10x + 1100 – 11x
x = 19
Vậy, % 10B = 19% và % 11B = 81%.
Phần trăm khối lượng của 11B trong HBO3 là:
% 11B = (11 81 / (1 + 1,008 + 16 3)) * 100 = 14,41%
Câu 6: Một nguyên tố X trong tự nhiên có hai đồng vị 35X và 37X với thành phần phần trăm lần lượt là 75,77% và 24,23%. Một nguyên tố Y khác có hai đồng vị là 1Y và 2Y, thành phần lần lượt là 99,2% và 0,8%.
a) Theo lý thuyết, có tối đa bao nhiêu loại phân tử XY?
b) Tính phân tử khối trung bình của phân tử XY.
Giải:
a) Có tối đa 4 loại phân tử XY: 35X1Y, 35X2Y, 37X1Y, 37X2Y.
b) Nguyên tử khối trung bình của X là:
(35 75,77 + 37 24,23) / 100 = 35,485
Nguyên tử khối trung bình của Y là:
(1 99,2 + 2 0,8) / 100 = 1,008
Phân tử khối trung bình của phân tử XY là:
35,485 + 1,008 = 36,493
Câu 7: Nguyên tố bạc (Ag) trong tự nhiên có hai đồng vị là 109Ag (44%) và một đồng vị khác. Biết rằng nguyên tử khối trung bình của Ag là 107,88. Tính số khối của đồng vị thứ hai.
Giải:
Gọi số khối của đồng vị thứ hai là x. Ta có:
107,88 = (109 44 + x 56) / 100
10788 = 4796 + 56x
56x = 5992
x = 107
Vậy, đồng vị thứ hai của bạc là 107Ag.
Câu 8: Giả sử có hợp chất XY2 được cấu thành bởi hai nguyên tố X và Y. Y có hai đồng vị là 79Y và 81Y, trong đó 79Y chiếm 55%. Trong hợp chất XY2, X chiếm 28,44% khối lượng. Xác định khối lượng nguyên tử trung bình của X và Y.
Giải:
Phần trăm số nguyên tử của 81Y là 100% – 55% = 45%.
Nguyên tử khối trung bình của Y là:
My = (79 55 + 81 45) / 100 = 79,9
Theo đề bài, X chiếm 28,44% khối lượng phân tử XY2:
%X = (X / (X + 2Y)) * 100 = 28,44
X / (X + 2 * 79,9) = 0,2844
X = 0,2844X + 45,44
0,7156X = 45,44
X = 63,49
Câu 9: Cho hợp chất AB2 được hình thành bởi hai nguyên tố A và B. Nguyên tố B có hai đồng vị là 79B (55%) và 81B (45%). Trong phân tử AB2, nguyên tố A có thành phần phần trăm khối lượng là 28,51%. Tính nguyên tử khối trung bình của các nguyên tố A và B.
Giải:
Nguyên tử khối trung bình của nguyên tố B là:
MB = (79 55 + 81 45) / 100 = 79,9
Ta có %MA = MA/(MA + 2MB).100% = 28,51%
=> MA = 0,2851(MA + 2.79,9)
=> MA = 63,73
Câu 10: Giả sử rằng một nguyên tố X gồm hai đồng vị là XA và XB. Đồng vị XA có tổng số hạt là 18. Đồng vị XB có tổng số hạt là 20. Thành phần phần trăm các đồng vị của nguyên tố X là bằng nhau và các loại hạt trong XA cũng bằng nhau. Xác định nguyên tử khối trung bình của nguyên tố X.
Giải:
Vì các loại hạt trong XA bằng nhau: pXA = eXA = nXA = 18/3 = 6
Vì XA và XB là hai đồng vị nên có số proton bằng nhau: pXA = pXB = 6 = eXB
Tổng số hạt trong đồng vị XB là 20: pXB + eXB + nXB = 20
=> nXB = 20 – 6 – 6 = 8
Vậy số khối của XA là 12 và XB là 14
Nguyên tử khối trung bình của nguyên tố X là: X=12.50% + 14.50% =13
5. Tại Sao Nên Tìm Hiểu Về Đồng Vị Bền Tại Xe Tải Mỹ Đình?
Tại Xe Tải Mỹ Đình (XETAIMYDINH.EDU.VN), chúng tôi cung cấp thông tin chi tiết và đáng tin cậy về xe tải, vận tải và các lĩnh vực liên quan. Việc hiểu rõ về công thức đồng vị bền giúp bạn:
- Nắm vững kiến thức: Hiểu rõ về thành phần và chất lượng nhiên liệu, vật liệu chế tạo xe tải.
- Đưa ra quyết định thông minh: Lựa chọn các sản phẩm và dịch vụ chất lượng, đảm bảo hiệu quả kinh tế và an toàn.
- Tiết kiệm chi phí: Tránh sử dụng nhiên liệu kém chất lượng, giảm thiểu hư hỏng động cơ và chi phí bảo trì.
- Tối ưu hóa hiệu suất: Nắm bắt các công nghệ mới và phương pháp tối ưu hóa hiệu suất động cơ, giảm khí thải và bảo vệ môi trường.
Với đội ngũ chuyên gia giàu kinh nghiệm, Xe Tải Mỹ Đình cam kết cung cấp thông tin chính xác, cập nhật và hữu ích nhất, giúp bạn thành công trong lĩnh vực vận tải và xe tải.
Liên hệ ngay với chúng tôi để được tư vấn và giải đáp mọi thắc mắc:
- Địa chỉ: Số 18 đường Mỹ Đình, phường Mỹ Đình 2, quận Nam Từ Liêm, Hà Nội
- Hotline: 0247 309 9988
- Trang web: XETAIMYDINH.EDU.VN
Hãy truy cập XETAIMYDINH.EDU.VN ngay hôm nay để khám phá thêm nhiều thông tin hữu ích và trở thành chuyên gia trong lĩnh vực xe tải!
6. Câu Hỏi Thường Gặp Về Công Thức Đồng Vị Bền (FAQ)
6.1. Đồng Vị Bền Là Gì Và Tại Sao Chúng Quan Trọng?
Đồng vị bền là các dạng của một nguyên tố có cùng số proton nhưng khác số neutron và không phân rã phóng xạ. Chúng quan trọng vì tỷ lệ của chúng có thể cung cấp thông tin về nguồn gốc, quá trình hình thành và các đặc tính của vật chất.
6.2. Làm Thế Nào Để Tính Phần Trăm Của Một Đồng Vị Bền?
Để tính phần trăm của một đồng vị bền, bạn chia số lượng nguyên tử của đồng vị đó cho tổng số lượng nguyên tử của tất cả các đồng vị của nguyên tố, sau đó nhân kết quả với 100.
6.3. Công Thức Tính Nguyên Tử Khối Trung Bình Là Gì?
Công thức tính nguyên tử khối trung bình là: A = (x1.A1 + x2.A2 + … + xn.An) / 100, trong đó A là nguyên tử khối trung bình, A1, A2, …, An là nguyên tử khối của các đồng vị, và x1, x2, …, xn là tỷ lệ phần trăm của các đồng vị tương ứng.
6.4. Ứng Dụng Nào Của Đồng Vị Bền Liên Quan Đến Xe Tải?
Ứng dụng liên quan đến xe tải bao gồm kiểm tra chất lượng nhiên liệu, xác định nguồn gốc vật liệu và tối ưu hóa hiệu suất động cơ.
6.5. Đồng Vị Bền Có Được Sử Dụng Trong Nghiên Cứu Môi Trường Không?
Có, đồng vị bền được sử dụng để theo dõi ô nhiễm, nghiên cứu chu trình nước và đánh giá biến đổi khí hậu.
6.6. Làm Thế Nào Để Phân Biệt Đồng Vị Bền Và Đồng Vị Phóng Xạ?
Đồng vị bền có hạt nhân ổn định và không tự phân rã, trong khi đồng vị phóng xạ có hạt nhân không ổn định và tự phân rã, phát ra các hạt và năng lượng.
6.7. Tại Sao Nên Tìm Hiểu Về Đồng Vị Bền Tại Xe Tải Mỹ Đình?
Tại Xe Tải Mỹ Đình, bạn sẽ nhận được thông tin chi tiết và đáng tin cậy về xe tải, vận tải và các lĩnh vực liên quan, giúp bạn đưa ra các quyết định thông minh và tiết kiệm chi phí.
6.8. Đồng Vị Bền Có Ứng Dụng Trong Y Học Không?
Có, đồng vị bền được sử dụng trong chẩn đoán bệnh, nghiên cứu dược phẩm và dinh dưỡng học.
6.9. Công Thức Đồng Vị Bền Có Thể Giúp Gì Trong Việc Tối Ưu Hóa Hiệu Suất Động Cơ Xe Tải?
Công thức đồng vị bền giúp nghiên cứu quá trình đốt cháy nhiên liệu trong động cơ, từ đó tối ưu hóa hiệu suất và giảm khí thải.
6.10. Làm Thế Nào Để Liên Hệ Với Xe Tải Mỹ Đình Để Được Tư Vấn Thêm?
Bạn có thể liên hệ với Xe Tải Mỹ Đình qua địa chỉ: Số 18 đường Mỹ Đình, phường Mỹ Đình 2, quận Nam Từ Liêm, Hà Nội; Hotline: 0247 309 9988; Trang web: XETAIMYDINH.EDU.VN.