Hạt Nguyên Tử Cấu Tạo Bởi những gì? Câu trả lời là hạt nhân và các electron quay xung quanh. Tại Xe Tải Mỹ Đình (XETAIMYDINH.EDU.VN), chúng tôi không chỉ cung cấp thông tin về xe tải mà còn mang đến những kiến thức khoa học cơ bản, giúp bạn hiểu rõ hơn về thế giới xung quanh. Tìm hiểu sâu hơn về cấu trúc nguyên tử giúp bạn nắm bắt các nguyên lý hóa học, vật lý cơ bản, từ đó ứng dụng vào nhiều lĩnh vực trong cuộc sống.
1. Thành Phần Cấu Tạo Nguyên Tử Là Gì?
Nguyên tử là đơn vị cơ bản của vật chất, vậy thành phần cấu tạo nên nó bao gồm những gì? Hãy cùng tìm hiểu chi tiết về cấu trúc phức tạp này.
1.1. Nguyên Tử Là Gì?
Nguyên tử là đơn vị cơ bản của vật chất, cấu tạo từ các hạt nhỏ hơn và mang đặc tính hóa học riêng biệt. Theo định nghĩa của Đại học Quốc gia Hà Nội, nguyên tử là thành phần nhỏ nhất của một nguyên tố hóa học, vẫn giữ được các tính chất hóa học đặc trưng của nguyên tố đó.
1.2. Hạt Nguyên Tử Cấu Tạo Bởi Những Gì?
Hạt nguyên tử được cấu tạo bởi ba loại hạt cơ bản: proton, neutron và electron. Trong đó, proton và neutron tạo thành hạt nhân, còn electron chuyển động xung quanh hạt nhân.
- Hạt Nhân: Chứa proton (mang điện tích dương) và neutron (không mang điện). Số proton xác định nguyên tố hóa học.
- Vỏ Nguyên Tử: Chứa electron (mang điện tích âm) chuyển động xung quanh hạt nhân theo các quỹ đạo nhất định.
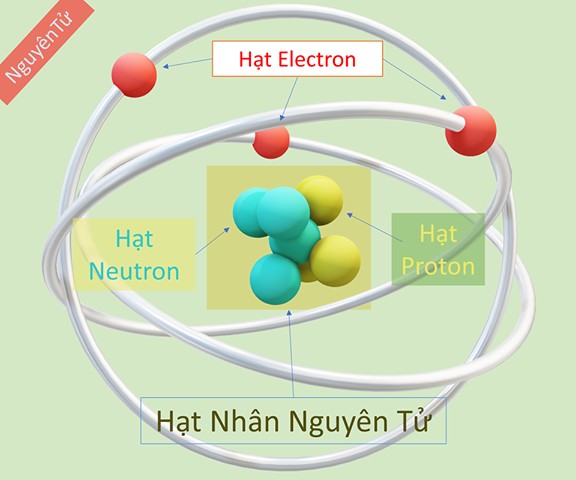 Mô hình cấu tạo nguyên tử
Mô hình cấu tạo nguyên tử
1.3. Đặc Điểm Của Các Hạt Cơ Bản
Để hiểu rõ hơn về cấu trúc nguyên tử, chúng ta cần nắm vững các đặc điểm của từng loại hạt:
- Proton (p):
- Điện tích: +1,602 x 10^-19 C (điện tích dương)
- Khối lượng: 1,6726 x 10^-27 kg (gần bằng 1 amu – đơn vị khối lượng nguyên tử)
- Vị trí: Nằm trong hạt nhân
- Neutron (n):
- Điện tích: 0 (trung hòa điện)
- Khối lượng: 1,6749 x 10^-27 kg (gần bằng 1 amu)
- Vị trí: Nằm trong hạt nhân
- Electron (e):
- Điện tích: -1,602 x 10^-19 C (điện tích âm)
- Khối lượng: 9,1094 x 10^-31 kg (nhỏ hơn rất nhiều so với proton và neutron)
- Vị trí: Chuyển động xung quanh hạt nhân theo các quỹ đạo
| Hạt | Điện tích | Khối lượng | Vị trí |
|---|---|---|---|
| Proton | +1,602 x 10^-19 C | 1,6726 x 10^-27 kg | Hạt nhân |
| Neutron | 0 | 1,6749 x 10^-27 kg | Hạt nhân |
| Electron | -1,602 x 10^-19 C | 9,1094 x 10^-31 kg | Vỏ nguyên tử |
2. Cấu Trúc Chi Tiết Của Hạt Nhân Nguyên Tử
Hạt nhân là trung tâm của nguyên tử, chứa gần như toàn bộ khối lượng của nguyên tử. Vậy cấu trúc của hạt nhân như thế nào?
2.1. Thành Phần Của Hạt Nhân
Hạt nhân được cấu tạo từ hai loại hạt: proton và neutron. Các hạt này được gọi chung là nucleon. Số lượng proton trong hạt nhân quyết định nguyên tố hóa học của nguyên tử.
2.2. Lực Hạt Nhân
Các proton mang điện tích dương, lẽ ra chúng phải đẩy nhau, nhưng hạt nhân vẫn ổn định nhờ lực hạt nhân. Lực hạt nhân là một lực cực mạnh, có tác dụng trong phạm vi rất ngắn, giúp liên kết các nucleon lại với nhau.
2.3. Số Khối Và Số Hiệu Nguyên Tử
- Số hiệu nguyên tử (Z): Là số proton trong hạt nhân, xác định nguyên tố hóa học.
- Số khối (A): Là tổng số proton và neutron trong hạt nhân.
Ví dụ, nguyên tử Carbon có số hiệu nguyên tử Z = 6 (6 proton) và số khối A = 12 (6 proton và 6 neutron).
3. Vỏ Nguyên Tử Và Sự Chuyển Động Của Electron
Vỏ nguyên tử là không gian xung quanh hạt nhân, nơi các electron chuyển động. Vậy electron chuyển động như thế nào và có những đặc điểm gì?
3.1. Các Lớp Và Phân Lớp Electron
Electron không chuyển động hỗn loạn mà sắp xếp thành các lớp (hay còn gọi là mức năng lượng) khác nhau. Mỗi lớp có một số lượng electron tối đa nhất định.
- Lớp electron: Được đánh số từ 1 đến 7 (hoặc ký hiệu K, L, M, N, O, P, Q), tương ứng với mức năng lượng tăng dần.
- Phân lớp electron: Mỗi lớp lại chia thành các phân lớp, ký hiệu s, p, d, f. Số lượng phân lớp trong mỗi lớp bằng số thứ tự của lớp đó.
| Lớp (n) | Ký hiệu | Số phân lớp | Số electron tối đa |
|---|---|---|---|
| 1 | K | 1 (s) | 2 |
| 2 | L | 2 (s, p) | 8 |
| 3 | M | 3 (s, p, d) | 18 |
| 4 | N | 4 (s, p, d, f) | 32 |
3.2. Cấu Hình Electron
Cấu hình electron là sự phân bố electron vào các lớp và phân lớp. Cấu hình electron quyết định tính chất hóa học của nguyên tố.
Nguyên tắc Aufbau: Electron điền vào các lớp và phân lớp theo thứ tự năng lượng tăng dần: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s,…
Quy tắc Hund: Trong cùng một phân lớp, các electron sẽ chiếm các orbital khác nhau trước khi ghép đôi.
Ví dụ, cấu hình electron của Oxygen (Z = 8) là 1s^2 2s^2 2p^4.
3.3. Orbital Nguyên Tử
Electron không chuyển động theo quỹ đạo cố định như hành tinh quay quanh mặt trời. Thay vào đó, chúng tồn tại trong các orbital, là vùng không gian xung quanh hạt nhân mà xác suất tìm thấy electron là lớn nhất.
- Orbital s: Có dạng hình cầu.
- Orbital p: Có dạng hình số 8 nổi.
- Orbital d và f: Có hình dạng phức tạp hơn.
4. Vai Trò Của Các Hạt Nguyên Tử Trong Tính Chất Hóa Học
Các hạt cấu tạo nên nguyên tử đóng vai trò quan trọng trong việc xác định tính chất hóa học của nguyên tố.
4.1. Proton Và Nguyên Tố Hóa Học
Số lượng proton trong hạt nhân (số hiệu nguyên tử) xác định nguyên tố hóa học. Mỗi nguyên tố có một số proton đặc trưng, ví dụ:
- Hydrogen (H): 1 proton
- Oxygen (O): 8 proton
- Iron (Fe): 26 proton
4.2. Electron Và Liên Kết Hóa Học
Electron, đặc biệt là các electron ở lớp ngoài cùng (electron hóa trị), quyết định khả năng tạo liên kết hóa học của nguyên tử. Các nguyên tử có xu hướng đạt cấu hình electron bền vững (8 electron ở lớp ngoài cùng, trừ Hydrogen và Helium có 2 electron). Để đạt được cấu hình bền vững, các nguyên tử có thể cho, nhận hoặc chia sẻ electron, tạo thành các liên kết hóa học như liên kết ion, liên kết cộng hóa trị.
4.3. Neutron Và Đồng Vị
Số lượng neutron có thể khác nhau ở các nguyên tử cùng một nguyên tố, tạo thành các đồng vị. Các đồng vị có cùng số proton nhưng khác số neutron, do đó có khối lượng khác nhau. Ví dụ, Carbon có các đồng vị Carbon-12 (6 proton, 6 neutron), Carbon-13 (6 proton, 7 neutron) và Carbon-14 (6 proton, 8 neutron).
5. Ứng Dụng Của Hiểu Biết Về Cấu Tạo Nguyên Tử
Hiểu biết về cấu tạo nguyên tử có rất nhiều ứng dụng trong khoa học, công nghệ và đời sống.
5.1. Y Học
- Chẩn đoán hình ảnh: Sử dụng các đồng vị phóng xạ để chẩn đoán bệnh (ví dụ: chụp PET, SPECT).
- Điều trị ung thư: Sử dụng xạ trị để tiêu diệt tế bào ung thư.
5.2. Năng Lượng
- Năng lượng hạt nhân: Sử dụng phản ứng hạt nhân để tạo ra năng lượng (ví dụ: nhà máy điện hạt nhân).
- Nghiên cứu vật liệu mới: Phát triển các vật liệu chịu nhiệt, chịu phóng xạ cho ngành năng lượng hạt nhân.
5.3. Công Nghiệp
- Sản xuất vật liệu: Tạo ra các vật liệu có tính chất đặc biệt (ví dụ: vật liệu siêu dẫn, vật liệu nano).
- Kiểm tra chất lượng sản phẩm: Sử dụng phương pháp phân tích thành phần nguyên tố để kiểm tra chất lượng sản phẩm.
5.4. Nghiên Cứu Khoa Học
- Vật lý hạt: Nghiên cứu cấu trúc cơ bản của vật chất, tìm hiểu về các hạt cơ bản và lực tương tác giữa chúng.
- Hóa học: Nghiên cứu tính chất và phản ứng của các chất, phát triển các hợp chất mới.
6. Những Câu Hỏi Thường Gặp Về Cấu Tạo Nguyên Tử (FAQ)
6.1. Nguyên tử có phải là hạt nhỏ nhất không?
Không, nguyên tử không phải là hạt nhỏ nhất. Nguyên tử được cấu tạo từ các hạt nhỏ hơn là proton, neutron và electron. Ngoài ra, proton và neutron còn được cấu tạo từ các hạt quark.
6.2. Tại sao electron không rơi vào hạt nhân?
Theo thuyết điện từ cổ điển, electron chuyển động xung quanh hạt nhân sẽ bức xạ năng lượng và mất dần năng lượng, cuối cùng rơi vào hạt nhân. Tuy nhiên, theo cơ học lượng tử, electron không chuyển động theo quỹ đạo cố định mà tồn tại trong các orbital. Electron chỉ có thể tồn tại ở các mức năng lượng nhất định, không thể mất năng lượng một cách liên tục, do đó không rơi vào hạt nhân.
6.3. Số proton và số electron trong một nguyên tử trung hòa điện có bằng nhau không?
Có, trong một nguyên tử trung hòa điện, số proton (điện tích dương) bằng số electron (điện tích âm).
6.4. Số neutron có ảnh hưởng đến tính chất hóa học của nguyên tố không?
Số neutron không ảnh hưởng trực tiếp đến tính chất hóa học của nguyên tố. Tính chất hóa học của nguyên tố chủ yếu được quyết định bởi số electron hóa trị. Tuy nhiên, số neutron ảnh hưởng đến khối lượng nguyên tử và tính chất vật lý của nguyên tố.
6.5. Đồng vị phóng xạ là gì?
Đồng vị phóng xạ là các đồng vị có hạt nhân không ổn định, tự phân rã và phát ra các hạt hoặc tia phóng xạ. Quá trình phân rã này giúp hạt nhân đạt trạng thái ổn định hơn.
6.6. Làm thế nào để xác định cấu hình electron của một nguyên tố?
Để xác định cấu hình electron của một nguyên tố, bạn cần biết số hiệu nguyên tử (Z) của nguyên tố đó, sau đó áp dụng nguyên tắc Aufbau và quy tắc Hund để điền electron vào các lớp và phân lớp theo thứ tự năng lượng tăng dần.
6.7. Orbital nguyên tử là gì và có hình dạng như thế nào?
Orbital nguyên tử là vùng không gian xung quanh hạt nhân mà xác suất tìm thấy electron là lớn nhất. Các orbital có hình dạng khác nhau: orbital s có dạng hình cầu, orbital p có dạng hình số 8 nổi, orbital d và f có hình dạng phức tạp hơn.
6.8. Tại sao các nguyên tố lại tạo thành liên kết hóa học?
Các nguyên tố tạo thành liên kết hóa học để đạt được cấu hình electron bền vững (8 electron ở lớp ngoài cùng, trừ Hydrogen và Helium có 2 electron). Khi tạo thành liên kết hóa học, các nguyên tử có thể cho, nhận hoặc chia sẻ electron để đạt được cấu hình bền vững này.
6.9. Lực hạt nhân là gì và có vai trò như thế nào?
Lực hạt nhân là một lực cực mạnh, có tác dụng trong phạm vi rất ngắn, giúp liên kết các nucleon (proton và neutron) lại với nhau trong hạt nhân. Lực hạt nhân giúp hạt nhân ổn định, chống lại lực đẩy tĩnh điện giữa các proton.
6.10. Ứng dụng của cấu tạo nguyên tử trong đời sống là gì?
Hiểu biết về cấu tạo nguyên tử có rất nhiều ứng dụng trong khoa học, công nghệ và đời sống, bao gồm: y học (chẩn đoán hình ảnh, điều trị ung thư), năng lượng (năng lượng hạt nhân, nghiên cứu vật liệu mới), công nghiệp (sản xuất vật liệu, kiểm tra chất lượng sản phẩm), nghiên cứu khoa học (vật lý hạt, hóa học).
7. Kết Luận
Hạt nguyên tử cấu tạo bởi những gì? Chúng ta đã cùng nhau khám phá cấu trúc phức tạp của nguyên tử, từ hạt nhân chứa proton và neutron, đến vỏ nguyên tử với các electron chuyển động theo các lớp và phân lớp. Hiểu rõ về cấu tạo nguyên tử không chỉ giúp bạn nắm vững kiến thức khoa học cơ bản, mà còn mở ra cánh cửa đến với nhiều ứng dụng thực tiễn trong cuộc sống.
Nếu bạn đang tìm kiếm thông tin về xe tải, đừng quên ghé thăm XETAIMYDINH.EDU.VN. Chúng tôi cung cấp thông tin chi tiết và cập nhật về các loại xe tải, giá cả, địa điểm mua bán uy tín và dịch vụ sửa chữa chất lượng.
Bạn đang gặp khó khăn trong việc lựa chọn xe tải phù hợp? Bạn có thắc mắc về thủ tục mua bán, đăng ký và bảo dưỡng xe tải? Hãy liên hệ ngay với Xe Tải Mỹ Đình qua hotline 0247 309 9988 hoặc truy cập website XETAIMYDINH.EDU.VN để được tư vấn và giải đáp mọi thắc mắc. Địa chỉ của chúng tôi là Số 18 đường Mỹ Đình, phường Mỹ Đình 2, quận Nam Từ Liêm, Hà Nội. Chúng tôi luôn sẵn lòng hỗ trợ bạn tìm được chiếc xe tải ưng ý nhất!
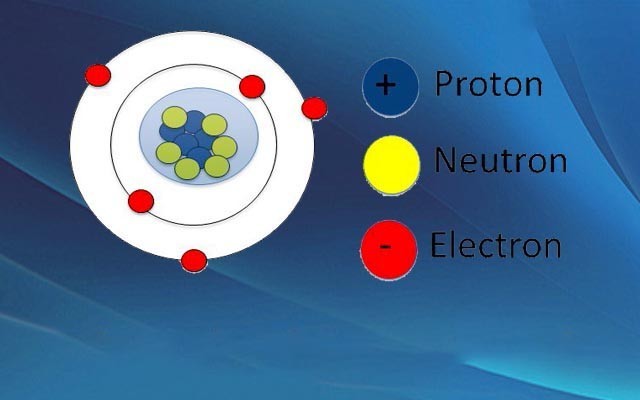 Giải bài tập nguyên tử trong hóa học lớp 10
Giải bài tập nguyên tử trong hóa học lớp 10
