Dung Dịch Feso4 Và Dung Dịch Cuso4 đều Tác Dụng được Với các kim loại đứng trước Fe trong dãy điện hóa, thể hiện tính oxi hóa của ion Fe2+ và Cu2+. Để hiểu rõ hơn về vấn đề này, hãy cùng Xe Tải Mỹ Đình tìm hiểu chi tiết về dãy điện hóa kim loại và ứng dụng của nó trong việc xác định khả năng phản ứng. Khám phá ngay các phản ứng trao đổi ion và những điều cần lưu ý.
1. Tổng Quan Về Dãy Điện Hóa Kim Loại
Dãy điện hóa của kim loại là một bảng sắp xếp các kim loại theo thứ tự tăng dần tính oxi hóa của ion kim loại và giảm dần tính khử của kim loại.
- Định nghĩa: Dãy điện hóa là dãy các cặp oxi hóa – khử được sắp xếp theo chiều tăng dần tính oxi hóa của ion kim loại và giảm dần tính khử của kim loại.
- Ý nghĩa: Dãy điện hóa cho biết tính chất oxi hóa – khử tương đối của các kim loại và ion kim loại, giúp dự đoán khả năng phản ứng giữa chúng.
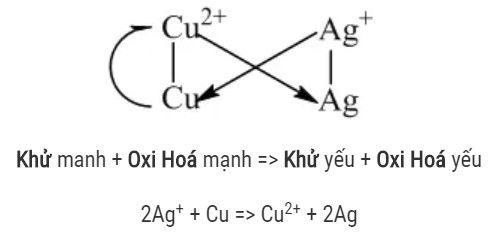 Dãy điện hóa kim loại
Dãy điện hóa kim loại
Alt text: Sơ đồ dãy điện hóa kim loại thể hiện quy tắc alpha để xác định chiều phản ứng oxi hóa khử.
2. Dung Dịch FeSO4 và Dung Dịch CuSO4 Tác Dụng Với Chất Nào?
Vậy dung dịch FeSO4 và dung dịch CuSO4 đều tác dụng được với kim loại nào? Câu trả lời là các kim loại đứng trước Fe trong dãy điện hóa.
Giải thích chi tiết:
- Tính chất của FeSO4: FeSO4 là muối của sắt (II), trong đó ion Fe2+ có tính oxi hóa.
- Tính chất của CuSO4: CuSO4 là muối của đồng (II), trong đó ion Cu2+ có tính oxi hóa.
- Phản ứng: Các kim loại đứng trước Fe trong dãy điện hóa có tính khử mạnh hơn Fe và Cu, nên có thể khử Fe2+ và Cu2+ thành Fe và Cu tự do.
Ví dụ:
- Zn + FeSO4 → Fe + ZnSO4
- Zn + CuSO4 → Cu + ZnSO4
3. Dãy Điện Hóa Kim Loại Đầy Đủ
Để hiểu rõ hơn về khả năng phản ứng của FeSO4 và CuSO4, chúng ta cần xem xét dãy điện hóa kim loại đầy đủ. Dưới đây là dãy điện hóa phổ biến:
K > Na > Mg > Al > Zn > Fe > Ni > Sn > Pb > H > Cu > Ag > Au
- Các kim loại bên trái có tính khử mạnh hơn và dễ bị oxi hóa hơn.
- Các kim loại bên phải có tính oxi hóa mạnh hơn và khó bị oxi hóa hơn.
4. Ý Nghĩa Của Dãy Điện Hóa Kim Loại
Dãy điện hóa kim loại không chỉ giúp xác định khả năng phản ứng của FeSO4 và CuSO4, mà còn có nhiều ứng dụng quan trọng khác:
4.1. Xác Định Chiều Của Phản Ứng Oxi Hóa – Khử
Dãy điện hóa cho phép xác định chiều của phản ứng oxi hóa – khử dựa trên quy tắc alpha (α). Theo quy tắc này, phản ứng sẽ xảy ra theo chiều tạo thành chất oxi hóa yếu hơn và chất khử yếu hơn.
Ví dụ:
- Cho phản ứng: Fe + CuSO4 → FeSO4 + Cu
- Fe2+/Fe và Cu2+/Cu là hai cặp oxi hóa – khử.
- Trong dãy điện hóa, Fe đứng trước Cu, nên Fe có tính khử mạnh hơn Cu.
- Phản ứng xảy ra theo chiều từ trái sang phải, tạo thành FeSO4 (Fe2+ yếu hơn Cu2+) và Cu (chất khử yếu hơn).
4.2. So Sánh Tính Khử Của Kim Loại
Dãy điện hóa cho phép so sánh tính khử của các kim loại một cách dễ dàng. Kim loại nào đứng trước trong dãy có tính khử mạnh hơn.
Ví dụ:
- Zn đứng trước Fe trong dãy điện hóa, nên Zn có tính khử mạnh hơn Fe.
- Al đứng trước Zn trong dãy điện hóa, nên Al có tính khử mạnh hơn Zn.
4.3. Dự Đoán Khả Năng Phản Ứng Của Kim Loại Với Dung Dịch Muối
Dãy điện hóa cho phép dự đoán khả năng phản ứng của một kim loại với dung dịch muối của kim loại khác. Kim loại mạnh hơn (đứng trước trong dãy) có thể đẩy kim loại yếu hơn (đứng sau trong dãy) ra khỏi dung dịch muối.
Ví dụ:
- Cho kim loại Zn vào dung dịch CuSO4, Zn sẽ đẩy Cu ra khỏi dung dịch:
Zn + CuSO4 → ZnSO4 + Cu - Cho kim loại Cu vào dung dịch FeSO4, Cu không thể đẩy Fe ra khỏi dung dịch vì Cu đứng sau Fe trong dãy điện hóa.
4.4. Điều Chế Kim Loại
Dãy điện hóa được sử dụng để lựa chọn phương pháp điều chế kim loại phù hợp. Các kim loại có tính khử mạnh (như K, Na, Ca, Mg, Al) thường được điều chế bằng phương pháp điện phân nóng chảy. Các kim loại có tính khử trung bình (như Zn, Fe, Ni, Sn, Pb) có thể được điều chế bằng phương pháp nhiệt luyện (dùng chất khử như CO, H2, Al). Các kim loại có tính khử yếu (như Cu, Ag, Au) có thể được điều chế bằng phương pháp thủy luyện (dùng dung dịch muối).
4.5. Ứng Dụng Trong Pin Điện Hóa
Dãy điện hóa là cơ sở để xây dựng các pin điện hóa. Pin điện hóa hoạt động dựa trên phản ứng oxi hóa – khử tự xảy ra, tạo ra dòng điện.
Ví dụ:
- Pin Daniell: Sử dụng cặp oxi hóa – khử Zn2+/Zn và Cu2+/Cu.
- Zn đóng vai trò là cực âm (anot), nơi xảy ra quá trình oxi hóa: Zn → Zn2+ + 2e-
- Cu đóng vai trò là cực dương (catot), nơi xảy ra quá trình khử: Cu2+ + 2e- → Cu
- Dòng điện được tạo ra do sự di chuyển của electron từ Zn sang Cu.
5. Các Yếu Tố Ảnh Hưởng Đến Phản Ứng
Ngoài dãy điện hóa, một số yếu tố khác cũng có thể ảnh hưởng đến khả năng phản ứng của FeSO4 và CuSO4:
- Nồng độ: Nồng độ của dung dịch muối ảnh hưởng đến tốc độ phản ứng. Nồng độ càng cao, tốc độ phản ứng càng nhanh.
- Nhiệt độ: Nhiệt độ cũng ảnh hưởng đến tốc độ phản ứng. Nhiệt độ càng cao, tốc độ phản ứng càng nhanh.
- Diện tích bề mặt: Diện tích bề mặt của kim loại ảnh hưởng đến tốc độ phản ứng. Diện tích bề mặt càng lớn, tốc độ phản ứng càng nhanh.
- Chất xúc tác: Một số chất xúc tác có thể làm tăng tốc độ phản ứng.
6. Ví Dụ Minh Họa
Để hiểu rõ hơn về khả năng phản ứng của FeSO4 và CuSO4, chúng ta sẽ xem xét một số ví dụ cụ thể:
6.1. Phản Ứng Của Zn Với FeSO4 Và CuSO4
Kẽm (Zn) là một kim loại đứng trước Fe trong dãy điện hóa, nên nó có thể tác dụng với cả FeSO4 và CuSO4.
- Phản ứng với FeSO4:
Zn + FeSO4 → ZnSO4 + Fe
Trong phản ứng này, Zn khử Fe2+ thành Fe và bị oxi hóa thành Zn2+. - Phản ứng với CuSO4:
Zn + CuSO4 → ZnSO4 + Cu
Trong phản ứng này, Zn khử Cu2+ thành Cu và bị oxi hóa thành Zn2+.
6.2. Phản Ứng Của Fe Với CuSO4
Sắt (Fe) là một kim loại đứng trước Cu trong dãy điện hóa, nên nó có thể tác dụng với CuSO4.
- Phản ứng với CuSO4:
Fe + CuSO4 → FeSO4 + Cu
Trong phản ứng này, Fe khử Cu2+ thành Cu và bị oxi hóa thành Fe2+.
6.3. Phản Ứng Của Cu Với FeSO4
Đồng (Cu) là một kim loại đứng sau Fe trong dãy điện hóa, nên nó không thể tác dụng với FeSO4.
- Không phản ứng:
Cu + FeSO4 → Không phản ứng
Cu không có khả năng khử Fe2+ thành Fe.
7. Ứng Dụng Thực Tiễn
Hiểu rõ về khả năng phản ứng của FeSO4 và CuSO4 có nhiều ứng dụng trong thực tiễn:
- Xử lý nước thải: FeSO4 được sử dụng để xử lý nước thải, loại bỏ các chất ô nhiễm như phosphate và kim loại nặng.
- Mạ điện: CuSO4 được sử dụng trong quá trình mạ điện, tạo lớp phủ kim loại bảo vệ trên bề mặt vật liệu.
- Sản xuất pin: Các phản ứng oxi hóa – khử liên quan đến FeSO4 và CuSO4 được sử dụng trong sản xuất pin điện hóa.
- Phân tích hóa học: Các phản ứng này được sử dụng trong phân tích hóa học để định lượng các chất.
8. Lưu Ý Khi Thực Hiện Phản Ứng
Khi thực hiện các phản ứng liên quan đến FeSO4 và CuSO4, cần lưu ý một số điểm sau:
- Sử dụng hóa chất tinh khiết: Để đảm bảo phản ứng xảy ra hoàn toàn và chính xác, nên sử dụng hóa chất tinh khiết.
- Kiểm soát điều kiện phản ứng: Nồng độ, nhiệt độ và thời gian phản ứng cần được kiểm soát để đạt được kết quả tốt nhất.
- Đảm bảo an toàn: Khi làm việc với hóa chất, cần tuân thủ các quy tắc an toàn, đeo găng tay, kính bảo hộ và làm việc trong môi trường thông thoáng.
- Xử lý chất thải: Chất thải sau phản ứng cần được xử lý đúng cách để tránh gây ô nhiễm môi trường.
9. So Sánh Chi Tiết Về Dung Dịch FeSO4 và Dung Dịch CuSO4
Để giúp bạn hiểu rõ hơn về hai loại dung dịch này, Xe Tải Mỹ Đình xin cung cấp bảng so sánh chi tiết:
| Tính chất | Dung dịch FeSO4 | Dung dịch CuSO4 |
|---|---|---|
| Công thức hóa học | FeSO4 | CuSO4 |
| Màu sắc | Lục nhạt | Xanh lam |
| Tính chất vật lý | Chất rắn màu trắng, tan trong nước | Chất rắn màu xanh lam, tan trong nước |
| Tính chất hóa học | Tính khử, tính oxi hóa yếu | Tính oxi hóa |
| Ứng dụng | Xử lý nước thải, sản xuất phân bón, dược phẩm | Mạ điện, thuốc trừ sâu, chất diệt tảo |
| Phản ứng với kim loại | Tác dụng với kim loại đứng trước Fe trong dãy điện hóa | Tác dụng với kim loại đứng trước Cu trong dãy điện hóa |
| Độ độc hại | Ít độc hại | Độc hại nếu nuốt phải |
10. Các Câu Hỏi Thường Gặp (FAQ)
Dưới đây là một số câu hỏi thường gặp liên quan đến khả năng tác dụng của dung dịch FeSO4 và dung dịch CuSO4:
- Dung dịch FeSO4 có tác dụng với dung dịch AgNO3 không?
Có, vì Ag+ có tính oxi hóa mạnh hơn Fe2+. - Dung dịch CuSO4 có tác dụng với dung dịch NaOH không?
Có, tạo thành kết tủa Cu(OH)2 màu xanh lam. - Kim loại nào có thể tác dụng với cả FeSO4 và CuSO4?
Các kim loại đứng trước Fe trong dãy điện hóa, ví dụ như Zn, Al, Mg. - Tại sao Cu không tác dụng với FeSO4?
Vì Cu đứng sau Fe trong dãy điện hóa, tính khử yếu hơn Fe. - Dung dịch FeSO4 có làm mất màu dung dịch KMnO4 không?
Có, vì Fe2+ có tính khử, có thể khử MnO4- thành Mn2+. - Ứng dụng của FeSO4 trong xử lý nước thải là gì?
FeSO4 được sử dụng để kết tủa các chất ô nhiễm như phosphate và kim loại nặng. - Tại sao CuSO4 được sử dụng trong mạ điện?
Vì Cu2+ có thể bị khử thành Cu trên bề mặt vật liệu, tạo lớp phủ bảo vệ. - FeSO4 và CuSO4 có gây ô nhiễm môi trường không?
Có, nếu không được xử lý đúng cách, chúng có thể gây ô nhiễm nguồn nước và đất. - Làm thế nào để nhận biết dung dịch FeSO4 và CuSO4?
Dựa vào màu sắc: FeSO4 có màu lục nhạt, CuSO4 có màu xanh lam. - Có thể dùng FeSO4 để điều chế Fe không?
Có, bằng cách cho FeSO4 tác dụng với kim loại có tính khử mạnh hơn Fe, ví dụ như Zn.
Hy vọng qua bài viết này, Xe Tải Mỹ Đình đã cung cấp cho bạn những thông tin chi tiết và hữu ích về khả năng tác dụng của dung dịch FeSO4 và dung dịch CuSO4. Nếu bạn có bất kỳ thắc mắc nào khác, đừng ngần ngại liên hệ với chúng tôi để được tư vấn và giải đáp.
Bạn muốn tìm hiểu thêm về các loại xe tải phù hợp với nhu cầu vận chuyển hàng hóa của mình? Hãy truy cập ngay XETAIMYDINH.EDU.VN hoặc liên hệ hotline 0247 309 9988 để được tư vấn chi tiết!
