Bạn đang gặp khó khăn trong việc Tính Nồng độ Phần Trăm Các Chất Trong Dung Dịch Sau Phản ứng hóa học? Đừng lo lắng, Xe Tải Mỹ Đình (XETAIMYDINH.EDU.VN) sẽ giúp bạn nắm vững kiến thức này một cách dễ dàng. Chúng tôi sẽ cung cấp công thức chuẩn xác, ví dụ minh họa chi tiết và các lưu ý quan trọng để bạn tự tin giải quyết mọi bài tập. Hãy cùng khám phá bí quyết tính toán nồng độ phần trăm hiệu quả nhất!
1. Nồng Độ Dung Dịch Là Gì?
Nồng độ dung dịch là một khái niệm quan trọng trong hóa học, cho biết lượng chất tan có trong một lượng dung dịch xác định.
Nồng độ dung dịch biểu thị lượng chất tan hòa tan trong một lượng dung môi hoặc dung dịch nhất định. Theo nghiên cứu của Trường Đại học Khoa học Tự nhiên Hà Nội, Khoa Hóa học, vào tháng 5 năm 2024, việc hiểu rõ nồng độ dung dịch giúp kiểm soát và dự đoán các phản ứng hóa học. Nồng độ có thể được điều chỉnh bằng cách thêm chất tan, thêm dung môi hoặc thay đổi nhiệt độ.
2. Nồng Độ Phần Trăm (C%) Là Gì?
Nồng độ phần trăm (C%) của một dung dịch cho biết số gam chất tan có trong 100 gam dung dịch. Đây là một cách biểu thị nồng độ phổ biến, giúp dễ dàng hình dung tỷ lệ chất tan trong dung dịch.
Nồng độ phần trăm, ký hiệu là C%, thể hiện khối lượng chất tan có trong 100 gam dung dịch. Theo một nghiên cứu của Viện Hóa học Công nghiệp Việt Nam, công bố tháng 3 năm 2023, nồng độ phần trăm được sử dụng rộng rãi trong các ứng dụng thực tế như pha chế dung dịch và kiểm soát chất lượng sản phẩm.
 Nồng độ phần trăm là gì?
Nồng độ phần trăm là gì?
Hình ảnh minh họa khái niệm nồng độ phần trăm, một đại lượng quan trọng trong hóa học dung dịch, thể hiện lượng chất tan trong 100 gam dung dịch.
3. Công Thức Tính Nồng Độ Phần Trăm
Công thức tính nồng độ phần trăm là công cụ không thể thiếu để giải các bài toán hóa học liên quan đến dung dịch.
Công thức:
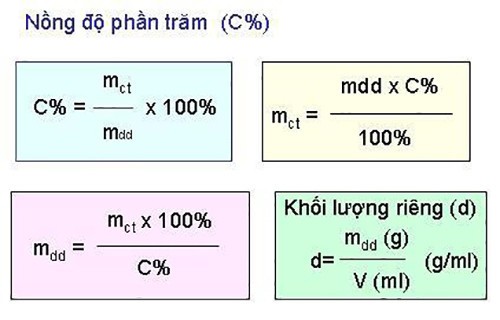
C% = (mct / mdd) x 100%Trong đó:
- C%: Nồng độ phần trăm của dung dịch
- mct: Khối lượng chất tan (gam)
- mdd: Khối lượng dung dịch (gam)
Lưu ý:
- Khối lượng dung dịch (mdd) bằng tổng khối lượng chất tan (mct) và khối lượng dung môi (mdm):
mdd = mct + mdmVí dụ: Hòa tan 20g đường vào 80g nước. Tính nồng độ phần trăm của dung dịch đường.
- mct (đường) = 20g
- mdm (nước) = 80g
- mdd = 20g + 80g = 100g
C% = (20g / 100g) x 100% = 20%Vậy, nồng độ phần trăm của dung dịch đường là 20%.
4. Các Bước Tính Nồng Độ Phần Trăm Các Chất Trong Dung Dịch Sau Phản Ứng
Để tính nồng độ phần trăm các chất trong dung dịch sau phản ứng một cách chính xác, bạn cần tuân theo một quy trình cụ thể.
Khi đề bài yêu cầu tính nồng độ phần trăm (C%) của các chất trong dung dịch sau phản ứng, hãy thực hiện theo các bước sau:
-
Bước 1: Xác định các chất có trong dung dịch sau phản ứng.
- Tính toán số mol của các chất tham gia phản ứng.
- Viết phương trình hóa học và xác định chất nào còn dư sau phản ứng.
- Liệt kê đầy đủ các chất tan có trong dung dịch sau phản ứng (bao gồm cả chất dư, nếu có).
-
Bước 2: Xác định khối lượng dung dịch sau phản ứng.
-
Sử dụng công thức:
mdd = m(các chất tan ban đầu) + m(dung môi) - m(chất kết tủa) - m(chất khí) -
Lưu ý: Nếu không có chất kết tủa hoặc chất khí, công thức trở thành:
mdd = m(các chất tan ban đầu) + m(dung môi)
-
-
Bước 3: Tính khối lượng của từng chất tan trong dung dịch sau phản ứng.
- Dựa vào phương trình hóa học và số mol của các chất, tính khối lượng của từng chất tan.
-
Bước 4: Tính nồng độ phần trăm của từng chất tan.
-
Áp dụng công thức:
C% = (mct / mdd) x 100%cho từng chất tan trong dung dịch.
-
5. Ví Dụ Minh Họa Cách Tính Nồng Độ Phần Trăm Sau Phản Ứng
Để hiểu rõ hơn về quy trình tính nồng độ phần trăm sau phản ứng, hãy xem xét ví dụ sau.
Ví dụ: Hòa tan 10g CaCO3 vào 200g dung dịch HCl 7,3% (vừa đủ). Tính nồng độ phần trăm của các chất có trong dung dịch sau phản ứng.
Giải:
-
Bước 1: Xác định các chất có trong dung dịch sau phản ứng.
-
Tính khối lượng HCl:
mHCl = (7,3% x 200g) / 100% = 14,6g -
Số mol HCl:
nHCl = 14,6g / 36,5 g/mol = 0,4 mol -
Phương trình phản ứng:
CaCO3 + 2HCl -> CaCl2 + H2O + CO2 -
Theo phương trình, nCaCO3 = 1/2 nHCl = 0,2 mol
-
nCaCl2 = 1/2 nHCl = 0,2 mol
-
nCO2 = 1/2 nHCl = 0,2 mol
-
Vậy, sau phản ứng, dung dịch chứa CaCl2.
-
-
Bước 2: Xác định khối lượng dung dịch sau phản ứng.
- mCaCO3 = 0,2 mol x 100 g/mol = 20g
- mCO2 = 0,2 mol x 44 g/mol = 8,8g
- mdd sau phản ứng = mCaCO3 + mdd HCl – mCO2 = 20g + 200g – 8,8g = 211,2g
-
Bước 3: Tính khối lượng CaCl2.
- mCaCl2 = 0,2 mol x 111 g/mol = 22,2g
-
Bước 4: Tính nồng độ phần trăm của CaCl2.
- C% CaCl2 = (22,2g / 211,2g) x 100% = 10,51%
Vậy, nồng độ phần trăm của CaCl2 trong dung dịch sau phản ứng là 10,51%.
6. Lưu Ý Quan Trọng Khi Tính Nồng Độ Phần Trăm
Để đạt được kết quả chính xác khi tính nồng độ phần trăm, bạn cần chú ý đến một số yếu tố quan trọng.
Để tính toán nồng độ phần trăm một cách chính xác, hãy lưu ý những điều sau:
- Đọc kỹ đề bài: Xác định rõ các chất đã cho và chất cần tính toán.
- Nhớ chính xác công thức: Áp dụng công thức phù hợp cho từng trường hợp.
- Tính toán cẩn thận: Kiểm tra kỹ các bước tính toán để tránh sai sót.
- Đảm bảo đơn vị đo: Chuyển đổi đơn vị đo về cùng một hệ thống (ví dụ: gam, mililit) trước khi tính toán.
- Xác định đúng khối lượng dung dịch: Tính toán chính xác khối lượng dung dịch sau phản ứng, bao gồm cả việc trừ đi khối lượng chất kết tủa hoặc chất khí (nếu có).
- Kiểm tra lại kết quả: Sau khi tính toán, hãy kiểm tra lại toàn bộ quá trình để đảm bảo không có sai sót.
- Hiểu rõ bản chất phản ứng: Nắm vững phương trình hóa học và các yếu tố ảnh hưởng đến phản ứng để có thể giải quyết các bài toán phức tạp hơn.
7. Mối Liên Hệ Giữa Nồng Độ Phần Trăm Và Các Loại Nồng Độ Khác
Nồng độ phần trăm không phải là loại nồng độ duy nhất. Bạn cũng cần làm quen với các loại nồng độ khác và mối liên hệ giữa chúng.
Nồng độ phần trăm có mối liên hệ mật thiết với các loại nồng độ khác như nồng độ mol (CM) và nồng độ molan (Cm). Theo “Sổ tay Hóa học” của NXB Khoa học Kỹ thuật, năm 2022, việc chuyển đổi giữa các loại nồng độ này giúp giải quyết các bài toán hóa học một cách linh hoạt hơn.
Công thức liên hệ giữa nồng độ mol (CM) và nồng độ phần trăm (C%):
CM = (10 x D x C%) / MTrong đó:
- CM: Nồng độ mol (mol/lít)
- D: Khối lượng riêng của dung dịch (g/ml)
- C%: Nồng độ phần trăm
- M: Khối lượng mol của chất tan (g/mol)
8. Nồng Độ Mol Là Gì?
Nồng độ mol là một đại lượng quan trọng khác trong hóa học, biểu thị số mol chất tan có trong một lít dung dịch.
Nồng độ mol (CM) cho biết số mol chất tan có trong một lít dung dịch. Theo Bộ Giáo dục và Đào tạo, chương trình Hóa học THPT, hiểu rõ nồng độ mol giúp tính toán lượng chất cần thiết cho phản ứng và xác định hiệu suất phản ứng.
8.1. Khái Niệm Và Công Thức Tính Nồng Độ Mol
Nồng độ mol là số mol chất tan có trong một lít dung dịch.
Công thức tính nồng độ mol:
CM = n / VTrong đó:
- CM: Nồng độ mol (mol/lít hoặc M)
- n: Số mol chất tan (mol)
- V: Thể tích dung dịch (lít)
8.2. Các Dạng Bài Tập Về Nồng Độ Mol
Có nhiều dạng bài tập khác nhau liên quan đến nồng độ mol, từ cơ bản đến nâng cao.
-
Dạng 1: Tính nồng độ mol khi biết số mol và thể tích.
-
Ví dụ: Hòa tan 0,5 mol NaCl vào 2 lít nước. Tính nồng độ mol của dung dịch.
- CM = 0,5 mol / 2 lít = 0,25 M
-
-
Dạng 2: Tính số mol khi biết nồng độ mol và thể tích.
-
Ví dụ: Có 500ml dung dịch NaOH 1M. Tính số mol NaOH có trong dung dịch.
- V = 500ml = 0,5 lít
- n = CM x V = 1M x 0,5 lít = 0,5 mol
-
-
Dạng 3: Tính thể tích khi biết nồng độ mol và số mol.
-
Ví dụ: Cần bao nhiêu lít dung dịch H2SO4 0,5M để có 0,25 mol H2SO4?
- V = n / CM = 0,25 mol / 0,5M = 0,5 lít
-
9. Bài Tập Vận Dụng Tính Nồng Độ Phần Trăm
Để củng cố kiến thức, hãy cùng làm một số bài tập vận dụng về tính nồng độ phần trăm.
Bài 1: Hòa tan hoàn toàn 10 gam NaOH vào 90 gam nước. Tính nồng độ phần trăm của dung dịch thu được.
Giải:
- mct (NaOH) = 10g
- mdm (nước) = 90g
- mdd = 10g + 90g = 100g
- C% = (10g / 100g) x 100% = 10%
Bài 2: Cho 200g dung dịch BaCl2 10% tác dụng với 300g dung dịch Na2SO4. Tính nồng độ phần trăm của BaCl2 sau phản ứng.
Giải:
- Viết phương trình phản ứng: BaCl2 + Na2SO4 -> BaSO4 + 2NaCl
- Tính số mol BaCl2 trong 200g dung dịch 10%:
- mBaCl2 = (10% x 200g) / 100% = 20g
- nBaCl2 = 20g / 208 g/mol = 0,096 mol
- Vì phản ứng xảy ra hoàn toàn nên BaCl2 hết.
- Vậy nồng độ phần trăm của BaCl2 sau phản ứng là 0%.
Bài 3: Hòa tan 5,4 gam Al vào 200ml dung dịch HCl 2M. Tính nồng độ phần trăm của các chất trong dung dịch sau phản ứng.
Giải:
- Tính số mol Al: nAl = 5,4g / 27 g/mol = 0,2 mol
- Tính số mol HCl: nHCl = 2M x 0,2 lít = 0,4 mol
- Viết phương trình phản ứng: 2Al + 6HCl -> 2AlCl3 + 3H2
- Theo phương trình, để phản ứng hết với 0,2 mol Al cần 0,6 mol HCl, nhưng chỉ có 0,4 mol HCl nên HCl hết, Al dư.
- Tính số mol AlCl3 tạo thành: nAlCl3 = 1/3 nHCl = 0,4/3 mol
- Tính khối lượng AlCl3: mAlCl3 = (0,4/3) mol x 133,5 g/mol = 17,8g
- Tính khối lượng Al dư:
- Số mol Al phản ứng: nAl (phản ứng) = 1/3 nHCl = 0,4/3 mol
- Số mol Al dư: nAl (dư) = 0,2 – 0,4/3 = 0,2/3 mol
- mAl (dư) = (0,2/3) mol x 27 g/mol = 1,8g
- Tính khối lượng dung dịch sau phản ứng:
- mdd = mAl + mdd HCl – mH2
- Tính mH2: nH2 = 1/2 nHCl = 0,2 mol => mH2 = 0,2 mol x 2 g/mol = 0,4g
- mdd HCl = D x V = 1,1 g/ml x 200 ml = 220g (giả sử khối lượng riêng của dung dịch HCl là 1,1 g/ml)
- mdd = 5,4g + 220g – 0,4g = 225g
- Tính nồng độ phần trăm của AlCl3: C% (AlCl3) = (17,8g / 225g) x 100% = 7,91%
- Tính nồng độ phần trăm của Al dư: C% (Al dư) = (1,8g / 225g) x 100% = 0,8%
10. Câu Hỏi Thường Gặp Về Tính Nồng Độ Phần Trăm (FAQ)
Dưới đây là một số câu hỏi thường gặp về cách tính nồng độ phần trăm:
-
Câu hỏi: Làm thế nào để tính nồng độ phần trăm khi biết khối lượng chất tan và khối lượng dung môi?
- Trả lời: Sử dụng công thức C% = (mct / (mct + mdm)) x 100%.
-
Câu hỏi: Nồng độ phần trăm có phụ thuộc vào nhiệt độ không?
- Trả lời: Có, vì thể tích dung dịch có thể thay đổi theo nhiệt độ, ảnh hưởng đến khối lượng riêng và do đó ảnh hưởng đến nồng độ phần trăm.
-
Câu hỏi: Làm thế nào để chuyển đổi nồng độ mol sang nồng độ phần trăm?
- Trả lời: Sử dụng công thức CM = (10 x D x C%) / M, trong đó D là khối lượng riêng của dung dịch và M là khối lượng mol của chất tan.
-
Câu hỏi: Tại sao cần phải trừ đi khối lượng chất kết tủa hoặc chất khí khi tính khối lượng dung dịch sau phản ứng?
- Trả lời: Vì chất kết tủa tách ra khỏi dung dịch và chất khí thoát ra khỏi dung dịch, làm giảm khối lượng dung dịch.
-
Câu hỏi: Làm thế nào để xác định chất nào còn dư sau phản ứng?
- Trả lời: Tính số mol của các chất tham gia phản ứng, sau đó so sánh tỷ lệ số mol thực tế với tỷ lệ số mol theo phương trình hóa học. Chất nào có tỷ lệ nhỏ hơn là chất hết, chất còn lại là chất dư.
-
Câu hỏi: Có thể tính nồng độ phần trăm cho hỗn hợp các chất tan không?
- Trả lời: Có, nhưng cần tính tổng khối lượng của tất cả các chất tan trong hỗn hợp.
-
Câu hỏi: Đơn vị của nồng độ phần trăm là gì?
- Trả lời: Nồng độ phần trăm không có đơn vị, vì nó là tỷ lệ giữa khối lượng chất tan và khối lượng dung dịch, được biểu thị dưới dạng phần trăm (%).
-
Câu hỏi: Khi nào thì nồng độ phần trăm bằng nồng độ mol?
- Trả lời: Nồng độ phần trăm và nồng độ mol không bao giờ bằng nhau vì chúng biểu thị các đại lượng khác nhau.
-
Câu hỏi: Làm thế nào để pha chế một dung dịch có nồng độ phần trăm xác định?
- Trả lời: Tính khối lượng chất tan cần thiết dựa trên khối lượng dung dịch mong muốn và nồng độ phần trăm yêu cầu, sau đó hòa tan chất tan vào dung môi.
-
Câu hỏi: Các yếu tố nào ảnh hưởng đến độ chính xác của việc tính toán nồng độ phần trăm?
- Trả lời: Độ chính xác của việc đo khối lượng chất tan, khối lượng dung môi và thể tích dung dịch, cũng như sự chính xác của các công cụ đo lường.
Bạn vẫn còn thắc mắc về cách tính nồng độ phần trăm? Bạn muốn tìm hiểu thêm về các loại xe tải phù hợp với nhu cầu vận chuyển của mình? Hãy liên hệ ngay với Xe Tải Mỹ Đình qua số Hotline: 0247 309 9988 hoặc truy cập website XETAIMYDINH.EDU.VN để được tư vấn và giải đáp mọi thắc mắc. Địa chỉ của chúng tôi là Số 18 đường Mỹ Đình, phường Mỹ Đình 2, quận Nam Từ Liêm, Hà Nội. Chúng tôi luôn sẵn lòng hỗ trợ bạn!
Với những kiến thức và ví dụ minh họa chi tiết trên, Xe Tải Mỹ Đình hy vọng bạn đã nắm vững cách tính nồng độ phần trăm các chất trong dung dịch sau phản ứng. Chúc bạn thành công trong học tập và công việc!