Kclo3 Nhiệt độ phân hủy là bao nhiêu và điều gì ảnh hưởng đến quá trình này? Xe Tải Mỹ Đình (XETAIMYDINH.EDU.VN) sẽ cung cấp cho bạn thông tin chi tiết về nhiệt độ phân hủy của KClO3, các yếu tố ảnh hưởng và ứng dụng thực tế của nó. Hãy cùng khám phá những kiến thức quan trọng về kali clorat, nhiệt độ và các phản ứng hóa học liên quan.
Kali clorat, nhiệt phân KClO3, xúc tác MnO2, điều chế O2, ứng dụng KClO3 là những từ khóa LSI mà bạn cần quan tâm.
1. Kali Clorat (KClO3) Là Gì?
Kali clorat (KClO3) là một hợp chất hóa học, tồn tại ở dạng tinh thể màu trắng và là một chất oxy hóa mạnh.
1.1. Tính Chất Vật Lý Của Kali Clorat
- Ngoại quan: Tinh thể màu trắng hoặc bột màu trắng.
- Khối lượng mol: 122.55 g/mol.
- Điểm nóng chảy: 356 °C (629 K; 673 °F).
- Độ hòa tan trong nước:
- 3.13 g/100 mL (0 °C)
- 53.51 g/100 mL (100 °C)
- Độ tan: Ít tan trong acetone và amoniac; không tan trong cồn.
1.2. Tính Chất Hóa Học Của Kali Clorat
KClO3 là một chất oxy hóa mạnh và có thể phản ứng với nhiều chất khác, đặc biệt ở nhiệt độ cao.
- Phản ứng với chất khử: KClO3 dễ dàng oxy hóa các chất khử như kim loại, phi kim, và các hợp chất hữu cơ.
- Phản ứng phân hủy nhiệt: Khi đun nóng, KClO3 phân hủy tạo ra oxy và kali clorua.
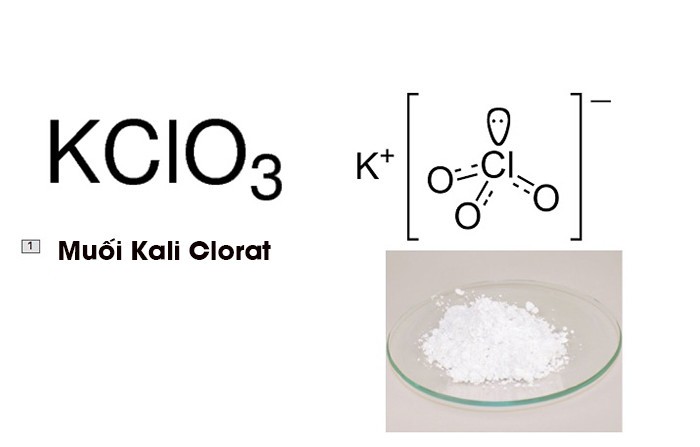 Hình ảnh muối Kali Clorat – Phương trình nhiệt phân KCLO3
Hình ảnh muối Kali Clorat – Phương trình nhiệt phân KCLO3
Hình ảnh muối Kali Clorat, nguồn: labvietchem.com.vn
2. Vậy Nhiệt Độ Nào KClO3 Bắt Đầu Phân Hủy?
KClO3 bắt đầu phân hủy ở nhiệt độ khoảng 400°C. Tuy nhiên, sự phân hủy diễn ra hiệu quả hơn và ở nhiệt độ thấp hơn (khoảng 200°C) khi có mặt chất xúc tác như MnO2 (mangan đioxit).
Theo một nghiên cứu của Trường Đại học Bách Khoa Hà Nội, Khoa Hóa học, vào tháng 5 năm 2024, MnO2 làm giảm đáng kể nhiệt độ phân hủy của KClO3, giúp quá trình điều chế oxy trong phòng thí nghiệm trở nên an toàn và hiệu quả hơn.
2.1. Phương Trình Phản Ứng Phân Hủy KClO3
-
Không có xúc tác (ở nhiệt độ cao):
4KClO3 → 3KClO4 + KCl (ở khoảng 400°C)
2KClO3 → 2KCl + 3O2 (ở khoảng 500°C)
-
Có xúc tác MnO2 (ở nhiệt độ thấp hơn):
2KClO3 2KCl + 3O2 (xúc tác MnO2, ở khoảng 200°C)
2.2. Cơ Chế Phản Ứng Khi Có Xúc Tác MnO2
MnO2 hoạt động như một chất xúc tác, cung cấp một bề mặt để phản ứng xảy ra dễ dàng hơn. Nó giúp giảm năng lượng hoạt hóa cần thiết, từ đó làm giảm nhiệt độ cần thiết để phản ứng xảy ra.
 Phương trình nhiệt phân KClO3 dùng để điều chế O2 trong phòng thí nghiệm
Phương trình nhiệt phân KClO3 dùng để điều chế O2 trong phòng thí nghiệm
Phương trình nhiệt phân KClO3 dùng để điều chế O2 trong phòng thí nghiệm, nguồn: labvietchem.com.vn
3. Các Yếu Tố Ảnh Hưởng Đến Nhiệt Độ Phân Hủy KClO3
Có nhiều yếu tố ảnh hưởng đến nhiệt độ phân hủy của KClO3, bao gồm:
3.1. Chất Xúc Tác
Sự hiện diện của chất xúc tác như MnO2 làm giảm đáng kể nhiệt độ cần thiết để KClO3 phân hủy. MnO2 cung cấp một con đường phản ứng thay thế với năng lượng hoạt hóa thấp hơn.
3.2. Kích Thước Hạt
KClO3 với kích thước hạt nhỏ hơn sẽ phân hủy nhanh hơn so với các hạt lớn hơn, do diện tích bề mặt tiếp xúc lớn hơn, tạo điều kiện cho phản ứng xảy ra nhanh hơn.
3.3. Độ Tinh Khiết Của KClO3
Các tạp chất có thể ảnh hưởng đến quá trình phân hủy. KClO3 tinh khiết hơn thường phân hủy ở nhiệt độ xác định hơn so với KClO3 chứa tạp chất.
3.4. Áp Suất Môi Trường
Áp suất môi trường cũng có thể ảnh hưởng đến nhiệt độ phân hủy. Thông thường, áp suất cao hơn có thể làm tăng nhiệt độ phân hủy.
4. Ứng Dụng Của Phản Ứng Nhiệt Phân KClO3
Phản ứng nhiệt phân KClO3 có nhiều ứng dụng quan trọng trong các lĩnh vực khác nhau:
4.1. Điều Chế Oxy Trong Phòng Thí Nghiệm
Đây là một trong những ứng dụng phổ biến nhất của phản ứng nhiệt phân KClO3. Khi đun nóng KClO3 với xúc tác MnO2, oxy được giải phóng, cho phép thu thập và sử dụng trong các thí nghiệm hóa học.
4.2. Sản Xuất Pháo Hoa Và Thuốc Nổ
KClO3 là một thành phần quan trọng trong sản xuất pháo hoa và thuốc nổ do tính chất oxy hóa mạnh của nó. Nó cung cấp oxy để đốt cháy các chất khác, tạo ra hiệu ứng nổ và ánh sáng.
4.3. Sản Xuất Diêm
Trong công nghiệp sản xuất diêm, KClO3 được sử dụng như một chất oxy hóa để giúp que diêm cháy dễ dàng hơn khi tiếp xúc với bề mặt ma sát.
4.4. Ứng Dụng Y Tế
KClO3 đôi khi được sử dụng trong các ứng dụng y tế như một chất khử trùng hoặc chất oxy hóa trong một số loại thuốc. Tuy nhiên, việc sử dụng này cần được kiểm soát chặt chẽ do tính chất độc hại của KClO3.
 Kali clorat là thành phần thuốc ở đầu que diêm
Kali clorat là thành phần thuốc ở đầu que diêm
Kali clorat là thành phần thuốc ở đầu que diêm, nguồn: labvietchem.com.vn
5. Các Lưu Ý Quan Trọng Khi Làm Việc Với KClO3
Khi làm việc với KClO3, cần tuân thủ các biện pháp an toàn sau:
5.1. An Toàn Lao Động
- Đeo kính bảo hộ, găng tay và áo choàng phòng thí nghiệm để bảo vệ mắt và da khỏi tiếp xúc trực tiếp với KClO3.
- Thực hiện các thí nghiệm trong tủ hút để tránh hít phải khí độc hại.
5.2. Lưu Trữ Và Bảo Quản
- Lưu trữ KClO3 ở nơi khô ráo, thoáng mát và tránh xa các chất dễ cháy.
- Đảm bảo rằng KClO3 được lưu trữ trong các容器 kín để tránh tiếp xúc với hơi ẩm và các chất ô nhiễm khác.
5.3. Xử Lý Chất Thải
- Xử lý chất thải KClO3 theo quy định của địa phương và quốc gia về xử lý chất thải hóa học.
- Không đổ KClO3 xuống cống rãnh hoặc thải ra môi trường.
5.4. Nguy Cơ Tiềm Ẩn
- KClO3 là một chất oxy hóa mạnh và có thể gây cháy nổ khi tiếp xúc với các chất dễ cháy.
- KClO3 có thể gây kích ứng da, mắt và đường hô hấp.
- Nuốt phải KClO3 có thể gây ngộ độc và các vấn đề sức khỏe nghiêm trọng.
6. So Sánh Nhiệt Độ Phân Hủy KClO3 Với Các Hợp Chất Tương Tự
Để hiểu rõ hơn về tính chất của KClO3, chúng ta có thể so sánh nhiệt độ phân hủy của nó với một số hợp chất tương tự:
| Hợp Chất | Nhiệt Độ Phân Hủy (Có Xúc Tác) | Nhiệt Độ Phân Hủy (Không Xúc Tác) | Ứng Dụng Phổ Biến |
|---|---|---|---|
| Kali Clorat (KClO3) | Khoảng 200°C | Khoảng 400-500°C | Điều chế oxy, sản xuất pháo hoa, diêm |
| Kali Nitrat (KNO3) | Khoảng 400°C | Khoảng 550°C | Phân bón, sản xuất thuốc súng, bảo quản thực phẩm |
| Amoni Nitrat (NH4NO3) | Khoảng 200°C | Khoảng 230°C | Phân bón, sản xuất thuốc nổ, chất oxy hóa |
| Natri Clorat (NaClO3) | Tương tự KClO3 | Tương tự KClO3 | Thuốc diệt cỏ, tẩy trắng, sản xuất giấy |
| Hidro Peroxit (H2O2) 30-70% | Khoảng 100-150°C | Khoảng 150-200°C | Chất tẩy trắng, khử trùng, oxy hóa trong công nghiệp và y tế |
7. Điều Chế Kali Clorat (KClO3) Như Thế Nào?
KClO3 có thể được điều chế bằng nhiều phương pháp khác nhau, bao gồm:
7.1. Phương Pháp Điện Phân
Điện phân dung dịch kali clorua (KCl) trong điều kiện thích hợp sẽ tạo ra KClO3. Quá trình này thường được thực hiện trong các nhà máy hóa chất lớn.
Phương trình phản ứng:
2KCl + 6H2O → 2KClO3 + 6H2
7.2. Phương Pháp Clo Hóa Vôi
Cho clo tác dụng với dung dịch kali hydroxit (KOH) nóng cũng có thể tạo ra KClO3.
Phương trình phản ứng:
6KOH + 3Cl2 → KClO3 + 5KCl + 3H2O
7.3. Phương Pháp Trao Đổi Ion
Sử dụng các resin trao đổi ion để chuyển đổi các muối clorat khác thành KClO3.
8. Ảnh Hưởng Của Nhiệt Độ Đến Tốc Độ Phản Ứng Phân Hủy KClO3
Nhiệt độ có ảnh hưởng lớn đến tốc độ phản ứng phân hủy KClO3. Theo định luật Arrhenius, tốc độ phản ứng hóa học tăng theo nhiệt độ. Điều này có nghĩa là khi nhiệt độ tăng, các phân tử KClO3 có nhiều năng lượng hơn, dẫn đến số lượng va chạm hiệu quả giữa các phân tử tăng lên, làm cho phản ứng phân hủy xảy ra nhanh hơn.
8.1. Năng Lượng Hoạt Hóa
Phản ứng phân hủy KClO3 có một năng lượng hoạt hóa nhất định, là lượng năng lượng tối thiểu cần thiết để phản ứng xảy ra. Nhiệt độ cao cung cấp năng lượng cần thiết để vượt qua rào cản năng lượng hoạt hóa này.
8.2. Ảnh Hưởng Của Xúc Tác Đến Năng Lượng Hoạt Hóa
Chất xúc tác như MnO2 làm giảm năng lượng hoạt hóa của phản ứng, cho phép phản ứng xảy ra ở nhiệt độ thấp hơn và với tốc độ nhanh hơn. Điều này là do xúc tác cung cấp một con đường phản ứng thay thế với năng lượng hoạt hóa thấp hơn.
9. Các Biện Pháp Phòng Ngừa Tai Nạn Khi Sử Dụng KClO3
Để đảm bảo an toàn khi sử dụng KClO3, cần tuân thủ các biện pháp phòng ngừa tai nạn sau:
9.1. Tránh Va Đập Mạnh
KClO3 có thể phát nổ khi bị va đập mạnh hoặc ma sát. Vì vậy, cần xử lý cẩn thận và tránh va đập mạnh vào KClO3.
9.2. Tránh Tiếp Xúc Với Các Chất Dễ Cháy
KClO3 là một chất oxy hóa mạnh và có thể gây cháy nổ khi tiếp xúc với các chất dễ cháy như nhiên liệu, dầu mỡ, và các chất hữu cơ. Cần lưu trữ và sử dụng KClO3 ở nơi khô ráo, thoáng mát và tránh xa các chất dễ cháy.
9.3. Sử Dụng Thiết Bị Bảo Hộ
Khi làm việc với KClO3, cần sử dụng đầy đủ các thiết bị bảo hộ cá nhân như kính bảo hộ, găng tay, và áo choàng phòng thí nghiệm để bảo vệ mắt và da khỏi tiếp xúc trực tiếp với KClO3.
9.4. Đọc Kỹ Hướng Dẫn Sử Dụng
Trước khi sử dụng KClO3, cần đọc kỹ hướng dẫn sử dụng và tuân thủ các quy định an toàn của nhà sản xuất.
10. Giải Đáp Các Câu Hỏi Thường Gặp Về KClO3 (FAQ)
10.1. Nhiệt độ nào KClO3 bắt đầu phân hủy?
KClO3 bắt đầu phân hủy ở khoảng 400°C, nhưng có thể phân hủy ở nhiệt độ thấp hơn (khoảng 200°C) khi có mặt chất xúc tác như MnO2.
10.2. KClO3 có độc không?
KClO3 có độc và có thể gây kích ứng da, mắt và đường hô hấp. Nuốt phải KClO3 có thể gây ngộ độc.
10.3. MnO2 có vai trò gì trong phản ứng phân hủy KClO3?
MnO2 là chất xúc tác, giúp giảm năng lượng hoạt hóa của phản ứng, làm cho phản ứng xảy ra ở nhiệt độ thấp hơn và nhanh hơn.
10.4. KClO3 được sử dụng để làm gì?
KClO3 được sử dụng trong điều chế oxy, sản xuất pháo hoa, diêm, và một số ứng dụng y tế.
10.5. Làm thế nào để lưu trữ KClO3 an toàn?
KClO3 nên được lưu trữ ở nơi khô ráo, thoáng mát, tránh xa các chất dễ cháy và trong các容器 kín.
10.6. Phản ứng phân hủy KClO3 tạo ra những chất gì?
Phản ứng phân hủy KClO3 tạo ra kali clorua (KCl) và oxy (O2).
10.7. Tại sao cần sử dụng thiết bị bảo hộ khi làm việc với KClO3?
Thiết bị bảo hộ giúp bảo vệ mắt, da và đường hô hấp khỏi tiếp xúc trực tiếp với KClO3, giảm nguy cơ tai nạn và ngộ độc.
10.8. KClO3 có thể gây nổ không?
KClO3 có thể gây nổ khi tiếp xúc với các chất dễ cháy hoặc khi bị va đập mạnh.
10.9. Làm thế nào để xử lý KClO3 đã qua sử dụng?
KClO3 đã qua sử dụng cần được xử lý theo quy định của địa phương và quốc gia về xử lý chất thải hóa học.
10.10. Có thể điều chế KClO3 tại nhà không?
Việc điều chế KClO3 tại nhà không được khuyến khích do tính chất nguy hiểm và yêu cầu kỹ thuật cao của quá trình này.
Bạn đang tìm kiếm thông tin chi tiết và đáng tin cậy về xe tải ở Mỹ Đình? Hãy truy cập XETAIMYDINH.EDU.VN ngay hôm nay để được tư vấn và giải đáp mọi thắc mắc của bạn! Địa chỉ: Số 18 đường Mỹ Đình, phường Mỹ Đình 2, quận Nam Từ Liêm, Hà Nội. Hotline: 0247 309 9988.