SO3 là oxit axit, được ứng dụng rộng rãi trong công nghiệp. Bài viết này của Xe Tải Mỹ Đình sẽ cung cấp thông tin chi tiết về SO3, từ định nghĩa, tính chất, ứng dụng đến các phản ứng hóa học quan trọng. Khám phá ngay để hiểu rõ hơn về hợp chất quan trọng này và tìm hiểu về các sản phẩm xe tải chất lượng cao mà chúng tôi cung cấp.
1. SO3 Là Gì? Lưu Huỳnh Trioxit Là Gì?
SO3, hay lưu huỳnh trioxit, là một oxit axit quan trọng, hợp chất vô cơ với công thức hóa học SO3. Ở điều kiện thường, SO3 tồn tại ở dạng lỏng không màu, tan vô hạn trong nước và axit sulfuric. Lưu huỳnh trioxit không gây ăn mòn kim loại và là một tác nhân gây ô nhiễm không khí nghiêm trọng, góp phần vào hiện tượng mưa axit. SO3 được sản xuất quy mô lớn để phục vụ sản xuất axit sulfuric (H2SO4).
 Cấu trúc phân tử SO3
Cấu trúc phân tử SO3
Cấu trúc phân tử SO3 thể hiện liên kết giữa lưu huỳnh và oxi
1.1. Các Dạng Tồn Tại Của SO3
Lưu huỳnh trioxit (SO3) có thể tồn tại ở nhiều dạng thù hình khác nhau, tùy thuộc vào điều kiện nhiệt độ và áp suất. Các dạng thù hình phổ biến nhất của SO3 bao gồm:
-
SO3 dạng khí: Ở nhiệt độ cao (trên 45°C), SO3 tồn tại dưới dạng phân tử đơn lẻ SO3. Trong pha khí, phân tử SO3 có cấu trúc phẳng, với nguyên tử lưu huỳnh ở trung tâm và ba nguyên tử oxy liên kết xung quanh.
-
SO3 dạng lỏng: Khi làm lạnh xuống dưới 45°C, các phân tử SO3 bắt đầu liên kết với nhau tạo thành các oligomer, thường là trimer vòng (S3O9). Dạng lỏng này có độ nhớt cao hơn so với dạng khí.
-
SO3 dạng rắn: Ở nhiệt độ thấp hơn nữa, SO3 có thể tồn tại ở nhiều dạng polyme khác nhau, bao gồm dạng α-SO3, β-SO3 và γ-SO3. Các dạng polyme này có cấu trúc phức tạp hơn, với các chuỗi SO3 liên kết với nhau tạo thành mạng lưới không gian ba chiều.
- α-SO3: Dạng này có cấu trúc tinh thể hình kim, là polyme vòng với công thức (SO3)n.
- β-SO3: Dạng này có cấu trúc giống amiăng, cũng là polyme nhưng có cấu trúc khác α-SO3.
- γ-SO3: Dạng này là một chất rắn vô định hình, hỗn hợp của các polyme khác nhau.
1.2. Tính Chất Vật Lý Của Lưu Huỳnh Trioxit
Dưới đây là bảng tổng hợp các tính chất vật lý quan trọng của lưu huỳnh trioxit (SO3):
| Tính Chất | Giá Trị |
|---|---|
| Trạng thái | Lỏng (ở điều kiện thường) |
| Màu sắc | Không màu |
| Mùi | Hắc, khó chịu |
| Khối lượng mol | 80.06 g/mol |
| Điểm nóng chảy | 16.8 °C (289.9 K; 62.2 °F) |
| Điểm sôi | 45 °C (318 K; 113 °F) |
| Độ hòa tan trong nước | Tan vô hạn, phản ứng mạnh tạo thành axit sulfuric (H2SO4) |
| Độ nhớt | Thay đổi tùy theo dạng thù hình (khí, lỏng, rắn); dạng lỏng có độ nhớt cao hơn dạng khí |
| Áp suất hơi | Cao ở nhiệt độ phòng, dễ bay hơi |
| Khối lượng riêng | 1.92 g/cm³ (ở 20 °C) |
| Cấu trúc phân tử | Phẳng (dạng khí), vòng hoặc polyme (dạng lỏng và rắn) |
| Tính hút ẩm | Rất háo nước, hấp thụ hơi ẩm từ không khí để tạo thành axit sulfuric |
| Ăn mòn | Không ăn mòn kim loại trực tiếp, nhưng sản phẩm phản ứng với nước (H2SO4) có tính ăn mòn mạnh |
| Độ bền hóa học | Kém bền, dễ dàng tham gia vào các phản ứng hóa học |
| Các dạng thù hình | Khí (SO3), lỏng (trimer vòng S3O9), rắn (α-SO3, β-SO3, γ-SO3) |
| Nguy hiểm | Gây kích ứng mạnh cho da, mắt và hệ hô hấp; phản ứng mạnh với nước tạo ra nhiệt lớn và axit sulfuric ăn mòn; là một chất ô nhiễm không khí |
1.3. Cấu Trúc Phân Tử Của SO3
Cấu trúc phân tử của SO3 phụ thuộc vào trạng thái vật lý của nó. Ở trạng thái khí, SO3 tồn tại dưới dạng phân tử đơn lẻ có cấu trúc phẳng, với nguyên tử lưu huỳnh (S) nằm ở trung tâm và ba nguyên tử oxy (O) liên kết xung quanh. Các liên kết S=O là liên kết đôi, và phân tử SO3 có tính cộng hưởng, với các điện tích âm được phân bố đều trên ba nguyên tử oxy.
Mô hình 3D của phân tử SO3
Trong trạng thái lỏng và rắn, các phân tử SO3 có xu hướng liên kết với nhau để tạo thành các cấu trúc polyme phức tạp hơn. Dạng phổ biến nhất là trimer vòng (S3O9), trong đó ba phân tử SO3 liên kết với nhau tạo thành một vòng sáu cạnh. Các dạng polyme khác cũng tồn tại, với các chuỗi SO3 liên kết với nhau thông qua các liên kết oxy.
Cấu trúc phân tử của SO3 quyết định các tính chất hóa học và vật lý của nó, bao gồm khả năng phản ứng mạnh với nước để tạo thành axit sulfuric, tính hút ẩm cao và khả năng tạo thành các dạng polyme khác nhau.
2. Vì Sao SO3 Là Oxit Axit?
SO3 được xác định là một oxit axit do những đặc điểm sau:
- Nguyên tố tạo thành: SO3 được tạo thành từ lưu huỳnh (S), một phi kim. Oxit của phi kim thường là oxit axit.
- Trạng thái oxi hóa: Lưu huỳnh trong SO3 có trạng thái oxi hóa +6, là trạng thái oxi hóa cao, thể hiện tính axit mạnh.
- Phản ứng với nước: SO3 phản ứng mạnh với nước tạo thành axit sulfuric (H2SO4), một axit mạnh, chứng minh tính chất axit của nó.
2.1. Giải Thích Chi Tiết Về Tính Axit Của SO3
Để hiểu rõ hơn về tính axit của SO3, chúng ta cần xem xét cấu trúc phân tử và khả năng phản ứng của nó.
-
Cấu trúc phân tử: SO3 có cấu trúc phân tử phẳng, với nguyên tử lưu huỳnh (S) ở trung tâm và ba nguyên tử oxy (O) liên kết xung quanh. Các liên kết S=O là liên kết cộng hóa trị phân cực, do oxy có độ âm điện lớn hơn lưu huỳnh. Điều này tạo ra sự phân bố điện tích không đều trong phân tử, với các nguyên tử oxy mang điện tích âm một phần (δ-) và nguyên tử lưu huỳnh mang điện tích dương một phần (δ+).
-
Khả năng phản ứng với nước: Do sự phân cực của các liên kết S=O, phân tử SO3 dễ dàng bị tấn công bởi các tác nhân ái lực điện tử (nucleophile), chẳng hạn như nước (H2O). Khi SO3 phản ứng với nước, nguyên tử oxy trong phân tử nước tấn công nguyên tử lưu huỳnh trong SO3, tạo thành axit sulfuric (H2SO4).
- Phản ứng hóa học: SO3 + H2O → H2SO4
-
Tính chất của axit sulfuric: Axit sulfuric (H2SO4) là một axit mạnh, có khả năng phân ly hoàn toàn trong nước để tạo thành các ion hydronium (H3O+) và ion sunfat (SO42-). Sự có mặt của các ion hydronium làm cho dung dịch có tính axit.
2.2. So Sánh SO3 Với Các Oxit Khác
Để hiểu rõ hơn về tính axit của SO3, chúng ta có thể so sánh nó với các oxit khác, chẳng hạn như oxit bazơ và oxit lưỡng tính.
- Oxit bazơ: Oxit bazơ là oxit của kim loại, chẳng hạn như natri oxit (Na2O) hoặc canxi oxit (CaO). Các oxit này phản ứng với nước để tạo thành bazơ, hoặc phản ứng với axit để tạo thành muối và nước.
- Oxit lưỡng tính: Oxit lưỡng tính là oxit có thể phản ứng cả với axit và bazơ, chẳng hạn như nhôm oxit (Al2O3) hoặc kẽm oxit (ZnO). Các oxit này có tính chất trung gian giữa oxit axit và oxit bazơ.
So với oxit bazơ và oxit lưỡng tính, SO3 có tính axit mạnh hơn nhiều. Nó không phản ứng với bazơ để tạo thành muối và nước, mà thay vào đó, nó phản ứng mạnh với nước để tạo thành axit sulfuric, một axit mạnh.
2.3. Tại Sao Việc Xác Định SO3 Là Oxit Axit Quan Trọng?
Việc xác định SO3 là một oxit axit có ý nghĩa quan trọng trong nhiều lĩnh vực, bao gồm:
- Công nghiệp hóa chất: SO3 là một nguyên liệu quan trọng trong sản xuất axit sulfuric, một hóa chất công nghiệp quan trọng được sử dụng trong sản xuất phân bón, chất tẩy rửa, thuốc nhuộm và nhiều sản phẩm khác.
- Môi trường: SO3 là một chất ô nhiễm không khí, góp phần vào sự hình thành mưa axit. Việc hiểu rõ về tính chất axit của SO3 giúp chúng ta phát triển các biện pháp kiểm soát ô nhiễm và bảo vệ môi trường.
- Nghiên cứu khoa học: SO3 là một hợp chất quan trọng trong hóa học, được sử dụng trong nhiều nghiên cứu khoa học để điều chế các hợp chất khác và nghiên cứu các phản ứng hóa học.
3. SO3 Tác Dụng Với Chất Nào?
Lưu huỳnh trioxit (SO3) là một chất phản ứng mạnh và có thể tác dụng với nhiều chất khác nhau, bao gồm:
- Nước (H2O): Phản ứng mạnh tạo thành axit sulfuric (H2SO4).
- Bazơ: Phản ứng với bazơ tạo thành muối sunfat và nước.
- Oxit bazơ: Phản ứng với oxit bazơ tạo thành muối sunfat.
- Hợp chất hữu cơ: Tham gia vào các phản ứng sulfon hóa để tạo thành các hợp chất sulfonic acid.
3.1. Phản Ứng Của SO3 Với Nước
Phản ứng giữa SO3 và nước là một phản ứng tỏa nhiệt mạnh, tạo ra axit sulfuric (H2SO4). Phản ứng này được sử dụng rộng rãi trong công nghiệp để sản xuất axit sulfuric.
- Phương trình hóa học: SO3(g) + H2O(l) → H2SO4(l) ΔH = -88 kJ/mol
- Cơ chế phản ứng: Phản ứng xảy ra theo cơ chế ái lực điện tử, trong đó nguyên tử oxy trong phân tử nước tấn công nguyên tử lưu huỳnh trong phân tử SO3.
- Ứng dụng: Phản ứng này được sử dụng trong sản xuất axit sulfuric, một hóa chất công nghiệp quan trọng được sử dụng trong sản xuất phân bón, chất tẩy rửa, thuốc nhuộm và nhiều sản phẩm khác.
3.2. Phản Ứng Của SO3 Với Bazơ
SO3 phản ứng với bazơ tạo thành muối sunfat và nước. Phản ứng này là một phản ứng trung hòa, trong đó axit SO3 phản ứng với bazơ để tạo thành muối và nước.
- Ví dụ: SO3 + 2NaOH → Na2SO4 + H2O
- Ứng dụng: Phản ứng này có thể được sử dụng để loại bỏ SO3 khỏi khí thải công nghiệp, hoặc để điều chế các muối sunfat khác nhau.
3.3. Phản Ứng Của SO3 Với Oxit Bazơ
SO3 phản ứng với oxit bazơ tạo thành muối sunfat. Phản ứng này tương tự như phản ứng giữa SO3 và bazơ, nhưng thay vì bazơ, SO3 phản ứng với oxit của kim loại.
- Ví dụ: SO3 + CaO → CaSO4
- Ứng dụng: Phản ứng này có thể được sử dụng để sản xuất xi măng, hoặc để loại bỏ SO3 khỏi khí thải công nghiệp.
3.4. Phản Ứng Của SO3 Với Hợp Chất Hữu Cơ
SO3 có thể tham gia vào các phản ứng sulfon hóa với các hợp chất hữu cơ, tạo thành các hợp chất sulfonic acid. Các hợp chất sulfonic acid được sử dụng rộng rãi trong sản xuất chất tẩy rửa, thuốc nhuộm và dược phẩm.
- Ví dụ: Phản ứng sulfon hóa benzen: C6H6 + SO3 → C6H5SO3H
- Ứng dụng: Phản ứng sulfon hóa được sử dụng để sản xuất chất tẩy rửa, thuốc nhuộm và dược phẩm.
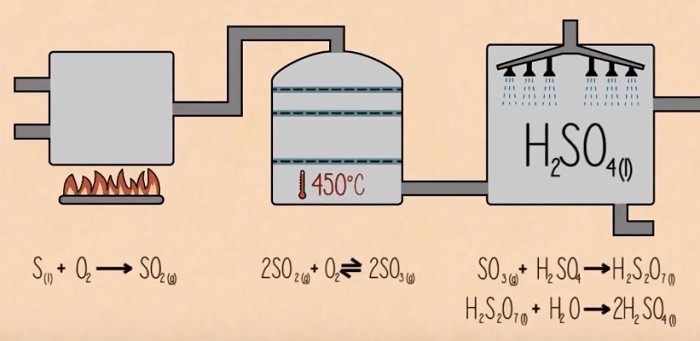
Sơ đồ sản xuất axit sunfuric từ SO3
4. Ứng Dụng Quan Trọng Của SO3
Lưu huỳnh trioxit (SO3) có nhiều ứng dụng quan trọng trong các ngành công nghiệp khác nhau, chủ yếu nhờ vào khả năng phản ứng mạnh mẽ và tính chất axit của nó. Dưới đây là một số ứng dụng chính:
- Sản xuất axit sulfuric (H2SO4): Đây là ứng dụng quan trọng nhất của SO3. Axit sulfuric là một hóa chất công nghiệp cơ bản, được sử dụng rộng rãi trong sản xuất phân bón, chất tẩy rửa, thuốc nhuộm, sợi tổng hợp, và nhiều sản phẩm khác.
- Sản xuất chất tẩy rửa: SO3 được sử dụng để sulfon hóa các hợp chất hữu cơ, tạo ra các chất hoạt động bề mặt dùng trong chất tẩy rửa.
- Sản xuất thuốc nhuộm: SO3 được sử dụng trong quá trình tổng hợp nhiều loại thuốc nhuộm khác nhau, đặc biệt là thuốc nhuộm azo.
- Sản xuất dược phẩm: SO3 được sử dụng trong sản xuất một số loại dược phẩm, chẳng hạn như các loại thuốc kháng sinh và thuốc chống viêm.
- Xử lý nước: SO3 được sử dụng để điều chỉnh độ pH của nước và loại bỏ các chất ô nhiễm.
- Sản xuất giấy: SO3 được sử dụng trong quá trình tẩy trắng bột giấy để sản xuất giấy trắng.
- Ngành công nghiệp dầu mỏ: SO3 được sử dụng trong quá trình tinh chế dầu mỏ để loại bỏ các tạp chất.
- Chất xúc tác: SO3 được sử dụng làm chất xúc tác trong một số phản ứng hóa học.
4.1. SO3 Trong Sản Xuất Axit Sunfuric
Axit sulfuric (H2SO4) là một trong những hóa chất công nghiệp quan trọng nhất trên thế giới, với sản lượng hàng năm lên tới hàng trăm triệu tấn. Axit sulfuric được sử dụng trong rất nhiều ứng dụng khác nhau, bao gồm sản xuất phân bón, chất tẩy rửa, thuốc nhuộm, sợi tổng hợp, và nhiều sản phẩm khác.
Quá trình sản xuất axit sulfuric thường bao gồm ba giai đoạn chính:
- Đốt lưu huỳnh hoặc quặng pyrite: Lưu huỳnh (S) hoặc quặng pyrite (FeS2) được đốt cháy trong không khí để tạo ra khí lưu huỳnh đioxit (SO2).
- Oxi hóa SO2 thành SO3: Khí SO2 được oxi hóa thành khí SO3 bằng cách sử dụng chất xúc tác vanadi pentoxit (V2O5).
- Hấp thụ SO3 vào axit sulfuric: Khí SO3 được hấp thụ vào axit sulfuric đậm đặc để tạo ra axit oleum (H2S2O7), sau đó được pha loãng với nước để tạo ra axit sulfuric với nồng độ mong muốn.
Phản ứng quan trọng nhất trong quá trình sản xuất axit sulfuric là phản ứng oxi hóa SO2 thành SO3:
- Phương trình hóa học: 2SO2(g) + O2(g) ⇌ 2SO3(g) ΔH = -197 kJ/mol
Phản ứng này là một phản ứng thuận nghịch và tỏa nhiệt, do đó cần phải được thực hiện ở nhiệt độ thấp và áp suất cao để đạt được hiệu suất cao. Chất xúc tác vanadi pentoxit (V2O5) được sử dụng để tăng tốc độ phản ứng.
4.2. SO3 Trong Sản Xuất Chất Tẩy Rửa
SO3 được sử dụng rộng rãi trong sản xuất chất tẩy rửa, đặc biệt là chất tẩy rửa tổng hợp. SO3 được sử dụng để sulfon hóa các hợp chất hữu cơ, tạo ra các chất hoạt động bề mặt có khả năng làm giảm sức căng bề mặt của nước và giúp loại bỏ bụi bẩn và dầu mỡ.
Quá trình sulfon hóa thường được thực hiện bằng cách cho SO3 phản ứng với các hợp chất hữu cơ như alkylbenzen hoặc alcohol béo. Phản ứng tạo ra các axit sulfonic, sau đó được trung hòa bằng bazơ để tạo ra các muối sulfonat, là thành phần chính của chất tẩy rửa.
-
Ví dụ: Sản xuất alkylbenzen sulfonat (ABS), một chất hoạt động bề mặt phổ biến trong chất tẩy rửa:
- C12H25-C6H5 + SO3 → C12H25-C6H4-SO3H
- C12H25-C6H4-SO3H + NaOH → C12H25-C6H4-SO3Na + H2O
4.3. SO3 Trong Các Ứng Dụng Khác
Ngoài các ứng dụng chính trong sản xuất axit sulfuric và chất tẩy rửa, SO3 còn được sử dụng trong nhiều ứng dụng khác, bao gồm:
- Sản xuất thuốc nhuộm: SO3 được sử dụng trong quá trình tổng hợp nhiều loại thuốc nhuộm khác nhau, đặc biệt là thuốc nhuộm azo. Thuốc nhuộm azo là một loại thuốc nhuộm tổng hợp quan trọng, được sử dụng rộng rãi trong ngành dệt may để nhuộm vải và sợi.
- Sản xuất dược phẩm: SO3 được sử dụng trong sản xuất một số loại dược phẩm, chẳng hạn như các loại thuốc kháng sinh và thuốc chống viêm. Các hợp chất sulfonic acid được sử dụng làm chất trung gian trong quá trình tổng hợp các loại thuốc này.
- Xử lý nước: SO3 được sử dụng để điều chỉnh độ pH của nước và loại bỏ các chất ô nhiễm. SO3 có thể được sử dụng để khử trùng nước bằng cách tạo ra axit sulfuric, có khả năng tiêu diệt vi khuẩn và virus.
- Sản xuất giấy: SO3 được sử dụng trong quá trình tẩy trắng bột giấy để sản xuất giấy trắng. SO3 giúp loại bỏ lignin, một chất màu có trong gỗ, làm cho giấy trở nên trắng hơn.
- Ngành công nghiệp dầu mỏ: SO3 được sử dụng trong quá trình tinh chế dầu mỏ để loại bỏ các tạp chất. SO3 có thể được sử dụng để loại bỏ các hợp chất lưu huỳnh có trong dầu mỏ, giúp cải thiện chất lượng của sản phẩm dầu mỏ.
- Chất xúc tác: SO3 được sử dụng làm chất xúc tác trong một số phản ứng hóa học. SO3 có thể được sử dụng để xúc tác các phản ứng sulfon hóa, este hóa và các phản ứng khác.
5. Ảnh Hưởng Của SO3 Đến Môi Trường Và Sức Khỏe
Mặc dù có nhiều ứng dụng quan trọng trong công nghiệp, SO3 cũng là một chất gây ô nhiễm môi trường và có thể gây hại cho sức khỏe con người.
- Ô nhiễm không khí: SO3 là một chất ô nhiễm không khí, góp phần vào sự hình thành mưa axit và sương mù axit. Mưa axit có thể gây hại cho các hệ sinh thái, ăn mòn các công trình xây dựng và gây ra các vấn đề về sức khỏe cho con người.
- Ảnh hưởng đến sức khỏe: SO3 có thể gây kích ứng da, mắt và hệ hô hấp. Tiếp xúc lâu dài với SO3 có thể gây ra các vấn đề về hô hấp, chẳng hạn như viêm phế quản và hen suyễn.
5.1. SO3 Và Mưa Axit
Mưa axit là một vấn đề môi trường nghiêm trọng, gây ra bởi sự ô nhiễm không khí bởi các chất như lưu huỳnh đioxit (SO2) và nitơ oxit (NOx). SO2 có thể bị oxi hóa thành SO3 trong không khí, sau đó SO3 phản ứng với nước để tạo thành axit sulfuric (H2SO4), một trong những thành phần chính của mưa axit.
Mưa axit có thể gây ra nhiều tác động tiêu cực đến môi trường, bao gồm:
- Gây hại cho các hệ sinh thái: Mưa axit có thể làm giảm độ pH của đất và nước, gây hại cho các loài thực vật và động vật.
- Ăn mòn các công trình xây dựng: Mưa axit có thể ăn mòn các công trình xây dựng bằng đá vôi hoặc đá cẩm thạch, gây ra sự xuống cấp của các di tích lịch sử và các tòa nhà.
- Gây ra các vấn đề về sức khỏe: Mưa axit có thể gây ra các vấn đề về hô hấp cho con người, đặc biệt là những người mắc bệnh hen suyễn hoặc các bệnh phổi khác.
5.2. Các Biện Pháp Giảm Thiểu Tác Động Của SO3
Để giảm thiểu tác động tiêu cực của SO3 đến môi trường và sức khỏe con người, cần thực hiện các biện pháp sau:
- Giảm thiểu khí thải SO2: Các nhà máy công nghiệp cần sử dụng các công nghệ để giảm thiểu khí thải SO2, chẳng hạn như sử dụng các chất hấp thụ SO2 hoặc các bộ lọc khí thải.
- Sử dụng nhiên liệu sạch: Cần khuyến khích sử dụng nhiên liệu sạch, chẳng hạn như khí tự nhiên hoặc năng lượng tái tạo, để giảm thiểu lượng SO2 thải ra từ các nhà máy điện và các phương tiện giao thông.
- Cải thiện hiệu quả sử dụng năng lượng: Cần cải thiện hiệu quả sử dụng năng lượng trong các ngành công nghiệp và giao thông vận tải để giảm thiểu lượng nhiên liệu cần đốt cháy và lượng SO2 thải ra.
- Sử dụng các biện pháp xử lý khí thải: Các nhà máy công nghiệp cần sử dụng các biện pháp xử lý khí thải để loại bỏ SO3 trước khi thải ra môi trường.
- Nâng cao nhận thức cộng đồng: Cần nâng cao nhận thức cộng đồng về tác hại của SO3 và các biện pháp giảm thiểu tác động của nó.
6. So Sánh SO2 và SO3
Lưu huỳnh đioxit (SO2) và lưu huỳnh trioxit (SO3) là hai oxit phổ biến của lưu huỳnh, nhưng chúng có những tính chất và ứng dụng khác nhau. Dưới đây là bảng so sánh chi tiết giữa SO2 và SO3:
| Tính Chất | Lưu Huỳnh Đioxit (SO2) | Lưu Huỳnh Trioxit (SO3) |
|---|---|---|
| Trạng thái vật lý | Khí không màu ở điều kiện thường | Chất lỏng không màu, dễ bay hơi thành khí |
| Mùi | Hắc, khó chịu | Hắc, khó chịu |
| Độ tan trong nước | Tan được trong nước, tạo thành axit sunfurơ (H2SO3) | Tan vô hạn trong nước, phản ứng mạnh tạo thành axit sulfuric (H2SO4) |
| Tính axit | Oxit axit yếu, tạo thành axit yếu khi tan trong nước | Oxit axit mạnh, tạo thành axit mạnh khi tan trong nước |
| Tính oxi hóa – khử | Vừa có tính oxi hóa, vừa có tính khử | Có tính oxi hóa mạnh |
| Ứng dụng | – Sản xuất axit sulfuric (qua giai đoạn trung gian SO3) – Tẩy trắng bột giấy, vải sợi – Chất bảo quản thực phẩm (chống nấm mốc) – Khử trùng | – Sản xuất axit sulfuric (H2SO4) – Chất sulfon hóa trong sản xuất chất tẩy rửa, thuốc nhuộm – Chất trung gian trong nhiều quá trình hóa học |
| Tác động môi trường | – Gây ô nhiễm không khí, góp phần vào mưa axit – Gây hại cho hệ hô hấp | – Gây ô nhiễm không khí, góp phần vào mưa axit (mạnh hơn SO2) – Gây kích ứng mạnh cho da, mắt, hệ hô hấp |
| Điều chế | – Đốt lưu huỳnh hoặc quặng sulfide – Trong công nghiệp: đốt lưu huỳnh, đốt quặng pyrite (FeS2), từ khí thải công nghiệp | – Oxi hóa SO2 bằng O2 xúc tác V2O5 ở nhiệt độ cao – Trong công nghiệp: oxi hóa SO2 từ quá trình đốt lưu huỳnh hoặc quặng pyrite |
| Công thức hóa học | SO2 | SO3 |
| Khối lượng mol | 64.06 g/mol | 80.06 g/mol |
| Cấu trúc phân tử | Phân tử góc, với một cặp electron tự do trên nguyên tử S | Phân tử phẳng, đối xứng |
| Trạng thái oxi hóa của S | +4 | +6 |
7. Các Câu Hỏi Thường Gặp Về SO3 (FAQ)
Dưới đây là một số câu hỏi thường gặp về SO3, giúp bạn hiểu rõ hơn về hợp chất này:
Câu 1: SO3 là gì?
Trả lời: SO3 là lưu huỳnh trioxit, một oxit axit quan trọng của lưu huỳnh, có công thức hóa học SO3.
Câu 2: SO3 có những tính chất vật lý nào nổi bật?
Trả lời: SO3 là chất lỏng không màu ở điều kiện thường, có mùi hắc, tan vô hạn trong nước và phản ứng mạnh với nước để tạo thành axit sulfuric.
Câu 3: Tại sao SO3 được coi là một oxit axit?
Trả lời: SO3 là oxit axit vì nó được tạo thành từ phi kim (lưu huỳnh), có trạng thái oxi hóa cao (+6) và phản ứng mạnh với nước tạo thành axit sulfuric.
Câu 4: SO3 tác dụng với những chất nào?
Trả lời: SO3 tác dụng với nước, bazơ, oxit bazơ và các hợp chất hữu cơ.
Câu 5: SO3 có những ứng dụng quan trọng nào trong công nghiệp?
Trả lời: SO3 được sử dụng chủ yếu trong sản xuất axit sulfuric, chất tẩy rửa, thuốc nhuộm, dược phẩm và nhiều ngành công nghiệp khác.
Câu 6: SO3 gây ảnh hưởng gì đến môi trường?
Trả lời: SO3 là một chất ô nhiễm không khí, góp phần vào sự hình thành mưa axit và có thể gây hại cho các hệ sinh thái.
Câu 7: SO3 có gây hại cho sức khỏe con người không?
Trả lời: Có, SO3 có thể gây kích ứng da, mắt và hệ hô hấp, tiếp xúc lâu dài có thể gây ra các vấn đề về hô hấp.
Câu 8: Làm thế nào để giảm thiểu tác động tiêu cực của SO3 đến môi trường?
Trả lời: Các biện pháp bao gồm giảm thiểu khí thải SO2, sử dụng nhiên liệu sạch, cải thiện hiệu quả sử dụng năng lượng và sử dụng các biện pháp xử lý khí thải.
Câu 9: Sự khác biệt chính giữa SO2 và SO3 là gì?
Trả lời: SO2 là lưu huỳnh đioxit, một oxit axit yếu, trong khi SO3 là lưu huỳnh trioxit, một oxit axit mạnh hơn. SO3 có tính oxi hóa mạnh hơn và được sử dụng chủ yếu trong sản xuất axit sulfuric.
Câu 10: SO3 có vai trò gì trong sản xuất chất tẩy rửa?
Trả lời: SO3 được sử dụng để sulfon hóa các hợp chất hữu cơ, tạo ra các chất hoạt động bề mặt dùng trong chất tẩy rửa.
8. Xe Tải Mỹ Đình – Đối Tác Tin Cậy Cho Giải Pháp Vận Tải Của Bạn
Hiểu rõ về các hợp chất hóa học như SO3 giúp chúng ta có cái nhìn sâu sắc hơn về các quy trình công nghiệp và tác động của chúng đến môi trường. Tại Xe Tải Mỹ Đình, chúng tôi luôn nỗ lực cung cấp những giải pháp vận tải tối ưu, thân thiện với môi trường và đáp ứng mọi nhu cầu của khách hàng.
Nếu bạn đang tìm kiếm một chiếc xe tải chất lượng, bền bỉ và hiệu quả, hãy đến với Xe Tải Mỹ Đình. Chúng tôi cung cấp đa dạng các dòng xe tải từ các thương hiệu uy tín, cùng với dịch vụ tư vấn chuyên nghiệp và hỗ trợ kỹ thuật tận tình.
Liên hệ ngay với Xe Tải Mỹ Đình để được tư vấn và trải nghiệm dịch vụ tốt nhất:
- Địa chỉ: Số 18 đường Mỹ Đình, phường Mỹ Đình 2, quận Nam Từ Liêm, Hà Nội
- Hotline: 0247 309 9988
- Trang web: XETAIMYDINH.EDU.VN
Xe Tải Mỹ Đình cam kết mang đến cho bạn những sản phẩm và dịch vụ chất lượng, góp phần vào sự thành công và phát triển bền vững của doanh nghiệp bạn.

