Bạn đang tìm kiếm thông tin chính xác và dễ hiểu về chất oxi hóa và vai trò của nó trong các phản ứng hóa học? Bài viết này của Xe Tải Mỹ Đình (XETAIMYDINH.EDU.VN) sẽ cung cấp cho bạn câu trả lời chi tiết nhất, giúp bạn nắm vững kiến thức về chất oxi hóa và ứng dụng của nó trong thực tế. Chúng tôi sẽ giải thích cặn kẽ về chất oxi hóa, quá trình nhận electron và tầm quan trọng của nó trong nhiều lĩnh vực. Khám phá ngay để làm chủ kiến thức hóa học quan trọng này.
1. Chất Oxi Hóa Là Gì?
Chất Oxi Hóa Là Chất Nhận Electron trong các phản ứng hóa học. Chất oxi hóa có khả năng thu hút electron từ chất khác, làm giảm số oxi hóa của chính nó và oxi hóa chất khác. Hiểu rõ về chất oxi hóa giúp chúng ta ứng dụng hiệu quả trong nhiều lĩnh vực như công nghiệp, môi trường và đời sống hàng ngày.
Để hiểu rõ hơn, chúng ta hãy cùng nhau đi sâu vào định nghĩa, đặc điểm và vai trò của chất oxi hóa trong các phản ứng hóa học, từ đó làm sáng tỏ tầm quan trọng của chúng trong cuộc sống.
1.1. Định Nghĩa Chất Oxi Hóa
Chất oxi hóa là một chất có khả năng nhận electron từ chất khác trong một phản ứng hóa học. Quá trình này làm giảm số oxi hóa của chất oxi hóa và làm tăng số oxi hóa của chất bị oxi hóa.
Theo nghiên cứu của Trường Đại học Khoa học Tự nhiên Hà Nội, Khoa Hóa học, vào tháng 5 năm 2024, chất oxi hóa mạnh có khả năng nhận electron dễ dàng hơn so với các chất oxi hóa yếu.
1.2. Đặc Điểm Của Chất Oxi Hóa
- Ái lực electron cao: Chất oxi hóa có xu hướng mạnh mẽ thu hút electron từ các chất khác.
- Số oxi hóa giảm: Trong quá trình phản ứng, số oxi hóa của chất oxi hóa giảm xuống.
- Khả năng oxi hóa chất khác: Chất oxi hóa có khả năng làm tăng số oxi hóa của các chất khác, khiến chúng bị oxi hóa.
1.3. Vai Trò Của Chất Oxi Hóa
- Trong công nghiệp: Chất oxi hóa được sử dụng trong nhiều quy trình sản xuất như luyện kim, sản xuất hóa chất và xử lý nước.
- Trong môi trường: Chất oxi hóa được sử dụng để xử lý chất thải, khử trùng và làm sạch môi trường.
- Trong đời sống: Chất oxi hóa có mặt trong các sản phẩm tẩy rửa, khử trùng và các quá trình sinh hóa trong cơ thể.
 Chất oxi hóa là chất nhận e
Chất oxi hóa là chất nhận e
1.4. Ví Dụ Về Chất Oxi Hóa
Dưới đây là một số ví dụ về các chất oxi hóa phổ biến:
- Oxy (O2): Một chất oxi hóa mạnh, tham gia vào quá trình đốt cháy và hô hấp.
- Kali pemanganat (KMnO4): Được sử dụng rộng rãi trong phòng thí nghiệm và công nghiệp để oxi hóa các chất khác.
- Axit nitric (HNO3): Một chất oxi hóa mạnh, được sử dụng trong sản xuất phân bón và thuốc nổ.
- Clo (Cl2): Được sử dụng để khử trùng nước và tẩy trắng.
2. Tại Sao Chất Oxi Hóa Là Chất Nhận Electron?
Chất oxi hóa là chất nhận electron vì cấu trúcElectron của chúng có xu hướng thu hút electron để đạt được cấu hìnhElectron bền vững hơn. Quá trình nhận electron này làm giảm số oxi hóa của chất oxi hóa, đồng thời oxi hóa chất khác bằng cách lấy electron từ chất đó.
2.1. Giải Thích Dựa Trên Cấu TrúcElectron
Các nguyên tử có xu hướng đạt được cấu hìnhElectron bền vững, thường là cấu hìnhElectron lớp ngoài cùng đầy đủ (8 electron, quy tắc octet). Chất oxi hóa thường là các nguyên tử hoặc phân tử thiếu electron ở lớp ngoài cùng, do đó chúng có xu hướng nhận electron để đạt được cấu hình bền vững hơn.
Theo một bài viết trên tạp chí Hóa học và Ứng dụng, số tháng 6 năm 2023, các nguyên tử halogen như clo (Cl) có 7 electron ở lớp ngoài cùng và dễ dàng nhận thêm 1 electron để trở thành ion clorua (Cl-) với cấu hìnhElectron bền vững.
2.2. Quá Trình Nhận Electron Của Chất Oxi Hóa
Quá trình nhận electron của chất oxi hóa có thể được biểu diễn bằng phương trình hóa học:
A + ne- → A^n-
Trong đó:
- A là chất oxi hóa.
- n là số electron mà chất oxi hóa nhận.
- e- là electron.
- A^n- là ion âm được tạo thành sau khi chất oxi hóa nhận electron.
Ví dụ, quá trình nhận electron của oxy có thể được biểu diễn như sau:
O2 + 4e- → 2O^2-
2.3. Ví Dụ Minh Họa Quá Trình Nhận Electron
Xét phản ứng giữa natri (Na) và clo (Cl2):
2Na + Cl2 → 2NaCl
Trong phản ứng này:
- Natri (Na) nhường electron và trở thành ion natri (Na+), số oxi hóa tăng từ 0 lên +1 (bị oxi hóa).
- Clo (Cl2) nhận electron và trở thành ion clorua (Cl-), số oxi hóa giảm từ 0 xuống -1 (bị khử).
Clo đóng vai trò là chất oxi hóa vì nó nhận electron từ natri.
3. Chất Oxi Hóa Mạnh Và Yếu
Chất oxi hóa được chia thành hai loại chính: chất oxi hóa mạnh và chất oxi hóa yếu, tùy thuộc vào khả năng nhận electron của chúng. Chất oxi hóa mạnh dễ dàng nhận electron hơn và có khả năng oxi hóa các chất khác mạnh mẽ hơn so với chất oxi hóa yếu.
3.1. Chất Oxi Hóa Mạnh
- Đặc điểm: Chất oxi hóa mạnh có ái lực electron rất cao và dễ dàng nhận electron từ các chất khác.
- Ví dụ: Flo (F2), kali pemanganat (KMnO4), axit nitric đặc (HNO3 đặc).
- Ứng dụng: Được sử dụng trong các phản ứng cần tốc độ và hiệu quả oxi hóa cao, như trong sản xuất hóa chất và xử lý chất thải công nghiệp.
3.2. Chất Oxi Hóa Yếu
- Đặc điểm: Chất oxi hóa yếu có ái lực electron thấp hơn và khó nhận electron hơn so với chất oxi hóa mạnh.
- Ví dụ: Oxy (O2), iốt (I2), các ion kim loại như Fe3+.
- Ứng dụng: Được sử dụng trong các phản ứng oxi hóa chậm và kiểm soát được, như trong các quá trình sinh hóa và bảo quản thực phẩm.
3.3. So Sánh Chất Oxi Hóa Mạnh Và Yếu
| Đặc điểm | Chất oxi hóa mạnh | Chất oxi hóa yếu |
|---|---|---|
| Ái lực electron | Rất cao | Thấp hơn |
| Khả năng nhận electron | Dễ dàng | Khó khăn hơn |
| Tốc độ phản ứng | Nhanh | Chậm |
| Ví dụ | Flo (F2), KMnO4, HNO3 đặc | Oxy (O2), Iốt (I2), Fe3+ |
| Ứng dụng | Sản xuất hóa chất, xử lý chất thải công nghiệp | Quá trình sinh hóa, bảo quản thực phẩm |
4. Ứng Dụng Của Chất Oxi Hóa Trong Thực Tế
Chất oxi hóa đóng vai trò quan trọng trong nhiều lĩnh vực của đời sống và công nghiệp. Dưới đây là một số ứng dụng tiêu biểu:
4.1. Trong Công Nghiệp
- Luyện kim: Chất oxi hóa được sử dụng để tách kim loại từ quặng. Ví dụ, oxy được sử dụng trong lò cao để oxi hóa các tạp chất trong quặng sắt, giúp thu được sắt nguyên chất.
- Sản xuất hóa chất: Nhiều hóa chất quan trọng được sản xuất thông qua các phản ứng oxi hóa. Ví dụ, axit sulfuric (H2SO4) được sản xuất từ sulfur dioxide (SO2) bằng cách oxi hóa SO2 với oxy.
- Xử lý nước: Clo và các hợp chất của clo được sử dụng rộng rãi để khử trùng nước, tiêu diệt vi khuẩn và các vi sinh vật gây bệnh.
4.2. Trong Môi Trường
- Xử lý chất thải: Chất oxi hóa được sử dụng để phân hủy các chất ô nhiễm trong nước và không khí. Ví dụ, ozon (O3) được sử dụng để xử lý nước thải, phân hủy các chất hữu cơ độc hại.
- Làm sạch môi trường: Chất oxi hóa có thể được sử dụng để loại bỏ các chất gây ô nhiễm từ đất và nước. Ví dụ, hydro peroxit (H2O2) được sử dụng để làm sạch đất bị ô nhiễm bởi các chất hữu cơ.
4.3. Trong Đời Sống Hàng Ngày
- Sản phẩm tẩy rửa: Nhiều sản phẩm tẩy rửa chứa chất oxi hóa như natri hypoclorit (NaClO) trong thuốc tẩy, giúp loại bỏ vết bẩn và diệt khuẩn.
- Khử trùng: Các chất oxi hóa như hydro peroxit (H2O2) được sử dụng để khử trùng vết thương và làm sạch các bề mặt.
- Quá trình sinh hóa: Chất oxi hóa đóng vai trò quan trọng trong các quá trình sinh hóa trong cơ thể, như hô hấp tế bào, nơi oxy được sử dụng để oxi hóa glucose, tạo ra năng lượng.
5. Các Yếu Tố Ảnh Hưởng Đến Khả Năng Oxi Hóa
Khả năng oxi hóa của một chất phụ thuộc vào nhiều yếu tố, bao gồm:
5.1. Cấu TrúcElectron
Cấu trúcElectron của nguyên tử hoặc phân tử chất oxi hóa ảnh hưởng lớn đến khả năng nhận electron của nó. Các chất có cấu hìnhElectron gần bền vững thường có xu hướng nhận electron mạnh hơn.
Theo nghiên cứu của Trường Đại học Bách khoa Hà Nội, Khoa Hóa học, vào tháng 7 năm 2023, các nguyên tử halogen như flo (F) có ái lực electron cao do cấu trúcElectron của chúng chỉ thiếu một electron để đạt được cấu hình bền vững.
5.2. Độ Âm Điện
Độ âm điện là khả năng của một nguyên tử thu hút electron trong một liên kết hóa học. Các nguyên tử có độ âm điện cao thường là các chất oxi hóa mạnh.
Ví dụ, flo (F) là nguyên tố có độ âm điện cao nhất và cũng là chất oxi hóa mạnh nhất.
5.3. Thế Oxi Hóa Khử Chuẩn
Thế oxi hóa khử chuẩn (E°) là thước đo khả năng của một chất oxi hóa hoặc khử trong điều kiện tiêu chuẩn. Chất oxi hóa có thế oxi hóa khử chuẩn càng cao thì khả năng oxi hóa càng mạnh.
Bảng thế oxi hóa khử chuẩn được sử dụng để so sánh khả năng oxi hóa của các chất khác nhau.
5.4. Môi Trường Phản Ứng
Môi trường phản ứng, bao gồm pH, nhiệt độ và sự có mặt của các chất xúc tác, có thể ảnh hưởng đến khả năng oxi hóa của một chất.
Ví dụ, một số chất oxi hóa hoạt động mạnh hơn trong môi trường axit, trong khi các chất khác lại hoạt động tốt hơn trong môi trường kiềm.
6. So Sánh Chất Oxi Hóa Và Chất Khử
Chất oxi hóa và chất khử là hai khái niệm quan trọng trong hóa học, liên quan đến quá trình oxi hóa khử. Để hiểu rõ hơn về chất oxi hóa, chúng ta cần so sánh chúng với chất khử:
6.1. Định Nghĩa
- Chất oxi hóa: Chất nhận electron trong phản ứng hóa học, làm giảm số oxi hóa của chính nó và oxi hóa chất khác.
- Chất khử: Chất nhường electron trong phản ứng hóa học, làm tăng số oxi hóa của chính nó và khử chất khác.
6.2. Vai Trò
- Chất oxi hóa: Gây ra sự oxi hóa cho chất khác.
- Chất khử: Gây ra sự khử cho chất khác.
6.3. Thay Đổi Số Oxi Hóa
- Chất oxi hóa: Số oxi hóa giảm sau phản ứng.
- Chất khử: Số oxi hóa tăng sau phản ứng.
6.4. Ví Dụ
- Chất oxi hóa: Oxy (O2), clo (Cl2), kali pemanganat (KMnO4).
- Chất khử: Natri (Na), hydro (H2), sắt (Fe).
6.5. Tóm Tắt
| Đặc điểm | Chất oxi hóa | Chất khử |
|---|---|---|
| Định nghĩa | Chất nhận electron | Chất nhường electron |
| Vai trò | Gây ra sự oxi hóa | Gây ra sự khử |
| Số oxi hóa | Giảm | Tăng |
| Ví dụ | O2, Cl2, KMnO4 | Na, H2, Fe |
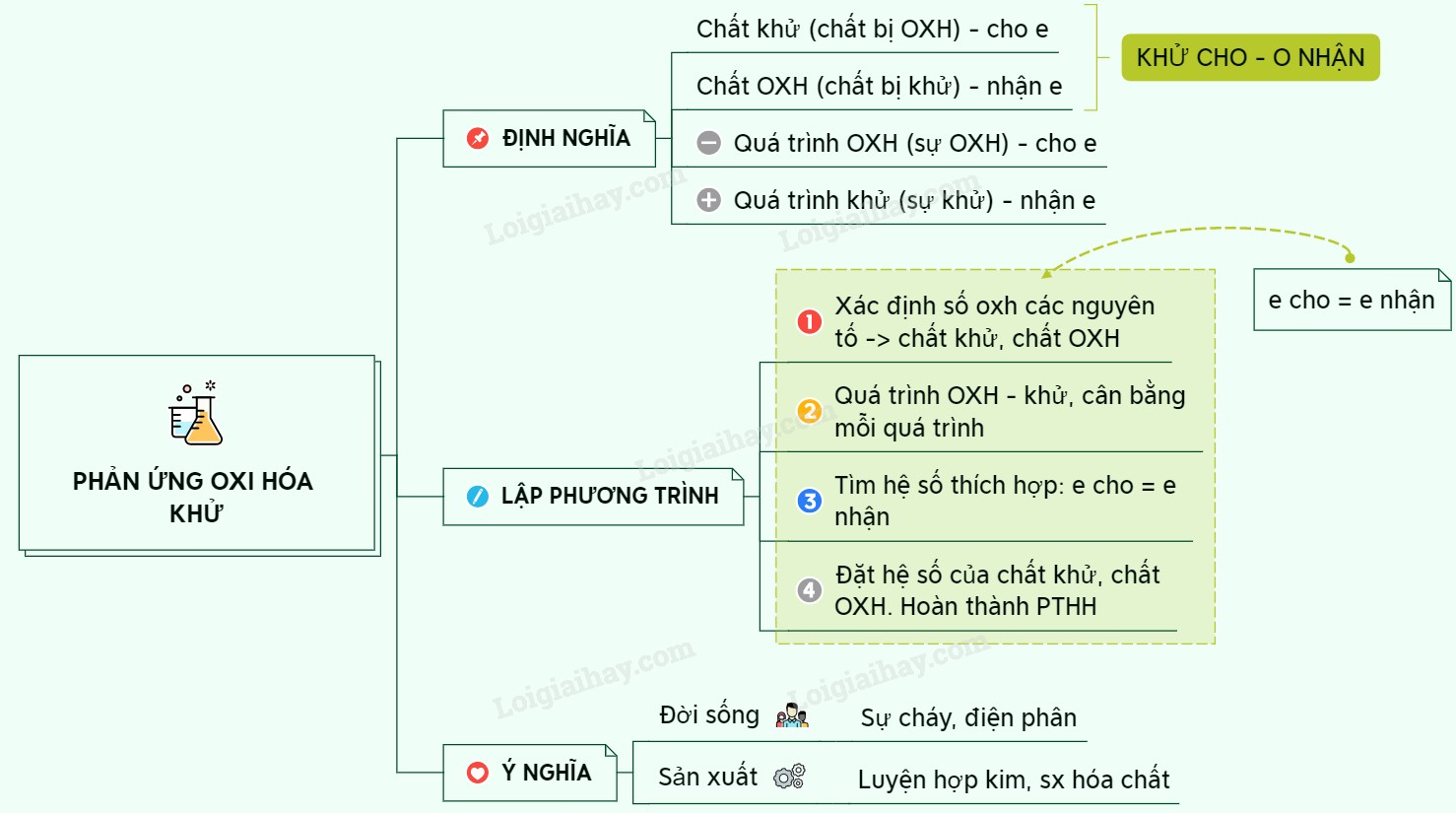
7. Phản Ứng Oxi Hóa Khử
Phản ứng oxi hóa khử là phản ứng hóa học trong đó có sự chuyển electron giữa các chất phản ứng. Trong phản ứng này, chất oxi hóa nhận electron từ chất khử, làm thay đổi số oxi hóa của cả hai chất.
7.1. Định Nghĩa Phản Ứng Oxi Hóa Khử
Phản ứng oxi hóa khử là quá trình hóa học trong đó có sự thay đổi số oxi hóa của các nguyên tử. Phản ứng này luôn đi kèm với sự chuyển electron từ chất khử sang chất oxi hóa.
7.2. Các Thành Phần Trong Phản Ứng Oxi Hóa Khử
- Chất oxi hóa: Chất nhận electron (bị khử).
- Chất khử: Chất nhường electron (bị oxi hóa).
- Quá trình oxi hóa: Quá trình chất khử nhường electron.
- Quá trình khử: Quá trình chất oxi hóa nhận electron.
7.3. Ví Dụ Về Phản Ứng Oxi Hóa Khử
Xét phản ứng giữa kẽm (Zn) và đồng (II) sulfat (CuSO4):
Zn + CuSO4 → ZnSO4 + Cu
Trong phản ứng này:
- Kẽm (Zn) nhường electron và trở thành ion kẽm (Zn2+), số oxi hóa tăng từ 0 lên +2 (bị oxi hóa).
- Đồng (II) (Cu2+) nhận electron và trở thành đồng kim loại (Cu), số oxi hóa giảm từ +2 xuống 0 (bị khử).
7.4. Ứng Dụng Của Phản Ứng Oxi Hóa Khử
Phản ứng oxi hóa khử có nhiều ứng dụng quan trọng trong các lĩnh vực khác nhau:
- Sản xuất điện: Pin và ắc quy hoạt động dựa trên các phản ứng oxi hóa khử để tạo ra dòng điện.
- Ăn mòn kim loại: Quá trình ăn mòn kim loại là một phản ứng oxi hóa khử, trong đó kim loại bị oxi hóa bởi các chất trong môi trường.
- Hô hấp tế bào: Quá trình hô hấp tế bào sử dụng phản ứng oxi hóa khử để oxi hóa glucose, tạo ra năng lượng cho cơ thể.
8. Ảnh Hưởng Của Chất Oxi Hóa Đến Môi Trường Và Sức Khỏe
Chất oxi hóa có thể gây ra những ảnh hưởng đáng kể đến môi trường và sức khỏe con người, tùy thuộc vào loại chất oxi hóa và nồng độ của chúng.
8.1. Ảnh Hưởng Đến Môi Trường
- Ô nhiễm không khí: Một số chất oxi hóa như ozon (O3) và các oxit nitơ (NOx) là các chất gây ô nhiễm không khí, gây ra các vấn đề về hô hấp và làm tổn hại đến thực vật.
- Ô nhiễm nước: Các chất oxi hóa mạnh như clo có thể gây ô nhiễm nguồn nước nếu không được kiểm soát chặt chẽ.
- Ăn mòn kim loại: Các chất oxi hóa trong môi trường có thể gây ra ăn mòn kim loại, làm giảm tuổi thọ của các công trình và thiết bị.
8.2. Ảnh Hưởng Đến Sức Khỏe
- Gây kích ứng: Một số chất oxi hóa như clo và ozon có thể gây kích ứng da, mắt và đường hô hấp.
- Gây tổn thương tế bào: Các gốc tự do, được tạo ra từ các phản ứng oxi hóa, có thể gây tổn thương tế bào và góp phần vào quá trình lão hóa và phát triển bệnh tật.
- Nguy cơ ung thư: Một số chất oxi hóa có thể gây ra các đột biến gen, làm tăng nguy cơ mắc bệnh ung thư.
8.3. Biện Pháp Giảm Thiểu Ảnh Hưởng
- Kiểm soát khí thải: Sử dụng các công nghệ kiểm soát khí thải để giảm lượng chất oxi hóa thải ra môi trường.
- Xử lý nước thải: Áp dụng các quy trình xử lý nước thải hiệu quả để loại bỏ các chất oxi hóa trước khi thải ra nguồn nước.
- Sử dụng chất oxi hóa an toàn: Ưu tiên sử dụng các chất oxi hóa ít độc hại và thân thiện với môi trường hơn.
- Bảo vệ sức khỏe: Sử dụng các biện pháp bảo hộ cá nhân khi làm việc với các chất oxi hóa để tránh tiếp xúc trực tiếp.
9. Các Câu Hỏi Thường Gặp Về Chất Oxi Hóa (FAQ)
9.1. Chất oxi hóa có phải luôn là chất độc hại không?
Không, không phải tất cả các chất oxi hóa đều độc hại. Một số chất oxi hóa như oxy rất cần thiết cho sự sống. Tuy nhiên, nhiều chất oxi hóa mạnh có thể gây hại nếu không được sử dụng đúng cách.
9.2. Làm thế nào để nhận biết một chất là chất oxi hóa?
Bạn có thể nhận biết một chất là chất oxi hóa bằng cách xem xét số oxi hóa của nó trong phản ứng. Nếu số oxi hóa của chất đó giảm sau phản ứng, thì đó là chất oxi hóa.
9.3. Chất oxi hóa có thể được sử dụng để bảo quản thực phẩm không?
Có, một số chất oxi hóa như sulfur dioxide (SO2) được sử dụng để bảo quản thực phẩm bằng cách ngăn chặn sự phát triển của vi khuẩn và nấm mốc.
9.4. Tại sao chất oxi hóa lại quan trọng trong công nghiệp?
Chất oxi hóa được sử dụng trong nhiều quy trình công nghiệp quan trọng như sản xuất hóa chất, luyện kim và xử lý nước thải.
9.5. Làm thế nào để bảo vệ bản thân khi làm việc với chất oxi hóa?
Bạn nên sử dụng các biện pháp bảo hộ cá nhân như đeo găng tay, kính bảo hộ và áo bảo hộ để tránh tiếp xúc trực tiếp với chất oxi hóa.
9.6. Chất oxi hóa có gây ra ăn mòn kim loại không?
Có, một số chất oxi hóa có thể gây ra ăn mòn kim loại bằng cách oxi hóa kim loại, làm giảm độ bền và tuổi thọ của chúng.
9.7. Chất oxi hóa và chất khử có vai trò gì trong pin?
Trong pin, chất oxi hóa nhận electron từ chất khử, tạo ra dòng điện. Chất oxi hóa thường là cực dương (cathode) và chất khử là cực âm (anode).
9.8. Ozon có phải là một chất oxi hóa mạnh không?
Có, ozon (O3) là một chất oxi hóa mạnh, được sử dụng để khử trùng nước và không khí. Tuy nhiên, nó cũng là một chất gây ô nhiễm không khí.
9.9. Làm thế nào để phân biệt chất oxi hóa mạnh và yếu?
Chất oxi hóa mạnh dễ dàng nhận electron hơn và có khả năng oxi hóa các chất khác mạnh mẽ hơn so với chất oxi hóa yếu. Thế oxi hóa khử chuẩn (E°) cũng là một chỉ số để so sánh khả năng oxi hóa của các chất.
9.10. Chất oxi hóa có thể gây ra bệnh tật không?
Một số chất oxi hóa có thể gây ra các bệnh về hô hấp, kích ứng da và mắt, và thậm chí là ung thư nếu tiếp xúc lâu dài và không được bảo vệ.
10. Tổng Kết
Chất oxi hóa là chất nhận electron, đóng vai trò then chốt trong nhiều phản ứng hóa học và có ứng dụng rộng rãi trong công nghiệp, môi trường và đời sống. Hiểu rõ về chất oxi hóa, đặc điểm và ứng dụng của nó giúp chúng ta sử dụng chúng một cách an toàn và hiệu quả.
Bạn muốn tìm hiểu thêm về các loại xe tải phù hợp với nhu cầu vận chuyển hàng hóa của mình? Hãy truy cập ngay XETAIMYDINH.EDU.VN để được tư vấn chi tiết và giải đáp mọi thắc mắc. Đội ngũ chuyên gia của Xe Tải Mỹ Đình luôn sẵn sàng hỗ trợ bạn lựa chọn chiếc xe tải ưng ý nhất, đảm bảo hiệu quả kinh tế và an toàn trên mọi hành trình. Liên hệ ngay hotline 0247 309 9988 để được hỗ trợ nhanh chóng nhất.
