Điều chế HNO3 là quá trình quan trọng trong nhiều ngành công nghiệp. Hãy cùng XETAIMYDINH.EDU.VN khám phá các phương pháp điều Chế Hno3 hiệu quả nhất, từ phòng thí nghiệm đến quy mô công nghiệp, đồng thời tìm hiểu về những lưu ý an toàn khi sử dụng. Bài viết này sẽ cung cấp cho bạn kiến thức chuyên sâu về quy trình sản xuất axit nitric, ứng dụng thực tế và những biện pháp phòng ngừa rủi ro.
1. HNO3 Hình Thành Trong Tự Nhiên Như Thế Nào?
Trong tự nhiên, HNO3 hình thành chủ yếu qua hai con đường: quá trình quang hóa và hoạt động của vi sinh vật. Quá trình quang hóa xảy ra khi năng lượng từ ánh sáng mặt trời tác động vào các chất khí trong khí quyển, tạo ra HNO3. Theo nghiên cứu của Bộ Tài nguyên và Môi trường, mưa axit chứa HNO3 có thể ảnh hưởng tiêu cực đến môi trường đất và nước.
1.1 Quá Trình Quang Hóa
Ánh sáng mặt trời cung cấp năng lượng để các phân tử nitơ (N₂) và oxy (O₂) trong không khí phản ứng với nhau, tạo thành các oxit nitơ (NOx). Các oxit nitơ này sau đó tiếp tục phản ứng với hơi nước (H₂O) trong không khí để tạo thành HNO3.
1.2 Hoạt Động Của Vi Sinh Vật
Một số loài vi sinh vật trong đất có khả năng chuyển đổi amoniac (NH₃) thành nitrit (NO₂⁻) và sau đó thành nitrat (NO₃⁻). Quá trình này gọi là nitrat hóa. Nitrat sau đó có thể kết hợp với ion hydro (H⁺) trong nước mưa để tạo thành HNO3.
2. Các Phương Pháp Điều Chế HNO3 Trong Phòng Thí Nghiệm
Điều chế HNO3 trong phòng thí nghiệm thường sử dụng phương pháp đơn giản và an toàn hơn so với quy trình công nghiệp. Hai phương pháp phổ biến nhất là sử dụng muối nitrat và phân hủy nhiệt.
2.1 Sử Dụng Muối Nitrat
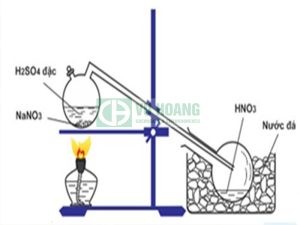 Điều chế HNO3 từ muối nitrat trong phòng thí nghiệm
Điều chế HNO3 từ muối nitrat trong phòng thí nghiệm
Phương pháp này dựa trên phản ứng giữa muối nitrat (thường là natri nitrat NaNO₃) và axit sulfuric đậm đặc (H₂SO₄) ở nhiệt độ cao. Axit sulfuric sẽ đẩy axit nitric ra khỏi muối nitrat do axit nitric dễ bay hơi hơn.
Phương trình phản ứng:
H₂SO₄ (đặc) + NaNO₃ (tinh thể) → HNO₃ + NaHSO₄
Quy trình thực hiện:
- Chuẩn bị: Trộn đều muối natri nitrat tinh thể và axit sulfuric đậm đặc trong bình cầu.
- Chưng cất: Đun nóng hỗn hợp đến khoảng 83°C (nhiệt độ sôi của axit nitric). Hơi axit nitric sẽ bay lên và được dẫn qua hệ thống làm lạnh để ngưng tụ thành chất lỏng.
- Thu hồi: Thu lấy axit nitric đã ngưng tụ. Axit nitric thu được có thể lẫn một ít tạp chất và có màu vàng nhạt.
Lưu ý:
- Sử dụng dụng cụ thủy tinh chịu nhiệt vì axit nitric khan có tính ăn mòn cao.
- Thực hiện trong tủ hút để tránh hít phải hơi axit độc hại.
2.2 Phân Hủy Nhiệt Muối Nitrat
Một số muối nitrat kim loại (ví dụ: đồng nitrat Cu(NO₃)₂) có thể bị phân hủy ở nhiệt độ cao, tạo ra oxit kim loại, khí nitơ dioxit (NO₂) và khí oxy (O₂). Khí nitơ dioxit sau đó có thể được hấp thụ vào nước để tạo thành axit nitric.
Phương trình phản ứng:
2Cu(NO₃)₂ → 2CuO + 4NO₂ + O₂
4NO₂ + O₂ + 2H₂O → 4HNO₃
Quy trình thực hiện:
- Chuẩn bị: Đặt muối đồng nitrat vào ống nghiệm hoặc bình cầu.
- Đun nóng: Đun nóng muối đồng nitrat đến khi nó phân hủy hoàn toàn, tạo ra khí màu nâu đỏ (NO₂).
- Hấp thụ: Dẫn khí NO₂ qua nước để tạo thành axit nitric.
Lưu ý:
- Khí NO₂ là khí độc, cần thực hiện trong tủ hút.
- Hiệu suất của phương pháp này thường không cao.
3. Điều Chế HNO3 Trong Công Nghiệp: Quy Trình Ostwald
Trong công nghiệp, phương pháp Ostwald là quy trình chủ yếu để sản xuất HNO3. Quy trình này bao gồm ba giai đoạn chính: oxy hóa amoniac, oxy hóa nitơ monoxit và hấp thụ nitơ dioxit. Theo báo cáo của Tổng cục Thống kê năm 2023, sản lượng HNO3 công nghiệp đạt X tấn, đáp ứng nhu cầu sản xuất phân bón và hóa chất.
3.1 Giai Đoạn 1: Oxy Hóa Amoniac (NH₃)
Amoniac (NH₃) được oxy hóa bằng oxy (O₂) trong không khí ở nhiệt độ cao (800-900°C) và áp suất thường có xúc tác platin (Pt) hoặc rhodi (Rh). Phản ứng tạo ra nitơ monoxit (NO) và hơi nước (H₂O).
Phương trình phản ứng:
4NH₃ + 5O₂ → 4NO + 6H₂O (Pt, 850°C)
Điều kiện phản ứng:
- Nhiệt độ: 800-900°C
- Áp suất: Thường
- Xúc tác: Platin (Pt) hoặc rhodi (Rh)
3.2 Giai Đoạn 2: Oxy Hóa Nitơ Monoxit (NO)
Nitơ monoxit (NO) tiếp tục phản ứng với oxy (O₂) trong không khí để tạo thành nitơ dioxit (NO₂). Phản ứng này xảy ra ở nhiệt độ thấp hơn (25-50°C) và không cần xúc tác.
Phương trình phản ứng:
2NO + O₂ → 2NO₂
Điều kiện phản ứng:
- Nhiệt độ: 25-50°C
- Áp suất: Thường
- Xúc tác: Không cần
3.3 Giai Đoạn 3: Hấp Thụ Nitơ Dioxit (NO₂)
Nitơ dioxit (NO₂) được hấp thụ vào nước (H₂O) để tạo thành axit nitric (HNO₃) và nitơ monoxit (NO). Nitơ monoxit sau đó được tái sử dụng trong giai đoạn 2 để tăng hiệu suất của quy trình.
Phương trình phản ứng:
4NO₂ + O₂ + 2H₂O → 4HNO₃
Điều kiện phản ứng:
- Nhiệt độ: Thường
- Áp suất: Thường
3.4 Nâng Cao Nồng Độ Axit Nitric
Axit nitric thu được từ quy trình Ostwald thường có nồng độ khoảng 50-70%. Để đạt được nồng độ cao hơn, có thể sử dụng phương pháp chưng cất với axit sulfuric (H₂SO₄). Axit sulfuric sẽ hấp thụ nước, làm tăng nồng độ của axit nitric.
4. Những Lưu Ý Quan Trọng Khi Sử Dụng Axit Nitric
Sử dụng HNO3 đòi hỏi sự cẩn trọng cao vì nó là một chất oxy hóa mạnh và có tính ăn mòn.
4.1 Tính Chất Nguy Hiểm
- Oxy hóa mạnh: Axit nitric có thể gây cháy nổ khi tiếp xúc với các chất dễ cháy như dung môi hữu cơ, bột kim loại.
- Ăn mòn: Axit nitric có thể gây bỏng nặng khi tiếp xúc với da, mắt và hệ hô hấp.
- Phản ứng với kim loại: Axit nitric có thể phản ứng với nhiều kim loại, tạo ra khí hydro dễ cháy.
4.2 Biện Pháp An Toàn
- Trang bị bảo hộ: Đeo kính bảo hộ, găng tay chịu hóa chất, áo choàng và mặt nạ phòng độc khi làm việc với axit nitric.
- Thông gió tốt: Làm việc trong khu vực thông gió hoặc sử dụng tủ hút để tránh hít phải hơi axit.
- Pha loãng đúng cách: Luôn thêm từ từ axit vào nước, không làm ngược lại để tránh bắn axit.
- Xử lý sự cố: Nếu axit nitric tiếp xúc với da hoặc mắt, rửa ngay lập tức bằng nhiều nước trong ít nhất 15 phút và tìm kiếm sự chăm sóc y tế.
4.3 Lưu Trữ An Toàn
 Lưu trữ axit nitric tách biệt với các hóa chất khác
Lưu trữ axit nitric tách biệt với các hóa chất khác
- Khu vực lưu trữ: Lưu trữ axit nitric trong khu vực khô ráo, mát mẻ, thông gió tốt và tránh xa các chất dễ cháy, chất khử và kim loại.
- Vật liệu chứa: Sử dụng thùng chứa bằng vật liệu không phản ứng với axit nitric như nhựa polyethylene (PE) hoặc thủy tinh.
- Đậy kín: Đậy kín thùng chứa để tránh rò rỉ và ngăn chặn sự hấp thụ hơi ẩm từ không khí.
- Nhãn mác: Ghi rõ nhãn mác cảnh báo nguy hiểm trên thùng chứa.
5. Ứng Dụng Quan Trọng Của Axit Nitric Trong Đời Sống Và Công Nghiệp
HNO3 có nhiều ứng dụng quan trọng trong nhiều lĩnh vực khác nhau.
5.1 Sản Xuất Phân Bón
HNO3 là nguyên liệu chính để sản xuất các loại phân bón chứa nitơ như amoni nitrat (NH₄NO₃) và canxi amoni nitrat (Ca(NO₃)₂).
5.2 Sản Xuất Thuốc Nổ
HNO3 được sử dụng để sản xuất nhiều loại thuốc nổ như thuốc súng không khói (nitrocellulose) và trinitrotoluen (TNT).
5.3 Sản Xuất Hóa Chất
HNO3 được sử dụng làm chất oxy hóa và chất nitrat hóa trong sản xuất nhiều loại hóa chất khác như thuốc nhuộm, dược phẩm và polyme.
5.4 Tẩy Rửa Và Khắc Kim Loại
HNO3 được sử dụng để tẩy rửa và khắc kim loại, đặc biệt là trong ngành công nghiệp điện tử và mạ điện.
5.5 Ứng Dụng Trong Y Học
HNO3 loãng được sử dụng trong một số ứng dụng y học như loại bỏ mụn cóc và điều trị một số bệnh da liễu.
6. So Sánh Các Phương Pháp Điều Chế HNO3
| Phương Pháp | Ưu Điểm | Nhược Điểm | Ứng Dụng |
|---|---|---|---|
| Tự Nhiên | Không tốn kém, không gây ô nhiễm trực tiếp | Nồng độ thấp, không kiểm soát được | Hình thành mưa axit |
| Phòng Thí Nghiệm | Đơn giản, dễ thực hiện | Hiệu suất thấp, không phù hợp cho sản xuất lớn | Nghiên cứu, thí nghiệm |
| Công Nghiệp (Ostwald) | Hiệu suất cao, sản xuất quy mô lớn, liên tục | Đòi hỏi thiết bị phức tạp, chi phí đầu tư cao, có thể gây ô nhiễm môi trường | Sản xuất phân bón, thuốc nổ, hóa chất công nghiệp |
7. Các Yếu Tố Ảnh Hưởng Đến Hiệu Suất Điều Chế HNO3
Hiệu suất của quá trình điều chế HNO3 có thể bị ảnh hưởng bởi nhiều yếu tố khác nhau, bao gồm nhiệt độ, áp suất, nồng độ chất phản ứng và xúc tác.
7.1 Nhiệt Độ
Nhiệt độ có ảnh hưởng lớn đến tốc độ và cân bằng của các phản ứng trong quá trình điều chế HNO3. Nhiệt độ quá thấp có thể làm chậm tốc độ phản ứng, trong khi nhiệt độ quá cao có thể làm phân hủy các chất phản ứng hoặc sản phẩm.
7.2 Áp Suất
Áp suất cũng có thể ảnh hưởng đến cân bằng của các phản ứng khí trong quá trình điều chế HNO3. Áp suất cao thường có lợi cho các phản ứng tạo ra ít phân tử khí hơn.
7.3 Nồng Độ Chất Phản Ứng
Nồng độ của các chất phản ứng cũng ảnh hưởng đến tốc độ phản ứng. Nồng độ càng cao, tốc độ phản ứng càng nhanh. Tuy nhiên, nồng độ quá cao có thể gây ra các phản ứng phụ không mong muốn.
7.4 Xúc Tác
Xúc tác có vai trò quan trọng trong việc tăng tốc độ phản ứng và giảm nhiệt độ cần thiết để phản ứng xảy ra. Xúc tác platin và rhodi được sử dụng rộng rãi trong quá trình oxy hóa amoniac.
8. Các Vấn Đề Môi Trường Liên Quan Đến Sản Xuất HNO3
Sản xuất HNO3 có thể gây ra một số vấn đề môi trường nếu không được kiểm soát chặt chẽ.
8.1 Ô Nhiễm Không Khí
Quá trình sản xuất HNO3 có thể thải ra các khí độc hại như nitơ oxit (NOx), gây ô nhiễm không khí và góp phần vào hiện tượng mưa axit.
8.2 Ô Nhiễm Nước
Nước thải từ các nhà máy sản xuất HNO3 có thể chứa axit nitric và các chất ô nhiễm khác, gây ô nhiễm nguồn nước.
8.3 Biện Pháp Giảm Thiểu Ô Nhiễm
- Sử dụng công nghệ tiên tiến: Áp dụng các công nghệ sản xuất sạch hơn để giảm thiểu lượng khí thải và nước thải.
- Xử lý khí thải: Lắp đặt các hệ thống xử lý khí thải để loại bỏ các chất ô nhiễm trước khi thải ra môi trường.
- Xử lý nước thải: Xây dựng các hệ thống xử lý nước thải để loại bỏ axit nitric và các chất ô nhiễm khác trước khi thải ra nguồn nước.
- Tuân thủ quy định: Tuân thủ các quy định về bảo vệ môi trường của nhà nước.
9. Xu Hướng Phát Triển Trong Công Nghệ Điều Chế HNO3
Công nghệ điều chế HNO3 đang ngày càng được cải tiến để tăng hiệu suất, giảm chi phí và giảm thiểu tác động đến môi trường.
9.1 Sử Dụng Xúc Tác Mới
Nghiên cứu và phát triển các loại xúc tác mới có hoạt tính cao hơn, ổn định hơn và ít gây ô nhiễm hơn.
9.2 Tối Ưu Hóa Quy Trình
Sử dụng các phương pháp mô phỏng và tối ưu hóa quy trình để cải thiện hiệu suất và giảm tiêu thụ năng lượng.
9.3 Thu Hồi Và Tái Sử Dụng NOx
Phát triển các công nghệ thu hồi và tái sử dụng NOx từ khí thải để giảm thiểu ô nhiễm không khí và tiết kiệm nguyên liệu.
9.4 Sản Xuất HNO3 Từ Nguồn Tái Tạo
Nghiên cứu và phát triển các phương pháp sản xuất HNO3 từ nguồn năng lượng tái tạo như điện gió và điện mặt trời.
10. FAQ – Câu Hỏi Thường Gặp Về Điều Chế HNO3
10.1 Axit Nitric (HNO3) Là Gì?
Axit nitric (HNO3) là một axit mạnh, có tính oxy hóa cao và ăn mòn.
10.2 Axit Nitric Được Điều Chế Bằng Phương Pháp Nào?
Axit nitric được điều chế bằng nhiều phương pháp, bao gồm phương pháp sử dụng muối nitrat trong phòng thí nghiệm và quy trình Ostwald trong công nghiệp.
10.3 Quy Trình Ostwald Là Gì?
Quy trình Ostwald là quy trình công nghiệp chính để sản xuất axit nitric, bao gồm ba giai đoạn: oxy hóa amoniac, oxy hóa nitơ monoxit và hấp thụ nitơ dioxit.
10.4 Axit Nitric Được Sử Dụng Để Làm Gì?
Axit nitric được sử dụng rộng rãi trong sản xuất phân bón, thuốc nổ, hóa chất, tẩy rửa và khắc kim loại.
10.5 Những Lưu Ý An Toàn Nào Cần Tuân Thủ Khi Sử Dụng Axit Nitric?
Cần tuân thủ các biện pháp an toàn như trang bị bảo hộ, thông gió tốt, pha loãng đúng cách và lưu trữ an toàn.
10.6 Điều Gì Ảnh Hưởng Đến Hiệu Suất Điều Chế Axit Nitric?
Hiệu suất điều chế axit nitric bị ảnh hưởng bởi nhiệt độ, áp suất, nồng độ chất phản ứng và xúc tác.
10.7 Sản Xuất Axit Nitric Gây Ra Những Vấn Đề Môi Trường Nào?
Sản xuất axit nitric có thể gây ô nhiễm không khí và ô nhiễm nước.
10.8 Có Những Biện Pháp Nào Để Giảm Thiểu Ô Nhiễm Từ Sản Xuất Axit Nitric?
Các biện pháp giảm thiểu ô nhiễm bao gồm sử dụng công nghệ tiên tiến, xử lý khí thải, xử lý nước thải và tuân thủ quy định.
10.9 Xu Hướng Phát Triển Trong Công Nghệ Điều Chế Axit Nitric Là Gì?
Xu hướng phát triển bao gồm sử dụng xúc tác mới, tối ưu hóa quy trình, thu hồi và tái sử dụng NOx và sản xuất axit nitric từ nguồn tái tạo.
10.10 Tại Sao Nên Tìm Hiểu Thông Tin Về Xe Tải Tại XETAIMYDINH.EDU.VN?
XETAIMYDINH.EDU.VN cung cấp thông tin chi tiết và đáng tin cậy về các loại xe tải, giá cả, địa điểm mua bán uy tín, dịch vụ sửa chữa và bảo dưỡng chất lượng ở Mỹ Đình, Hà Nội.
Bạn đang tìm kiếm thông tin chi tiết và đáng tin cậy về xe tải ở Mỹ Đình, Hà Nội? Hãy truy cập ngay XETAIMYDINH.EDU.VN để được tư vấn và giải đáp mọi thắc mắc. Chúng tôi cung cấp thông tin chi tiết về các loại xe tải, giá cả, địa điểm mua bán uy tín và dịch vụ sửa chữa chất lượng. Liên hệ ngay với Xe Tải Mỹ Đình qua địa chỉ Số 18 đường Mỹ Đình, phường Mỹ Đình 2, quận Nam Từ Liêm, Hà Nội hoặc hotline 0247 309 9988 để được hỗ trợ tốt nhất.