Công Thức Tổng Quát Của Amin là CxHyNz, trong đó x, y, và z là các số nguyên dương. Để tìm hiểu sâu hơn về công thức này và ứng dụng của nó, hãy cùng XETAIMYDINH.EDU.VN khám phá chi tiết về amin, từ định nghĩa, phân loại, đến tính chất hóa học và cách điều chế. Chúng tôi sẽ cung cấp những thông tin hữu ích nhất giúp bạn nắm vững kiến thức về hợp chất quan trọng này, đồng thời gợi ý các địa chỉ tin cậy để tìm hiểu thêm về thị trường xe tải và các dịch vụ liên quan. Xe Tải Mỹ Đình cam kết mang đến những giải pháp tối ưu cho mọi nhu cầu vận tải của bạn.
1. Tổng Quan Về Amin
1.1. Amin Là Gì?
Amin là hợp chất hữu cơ được hình thành khi thay thế một hoặc nhiều nguyên tử hydro trong phân tử amoniac (NH3) bằng một hoặc nhiều gốc hydrocarbon. Công thức tổng quát của amin đơn chức là CxHyN.
Ví dụ:
- Metylamin (CH3NH2)
- Etylamin (C2H5NH2)
- Phenylamin (C6H5NH2)
1.2. Phân Loại Amin
Amin được phân loại theo nhiều cách khác nhau, bao gồm:
- Theo gốc hydrocarbon:
- Amin béo (aliphatic): Các gốc hydrocarbon là gốc alkyl (ví dụ: metyl, etyl).
- Amin thơm (aromatic): Gốc hydrocarbon là gốc aryl (ví dụ: phenyl).
- Amin dị vòng (heterocyclic): Nitơ là một phần của vòng.
- Theo bậc của amin: Bậc của amin được xác định bởi số lượng gốc hydrocarbon liên kết trực tiếp với nguyên tử nitơ.
- Amin bậc 1 (amin bậc nhất): Một gốc hydrocarbon liên kết với nitơ.
- Amin bậc 2 (amin bậc hai): Hai gốc hydrocarbon liên kết với nitơ.
- Amin bậc 3 (amin bậc ba): Ba gốc hydrocarbon liên kết với nitơ.
 Phân loại amin theo bậc
Phân loại amin theo bậc
1.3. Công Thức Tổng Quát Của Amin
- Amin đơn chức: CxHyN
- Amin no, đơn chức: CnH2n+3N
- Amin no, đa chức: CnH2n+2+zNz (với z là số nhóm amino -NH2)
Ví dụ:
- Etanamin (C2H5NH2): n = 2, C2H(2*2)+3N = C2H7N
- Etilenđiamin (H2NCH2CH2NH2): n = 2, z = 2, C2H(2*2)+2+2N2 = C2H8N2
2. Đồng Phân Và Danh Pháp Của Amin
2.1. Đồng Phân Của Amin
Amin có thể có các loại đồng phân sau:
- Đồng phân mạch carbon: Sự khác nhau về cấu trúc mạch carbon.
- Đồng phân vị trí nhóm chức: Sự khác nhau về vị trí của nhóm amino (-NH2) trên mạch carbon.
- Đồng phân bậc của amin: Sự khác nhau về bậc của amin (bậc 1, 2, 3).
Ví dụ, amin có công thức phân tử C3H9N có các đồng phân sau:
- Propan-1-amin (CH3CH2CH2NH2) – Amin bậc 1
- Propan-2-amin (CH3CH(NH2)CH3) – Amin bậc 1
- N-Metyl etanamin (CH3NHCH2CH3) – Amin bậc 2
- N,N-Đimetyl metanamin (CH3N(CH3)2) – Amin bậc 3
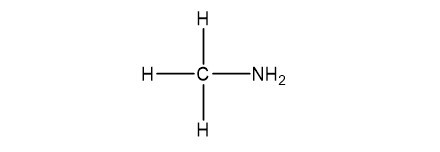 Đồng phân của CH5N
Đồng phân của CH5N
2.2. Danh Pháp Của Amin
Có hai cách gọi tên amin phổ biến:
- Danh pháp gốc – chức: Tên gốc hydrocarbon + amin
- Ví dụ: CH3NH2 – Metylamin, C6H5NH2 – Phenylamin
- Danh pháp thay thế: Tên hydrocarbon + vị trí nhóm amino + amin
- Ví dụ: CH3CH2NH2 – Etanamin, CH3CH(NH2)CH3 – Propan-2-amin
Bảng Tên Gọi Một Số Amin Thông Dụng
| Công Thức Cấu Tạo | Tên Thông Thường | Tên Thay Thế |
|---|---|---|
| CH3NH2 | Metylamin | Metanamin |
| CH3CH2NH2 | Etylamin | Etanamin |
| (CH3)2NH | Đimetylamin | N-Metylmetanamin |
| (CH3)3N | Trimetylamin | N,N-Đimetylmetanamin |
| C6H5NH2 | Anilin | Benzenamin |
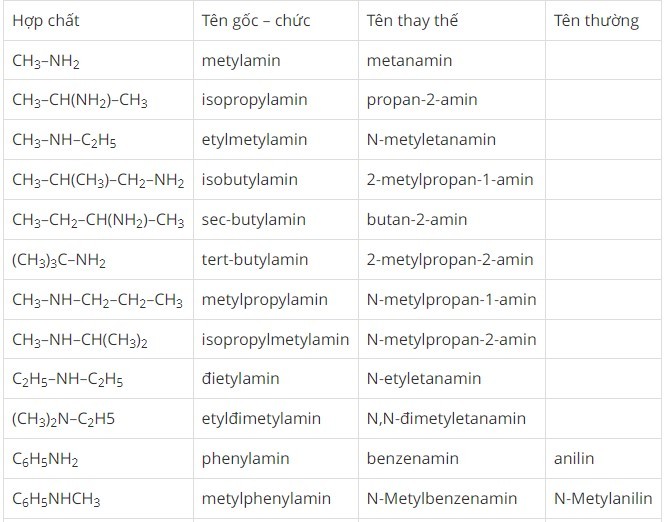 Bảng tên gọi amin
Bảng tên gọi amin
3. Tính Chất Vật Lý Của Amin
3.1. Trạng Thái Tồn Tại
Amin có thể tồn tại ở cả ba trạng thái: rắn, lỏng và khí, tùy thuộc vào khối lượng phân tử và cấu trúc của chúng.
- Các amin có khối lượng phân tử nhỏ (amin bậc thấp) thường ở trạng thái khí hoặc lỏng, có mùi khai đặc trưng như amoniac.
- Các amin có khối lượng phân tử lớn hơn (amin bậc cao) thường ở trạng thái rắn.
3.2. Độ Tan
Độ tan của amin trong nước giảm khi khối lượng phân tử tăng. Các amin bậc thấp tan tốt trong nước do tạo liên kết hydro với nước, trong khi các amin bậc cao ít tan hơn hoặc không tan.
3.3. Nhiệt Độ Sôi
Nhiệt độ sôi của amin phụ thuộc vào khối lượng phân tử và khả năng tạo liên kết hydro. Amin bậc 1 và bậc 2 có nhiệt độ sôi cao hơn so với amin bậc 3 có cùng khối lượng phân tử do khả năng tạo liên kết hydro giữa các phân tử.
Bảng Nhiệt Độ Sôi, Độ Nóng Chảy, Độ Tan Của Một Số Amin
| Tên Amin | Công Thức | Nhiệt Độ Sôi (°C) | Độ Tan Trong Nước |
|---|---|---|---|
| Metylamin | CH3NH2 | -6 | Tan vô hạn |
| Etylamin | C2H5NH2 | 16.6 | Tan vô hạn |
| Đimetylamin | (CH3)2NH | 7.4 | Tan vô hạn |
| Trimetylamin | (CH3)3N | 3.5 | Tan tốt |
| Anilin | C6H5NH2 | 184 | Ít tan |
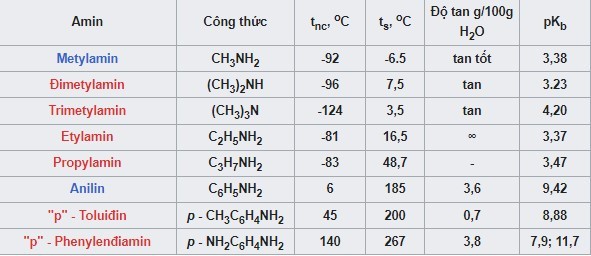 Bảng nhiệt độ sôi và độ tan của amin
Bảng nhiệt độ sôi và độ tan của amin
4. Tính Chất Hóa Học Của Amin
4.1. Tính Bazơ
Amin có tính bazơ do nguyên tử nitơ còn cặp electron tự do, có khả năng nhận proton (H+). Tính bazơ của amin phụ thuộc vào cấu trúc của gốc hydrocarbon liên kết với nitơ.
- Amin béo có tính bazơ mạnh hơn amoniac (NH3).
- Amin thơm có tính bazơ yếu hơn amoniac do ảnh hưởng hút electron của vòng benzen làm giảm mật độ electron trên nitơ.
4.2. Phản Ứng Với Axit
Amin tác dụng với axit tạo thành muối amoni.
Ví dụ:
CH3NH2 + HCl → CH3NH3Cl (Metylamoni clorua)
C6H5NH2 + HCl → C6H5NH3Cl (Phenylamoni clorua)
4.3. Phản Ứng Với Anhydrit Axit Và Clorua Axit
Amin phản ứng với anhydrit axit và clorua axit tạo thành amit.
Ví dụ:
CH3NH2 + CH3COCl → CH3NHCOCH3 + HCl (N-Metylaxetamit)
4.4. Phản Ứng Với Axit Nitrơ (HNO2)
Phản ứng của amin với axit nitrơ được sử dụng để phân biệt các bậc của amin.
- Amin bậc 1: Tác dụng với HNO2 tạo thành ancol hoặc phenol và giải phóng khí nitơ (N2).
- RNH2 + HNO2 → ROH + N2 + H2O
- Amin bậc 2: Tác dụng với HNO2 tạo thành hợp chất nitrozo.
- R2NH + HNO2 → R2N-NO + H2O
- Amin bậc 3: Không phản ứng với HNO2.
- Anilin: Phản ứng với HNO2 ở nhiệt độ thấp (0-5°C) tạo thành muối diazoni.
- C6H5NH2 + HNO2 + HCl → C6H5N2+Cl- + 2H2O
 Phản ứng riêng của anilin
Phản ứng riêng của anilin
4.5. Phản Ứng Ankyl Hóa
Amin có thể phản ứng với các dẫn xuất halogen (RX) để tạo thành amin bậc cao hơn.
RNH2 + RX → R2NH + HX
R2NH + RX → R3N + HX
R3N + RX → R4N+X- (muối amoni bậc 4)
5. Điều Chế Amin
5.1. Ankyl Hóa Amoniac
Amoniac (NH3) phản ứng với dẫn xuất halogen (RX) tạo thành amin bậc 1. Phản ứng tiếp tục tạo thành hỗn hợp amin bậc 2, bậc 3 và muối amoni bậc 4.
NH3 + RX → RNH2 + HX
Để thu được amin bậc 1 làm sản phẩm chính, cần sử dụng dư NH3.
5.2. Khử Hợp Chất Nitro
Khử các hợp chất nitro (R-NO2) bằng các chất khử như Fe/HCl, Sn/HCl hoặc H2/Ni tạo thành amin.
R-NO2 + 6[H] → R-NH2 + 2H2O
Ví dụ:
C6H5NO2 + 6[H] → C6H5NH2 + 2H2O
5.3. Khử Nitril Và Amit
Khử nitril (RCN) hoặc amit (RCONH2) bằng các chất khử mạnh như LiAlH4 tạo thành amin.
RCN + 4[H] → RCH2NH2
RCONH2 + 4[H] → RCH2NH2 + H2O
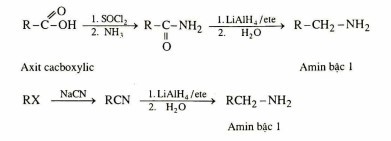 Khử nitrin, amid
Khử nitrin, amid
6. Các Dạng Bài Tập Về Amin
6.1. Xác Định Tên Gọi, Số Đồng Phân
- Bước 1: Xác định độ bất bão hòa của phân tử (nếu cần).
- δ = (2x + 2 + z – y)/2 (với CxHyNzOt)
- Bước 2: Xác định loại mạch carbon (mạch thẳng, mạch nhánh, vòng).
- Bước 3: Xác định các nhóm chức và vị trí của chúng.
- Bước 4: Gọi tên theo danh pháp thay thế hoặc danh pháp gốc – chức.
6.2. So Sánh Tính Bazơ
Tính bazơ của amin phụ thuộc vào các yếu tố sau:
- Ảnh hưởng của gốc hydrocarbon: Gốc đẩy electron làm tăng tính bazơ, gốc hút electron làm giảm tính bazơ.
- Hiệu ứng không gian: Các gốc lớn cản trở sự proton hóa của nitơ, làm giảm tính bazơ.
Thứ tự tính bazơ thường gặp:
Amin béo > NH3 > Amin thơm
6.3. Xác Định Số Nhóm Chức Amin
Sử dụng phản ứng trung hòa:
n(H+) / n(amin) = số nhóm chức amin
6.4. Phản Ứng Cháy Của Amin
CxHyNt + (x + y/4) O2 → xCO2 + (y/2)H2O + (t/2)N2
Lưu ý:
- Nếu đốt cháy trong không khí, N2 sinh ra từ phản ứng cháy amin cộng với N2 trong không khí.
- Amin no, đơn chức, mạch hở: CnH2n+3N
- Amin no, hai chức, mạch hở: CnH2n+4N2
%20O{2}%20overset{t^{0}C}{rightarrow}%20xCO{2}%20+%20frac{y}{2}H{2}O%20+%20frac{t}{2}N{2})
6.5. Amin Tác Dụng Với Muối Của Kim Loại
Một số muối dễ dàng tạo kết tủa hydroxit với dung dịch amin.
Ví dụ:
CuCl2 + 2CH3NH2 + 2H2O → Cu(OH)2↓ + 2CH3NH3Cl
Anilin và amin thơm thường không tác dụng với muối của kim loại.
6.6. Bài Tập Về Anilin
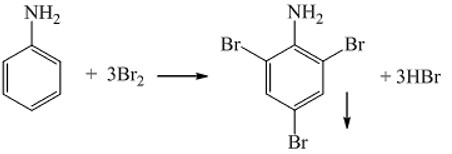
Anilin có khả năng phản ứng với nước brom tạo kết tủa trắng 2,4,6-tribromanilin.
C6H5NH2 + 3Br2 → C6H2Br3NH2↓ + 3HBr
6.7. Phản Ứng Khử Amin Bằng HNO2
Amin bậc 1 tác dụng với HNO2 ở nhiệt độ thường tạo ra ancol hoặc phenol và giải phóng khí N2.
RNH2 + HNO2 → ROH + N2 + H2O
Anilin và amin thơm phản ứng với HNO2 ở nhiệt độ thấp (0-5°C) tạo muối diazoni.
7. Ứng Dụng Của Amin
Amin có nhiều ứng dụng quan trọng trong các ngành công nghiệp khác nhau:
- Sản xuất dược phẩm: Nhiều loại thuốc chứa nhóm amin, ví dụ như thuốc giảm đau, thuốc kháng histamin.
- Sản xuất thuốc nhuộm: Anilin và các amin thơm khác được sử dụng để sản xuất thuốc nhuộm.
- Sản xuất polyme: Amin được sử dụng để sản xuất các loại polyme như polyuretan, nylon.
- Sản xuất hóa chất bảo vệ thực vật: Một số loại thuốc trừ sâu, thuốc diệt cỏ chứa nhóm amin.
- Trong công nghiệp cao su: Amin được sử dụng làm chất xúc tiến trong quá trình lưu hóa cao su.
8. Các Nghiên Cứu Liên Quan Đến Amin
Theo nghiên cứu của Trường Đại học Khoa học Tự nhiên, Đại học Quốc gia Hà Nội, vào tháng 5 năm 2024, các amin thơm có khả năng hấp thụ tia UV, mở ra tiềm năng ứng dụng trong sản xuất kem chống nắng.
Nghiên cứu của Viện Hóa học, Viện Hàn lâm Khoa học và Công nghệ Việt Nam, công bố tháng 11 năm 2023, chỉ ra rằng các amin dị vòng có hoạt tính sinh học cao, có thể được sử dụng để phát triển các loại thuốc mới.
9. FAQ Về Công Thức Tổng Quát Của Amin
9.1. Công thức tổng quát của amin no, đơn chức, mạch hở là gì?
Công thức tổng quát của amin no, đơn chức, mạch hở là CnH2n+3N.
9.2. Amin có tính chất hóa học đặc trưng nào?
Tính chất hóa học đặc trưng của amin là tính bazơ, do nguyên tử nitơ còn cặp electron tự do.
9.3. Làm thế nào để phân biệt các bậc của amin?
Có thể phân biệt các bậc của amin bằng phản ứng với axit nitrơ (HNO2).
9.4. Anilin có tính bazơ mạnh hơn hay yếu hơn amoniac?
Anilin có tính bazơ yếu hơn amoniac do ảnh hưởng hút electron của vòng benzen.
9.5. Ứng dụng quan trọng nhất của amin là gì?
Amin có nhiều ứng dụng quan trọng, trong đó có sản xuất dược phẩm, thuốc nhuộm và polyme.
9.6. Điều gì xảy ra khi amin tác dụng với axit?
Khi amin tác dụng với axit, muối amoni sẽ được tạo thành.
9.7. Các yếu tố nào ảnh hưởng đến tính bazơ của amin?
Các yếu tố ảnh hưởng đến tính bazơ của amin bao gồm: ảnh hưởng của gốc hydrocarbon, hiệu ứng không gian.
9.8. Làm thế nào để điều chế amin từ hợp chất nitro?
Có thể điều chế amin từ hợp chất nitro bằng cách khử bằng các chất khử như Fe/HCl, Sn/HCl hoặc H2/Ni.
9.9. Công thức tổng quát của amin được sử dụng để làm gì?
Công thức tổng quát của amin giúp xác định thành phần nguyên tố và cấu trúc của phân tử amin, từ đó dự đoán các tính chất và ứng dụng của chúng.
9.10. Tại sao amin lại có mùi khai đặc trưng?
Các amin bậc thấp có mùi khai đặc trưng do chúng dễ bay hơi và có tính bazơ, tương tác với các thụ thể mùi trong mũi.
10. Xe Tải Mỹ Đình: Địa Chỉ Tin Cậy Cho Mọi Nhu Cầu Vận Tải
Bạn đang tìm kiếm thông tin chi tiết và đáng tin cậy về các loại xe tải ở Mỹ Đình, Hà Nội? Bạn muốn so sánh giá cả và thông số kỹ thuật giữa các dòng xe? Bạn cần tư vấn lựa chọn xe phù hợp với nhu cầu và ngân sách của mình? Hãy đến với XETAIMYDINH.EDU.VN, nơi bạn sẽ tìm thấy mọi thông tin cần thiết và được giải đáp mọi thắc mắc liên quan đến thủ tục mua bán, đăng ký và bảo dưỡng xe tải.
Chúng tôi cam kết cung cấp thông tin cập nhật và chính xác nhất về các dịch vụ sửa chữa xe tải uy tín trong khu vực. Với đội ngũ chuyên gia giàu kinh nghiệm, Xe Tải Mỹ Đình sẽ giúp bạn lựa chọn được chiếc xe tải ưng ý, đáp ứng mọi yêu cầu vận tải của bạn.
Liên hệ ngay với chúng tôi để được tư vấn miễn phí:
- Địa chỉ: Số 18 đường Mỹ Đình, phường Mỹ Đình 2, quận Nam Từ Liêm, Hà Nội
- Hotline: 0247 309 9988
- Trang web: XETAIMYDINH.EDU.VN
Hãy truy cập XETAIMYDINH.EDU.VN ngay hôm nay để khám phá thêm nhiều thông tin hữu ích và nhận được sự hỗ trợ tận tình từ đội ngũ chuyên gia của chúng tôi. Chúng tôi luôn sẵn sàng đồng hành cùng bạn trên mọi nẻo đường!
