Công Thức Của Benzen là C6H6, một hợp chất hữu cơ quan trọng với cấu trúc vòng đặc biệt và nhiều ứng dụng trong công nghiệp. Hãy cùng XETAIMYDINH.EDU.VN khám phá sâu hơn về cấu trúc, tính chất và ứng dụng của benzen, đồng thời tìm hiểu về các đồng đẳng và cách gọi tên chúng. Bài viết này sẽ cung cấp cho bạn cái nhìn tổng quan và chi tiết nhất về hợp chất benzen, giúp bạn tự tin nắm vững kiến thức và áp dụng vào thực tế.
1. Tổng Quan Về Benzen
1.1. Benzen Là Gì?
Benzen là một hidrocacbon thơm, có dạng lỏng, không màu và không tan trong nước. Tuy nhiên, benzen lại dễ dàng hòa tan trong các dung môi hữu cơ như dầu khoáng, dầu thực vật, cao su, nhựa đường, mỡ, sơn và vecni. Mặc dù có mùi thơm nhẹ, benzen lại là một chất độc hại đối với sức khỏe con người.
 benzen – benzen là gì
benzen – benzen là gì
Trong công nghiệp, benzen là nguyên liệu quan trọng để tổng hợp nhiều hợp chất hữu cơ khác như anilin, clo benzen, nitrobenzen và phenol. Tuy nhiên, do tính độc hại, việc sử dụng benzen đã bị hạn chế từ những năm 1970. Tại Việt Nam, việc cấm sử dụng benzen trong một số ngành công nghiệp đã được quy định rõ ràng.
1.2. Công Thức Phân Tử và Cấu Tạo Của Benzen
Công Thức Tổng Quát Của Benzen
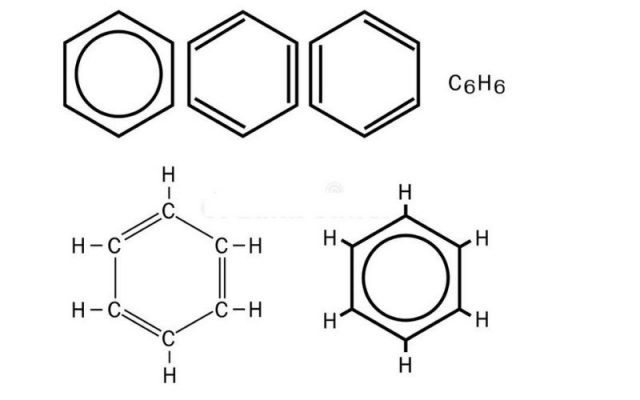
Công thức phân tử của benzen là C6H6, cho thấy mỗi phân tử benzen chứa 6 nguyên tử cacbon và 6 nguyên tử hydro. Công thức tổng quát cho dãy đồng đẳng của benzen là CnH2n-6 (với n ≥ 6).
Cấu Tạo Phân Tử Của Benzen
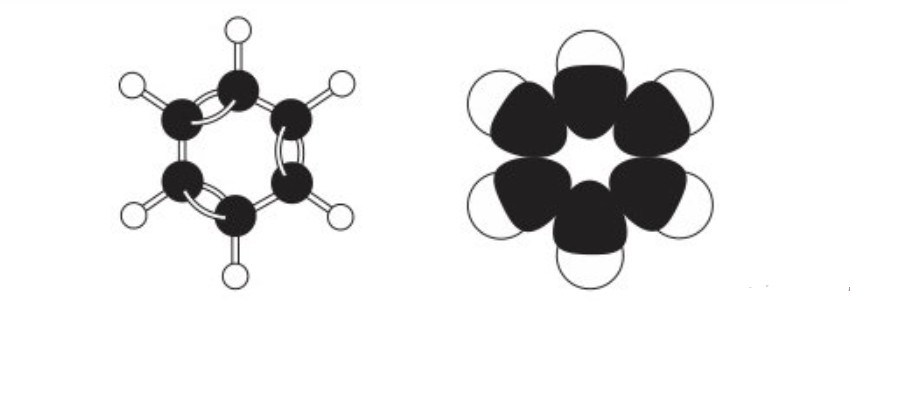
Benzen có cấu trúc vòng 6 cạnh đều, với mỗi nguyên tử cacbon liên kết với hai nguyên tử cacbon khác và một nguyên tử hydro. Tất cả các nguyên tử cacbon trong phân tử benzen đều ở trạng thái lai hóa sp2, tạo thành ba obitan lai hóa.
 mô hình cấu tạo phân tử của benzen – benzen là gì
mô hình cấu tạo phân tử của benzen – benzen là gì
Ba obitan lai hóa này được sử dụng để tạo liên kết sigma (σ) với hai nguyên tử cacbon bên cạnh và một nguyên tử hydro. Sáu obitan p còn lại của sáu nguyên tử cacbon tạo thành một hệ liên hợp π chung cho toàn bộ vòng benzen. Điều này làm cho liên kết π trong benzen bền vững hơn so với liên kết π trong anken và các hidrocacbon không no khác.
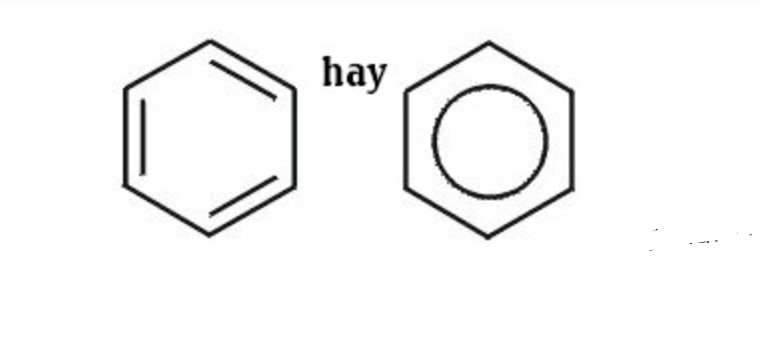
Công Thức Cấu Tạo Rút Gọn Của Benzen
Công thức cấu tạo rút gọn của benzen thường được biểu diễn bằng một vòng lục giác đều, với một vòng tròn bên trong biểu thị sự phân bố đều của các electron π.
 công thức cấu tạo của benzen dạng rút gọn – benzen công thức
công thức cấu tạo của benzen dạng rút gọn – benzen công thức
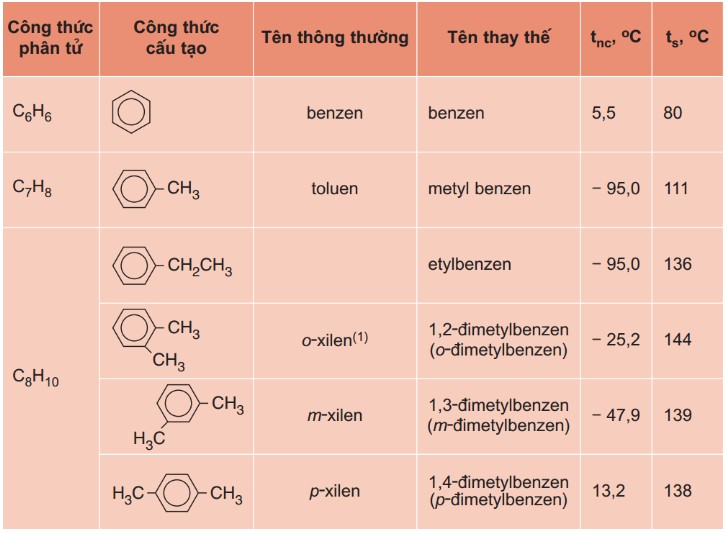
1.3. Benzen Và Đồng Đẳng
Benzen (C6H6) và các hidrocacbon thơm khác có công thức phân tử chung là CnH2n-6 (n ≥ 6). Ví dụ, C7H8 (toluen) và C8H10 (xylen) là hai đồng đẳng phổ biến của benzen. Tên gọi chung của dãy đồng đẳng benzen là aren. Các ankyl benzen thường gặp bao gồm toluen (C6H5CH3), xylen (C6H4(CH3)2) và cumen (C6H5CH(CH3)2).
2. Danh Pháp Của Đồng Đẳng Benzen
2.1. Cách Gọi Tên Đồng Đẳng Benzen
Khi thay thế các nguyên tử hydro trong phân tử benzen bằng các nhóm ankyl, ta thu được các ankyl benzen khác nhau, có công thức chung là CnH2n-6 (n ≥ 6). Nếu coi vòng benzen là mạch chính, các nhóm ankyl đính vào nó là mạch nhánh, hay còn gọi là nhóm thế.
Công thức gọi tên: Tên vị trí – tên nhánh + benzen
Ví dụ:
- Metylbenzen (Toluen)
- Etylbenzen
- 1,2-đimetylbenzen (o-Xylen)
- 1,3-đimetylbenzen (m-Xylen)
- 1,4-đimetylbenzen (p-Xylen)
2.2. Đồng Phân Của Benzen
Đồng phân của benzen bao gồm đồng phân vị trí nhóm ankyl trên vòng benzen và đồng phân mạch cacbon của mạch nhánh.
- Đồng phân ortho (o-): Hai nhóm thế ở vị trí 2C liền kề nhau (vị trí 1,2).
- Đồng phân meta (m-): Hai nhóm thế cách nhau một nguyên tử cacbon (vị trí 1,3).
- Đồng phân para (p-): Hai nhóm thế ở vị trí đối diện nhau trên vòng benzen (vị trí 1,4).
 danh pháp một số đồng đẳng, đồng phân của benzen – benzen và đồng đẳng
danh pháp một số đồng đẳng, đồng phân của benzen – benzen và đồng đẳng
Từ C8H10 trở đi, có các đồng phân về vị trí tương đối của các nhóm ankyl xung quanh vòng benzen và về cấu tạo mạch cacbon của mạch nhánh.
3. Tính Chất Vật Lý Của Benzen Và Đồng Đẳng
3.1. Trạng Thái Tự Nhiên Và Màu Sắc
Các hidrocacbon thơm thường tồn tại ở dạng chất lỏng linh động hoặc chất rắn (đối với các đồng đẳng cao hơn). Chúng có nhiệt độ sôi tăng theo sự tăng của khối lượng phân tử. Các hidrocacbon thơm ở thể lỏng có mùi thơm đặc trưng, do đó chúng còn được gọi là hidrocacbon thơm.
 benzen – benzen là gì
benzen – benzen là gì
3.2. Khả Năng Hòa Tan
Hidrocacbon thơm có khối lượng riêng nhỏ hơn nước, không tan trong nước nhưng tan nhiều trong các dung môi hữu cơ như chất béo, aceton, rượu và ete. Benzen (C6H6) là một ví dụ điển hình về tính chất vật lý này.
4. Tính Chất Hóa Học Của Benzen Và Đồng Đẳng
4.1. Phản Ứng Thế
Thế Nguyên Tử H Của Vòng Benzen
-
Phản ứng với halogen (Br2): Benzen phản ứng với brom khi có xúc tác bột sắt, tạo thành brombenzen và khí hydro bromua.
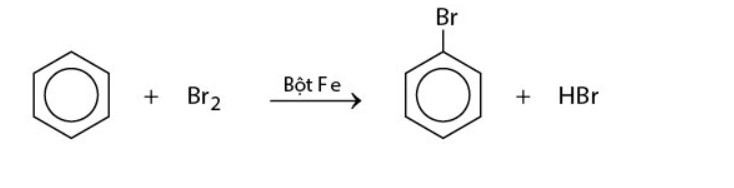 phản ứng thế của benzen với Br2 – benzen
phản ứng thế của benzen với Br2 – benzenNếu cho các ankylbenzen phản ứng với brom trong điều kiện có bột sắt, sẽ thu được hỗn hợp sản phẩm thế brom chủ yếu vào vị trí para (p-) và ortho (o-) so với nhóm ankyl.
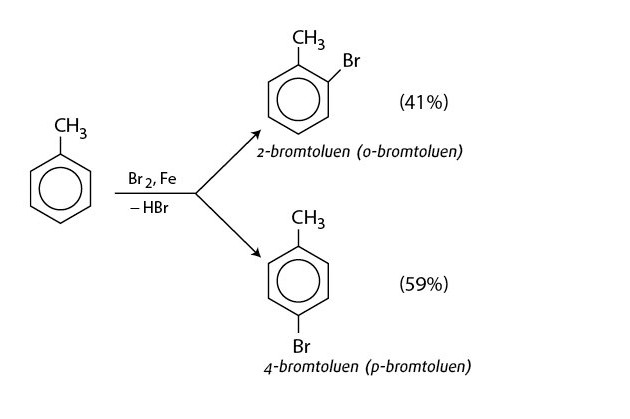 benzen phản ứng với brom có xúc tác bột sắt – benzen
benzen phản ứng với brom có xúc tác bột sắt – benzen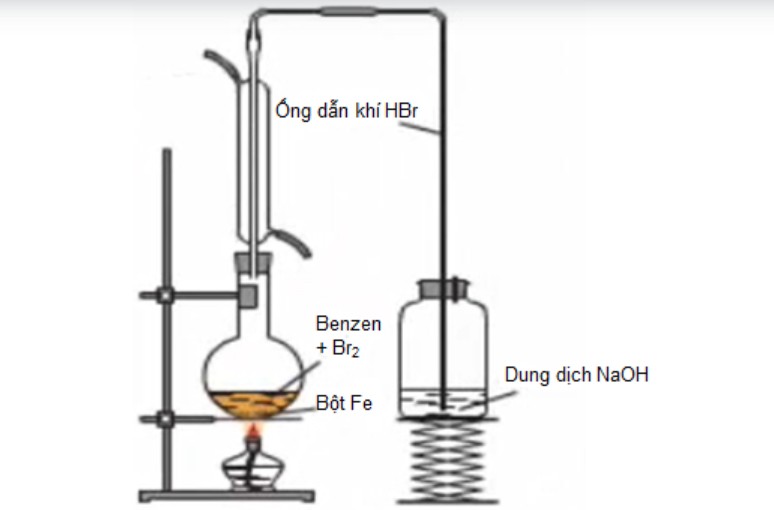 Mô phỏng thí nghiệm benzen xảy ra phản ứng thế với brom có xúc tác bột sắt – benzen
Mô phỏng thí nghiệm benzen xảy ra phản ứng thế với brom có xúc tác bột sắt – benzen -
Phản ứng với axit nitric (HNO3): Benzen phản ứng với hỗn hợp axit nitric đặc và axit sulfuric đặc, tạo thành nitrobenzen.
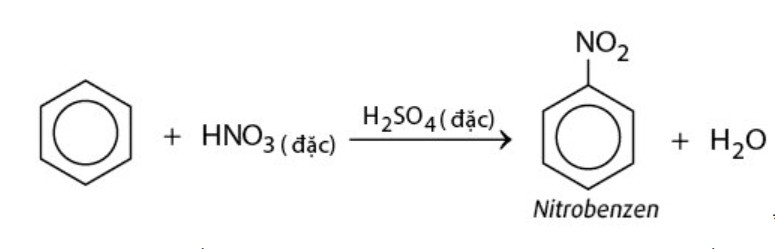 benzen xảy ra phản ứng thế với HNO3 – benzen
benzen xảy ra phản ứng thế với HNO3 – benzen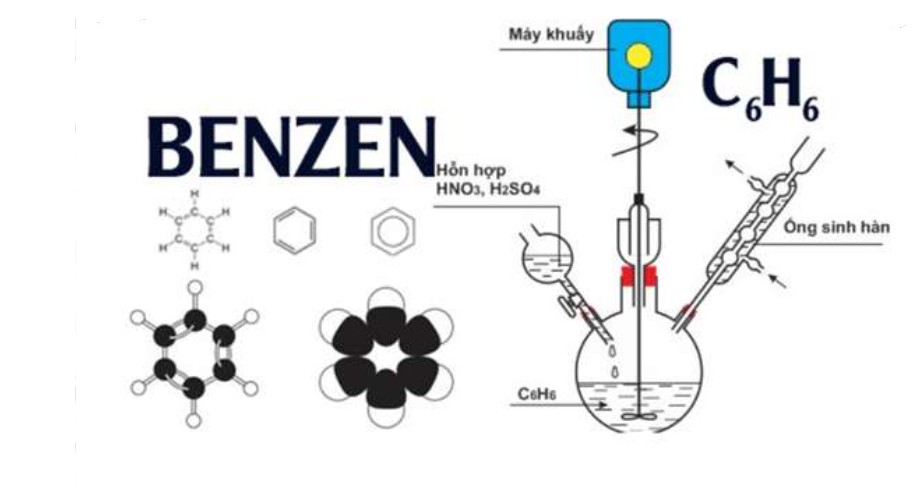 mô phỏng thí nghiệm benzen phản ứng với HNO3 – benzen
mô phỏng thí nghiệm benzen phản ứng với HNO3 – benzen
Quy tắc thế: Các ankyl benzen dễ tham gia phản ứng thế nguyên tử H của vòng benzen hơn benzen, và sự thế ưu tiên ở vị trí ortho (o-) và para (p-) so với nhóm ankyl.
Thế Nguyên Tử H Ở Mạch Nhánh
Khi đun toluen hoặc các ankylbenzen với brom, sẽ xảy ra phản ứng thế nguyên tử H của mạch nhánh tương tự như đối với ankan.
Ví dụ: Toluen phản ứng với brom tạo ra benzyl bromua:
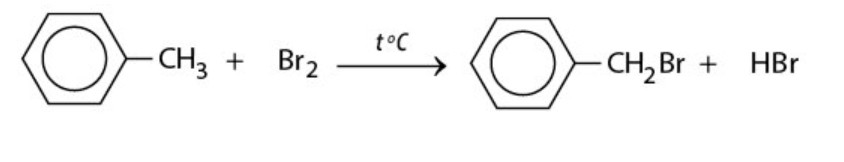 phản ứng của Toluen với Brom tạo Benzyl bromua – benzen
phản ứng của Toluen với Brom tạo Benzyl bromua – benzen
4.2. Phản Ứng Cộng
Cộng Hydro (H2)
Benzen cộng với hidro (H2) khi có xúc tác niken (Ni) và nhiệt độ, tạo thành xiclohexan (C6H12).
C6H6 + 3 H2 → C6H12
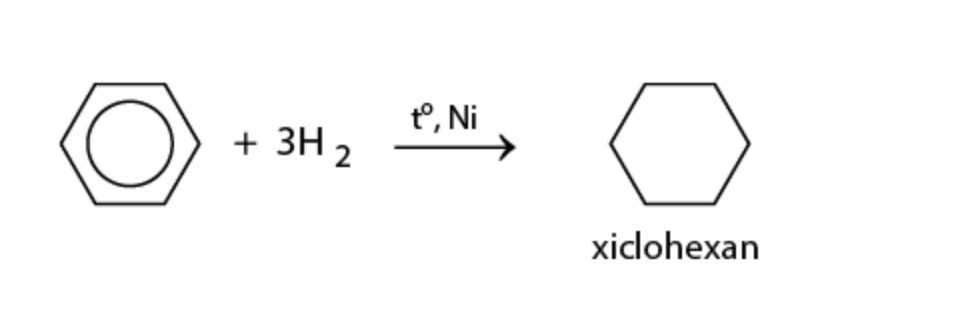 benzen phản ứng với H2 – benzen
benzen phản ứng với H2 – benzen
Cộng Clo (Cl2)
Benzen cộng với clo (Cl2) khi có ánh sáng khuếch tán, tạo thành hexacloran (C6H6Cl6).
C6H6 + 3 Cl2 → C6H6Cl6
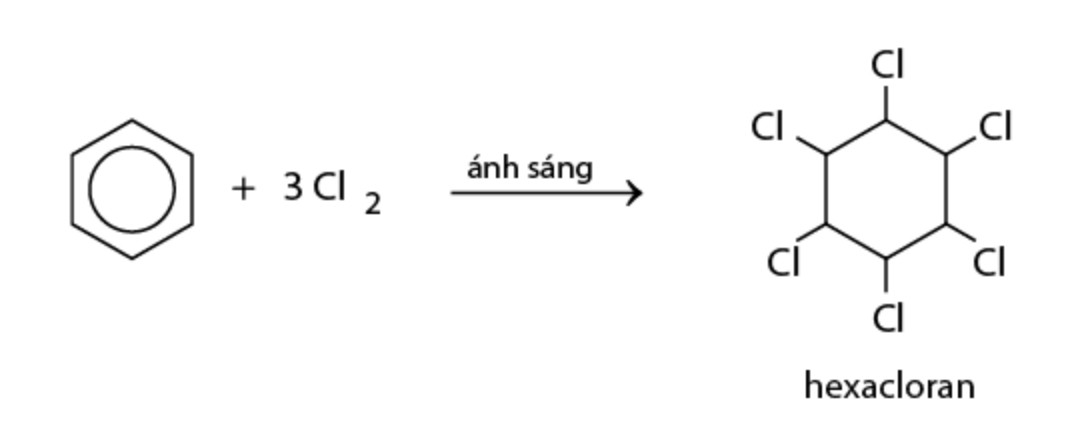 benzen phản ứng với Cl2 – benzen
benzen phản ứng với Cl2 – benzen
4.3. Phản Ứng Oxi Hóa
Oxi Hóa Không Hoàn Toàn
Benzen không làm mất màu dung dịch KMnO4 ở điều kiện thường. Tuy nhiên, toluen và các ankylbenzen khác có thể làm mất màu dung dịch KMnO4 khi đun nóng.
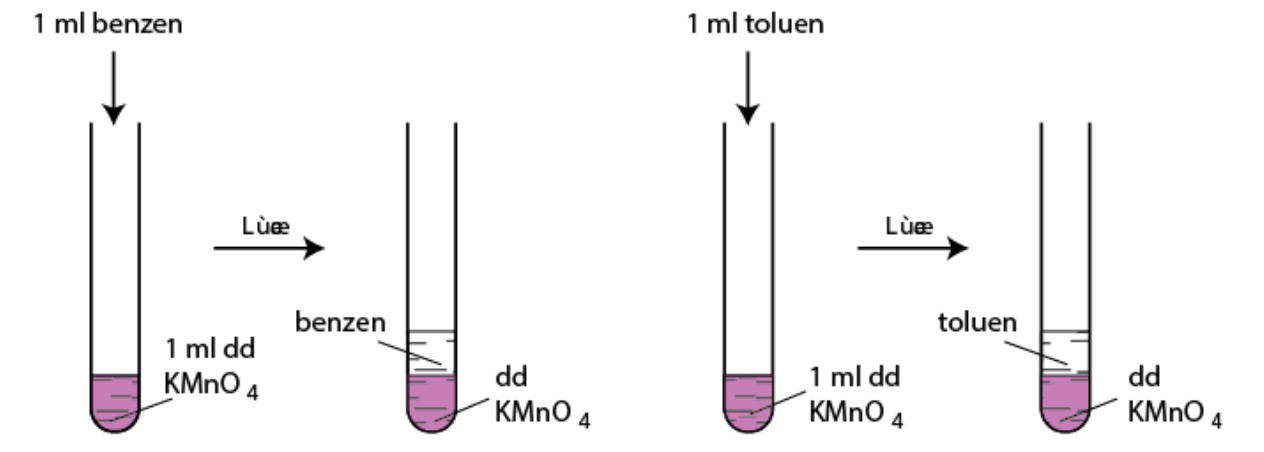 benzen và toluen phản ứng với KMnO4 trong điều kiện thường – benzen
benzen và toluen phản ứng với KMnO4 trong điều kiện thường – benzen
Toluene + KMnO4 → C6H5-COOK (kali benzoat) + MnO2 + KOH + H2O
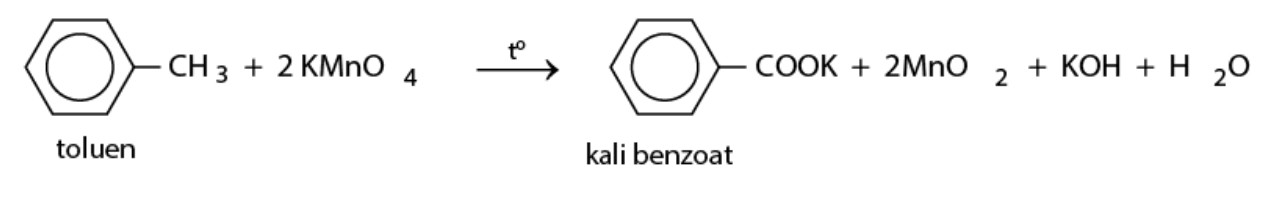 toluen phản ứng với KMnO4 trong điều kiện nhiệt độ – benzen
toluen phản ứng với KMnO4 trong điều kiện nhiệt độ – benzen
Oxi Hóa Hoàn Toàn
Khi đốt cháy, các hidrocacbon thơm tỏa nhiều nhiệt theo phương trình tổng quát:
CnH2n-6 + (3n – 3)/2 O2 → nCO2 + (n – 3) H2O
Số mol CO2 luôn lớn hơn số mol H2O.
5. Điều Chế Và Ứng Dụng Của Benzen
5.1. Điều Chế Benzen
Benzen thường được điều chế bằng cách chưng cất từ dầu mỏ và nhựa than đá. Ngoài ra, benzen còn được điều chế từ các ankan hoặc xicloankan.
 hóa chất benzen – benzen là gì
hóa chất benzen – benzen là gì
Phản ứng điều chế:
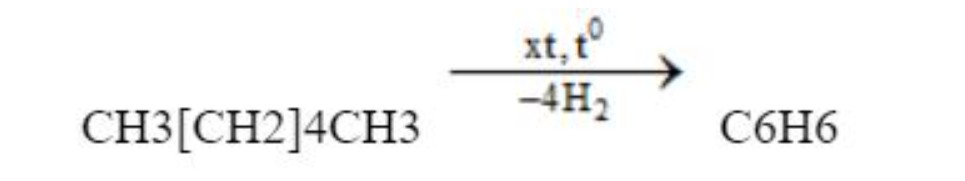 điều chế benzen – benzen
điều chế benzen – benzen
5.2. Ứng Dụng Của Benzen
Benzen là một trong những nguyên liệu quan trọng nhất của công nghiệp hóa hữu cơ. Nó được ứng dụng trong sản xuất polime làm chất dẻo, cao su, tơ sợi (ví dụ như polistiren, cao su buna-stiren hoặc tơ capron).
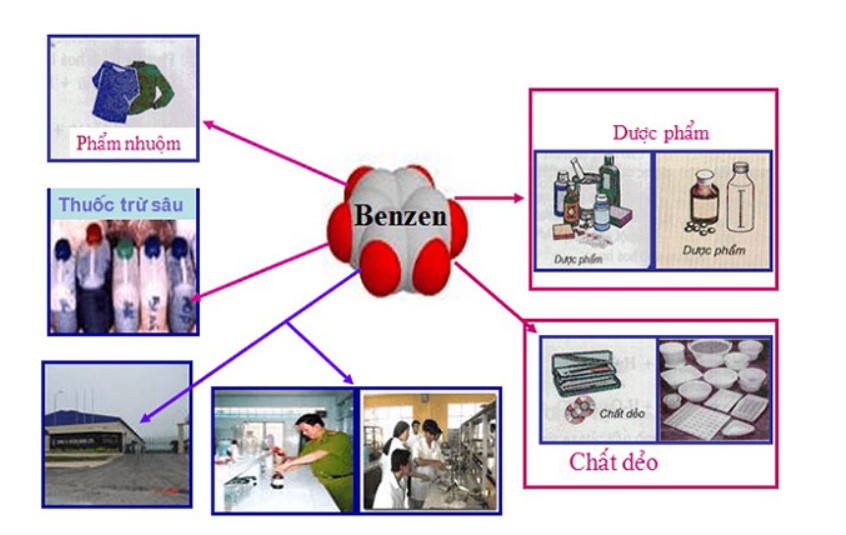 ứng dụng của benzen – benzen
ứng dụng của benzen – benzen
Benzen, toluen và xylen còn được dùng làm dung môi hòa tan các chất như mỡ, cao su, vecni. Benzen còn được dùng trong tẩy mỡ ở xương, da sợi, len, vải, dạ và các tấm kim loại. Từ benzen, người ta điều chế ra các chất khác như cumen, axeton, phenol, nitrobenzen, anilin, phẩm nhuộm, dược phẩm và thuốc trừ dịch hại. Toluen được dùng để chế tạo thuốc nổ TNT (trinitrotoluen).
6. Các Bài Tập Về Benzen Và Đồng Đẳng (Có Lời Giải)
Bài tập 1: Hidrocacbon X là chất lỏng, có tỷ khối hơi so với không khí bằng 3,17. Đốt cháy hoàn toàn X thu được CO2 có khối lượng bằng 4,28 lần khối lượng nước. Ở nhiệt độ thường, X không làm mất màu dung dịch brom, nhưng khi đun nóng (có xúc tác), X làm mất màu KMnO4.
a. Tìm công thức phân tử và cấu tạo của X?
b. Viết các phương trình hóa học phản ứng giữa X với H2 (xúc tác Ni, đun nóng), brom (xúc tác bột Fe) và hỗn hợp axit HNO3 và H2SO4 đậm đặc dư.
Đáp án:
a. Gọi CTPT của X là CxHy:
MX = 3,17. 29 = 92 → 12x + y = 92 (1)
mCO2 = 4,28mH2O → 44x = 4,28. 18. (y/2) → y = 1,14x (2)
Từ (1) và (2) → x = 7, y = 8. CTPT của X là C7H8 (Toluen).
b.
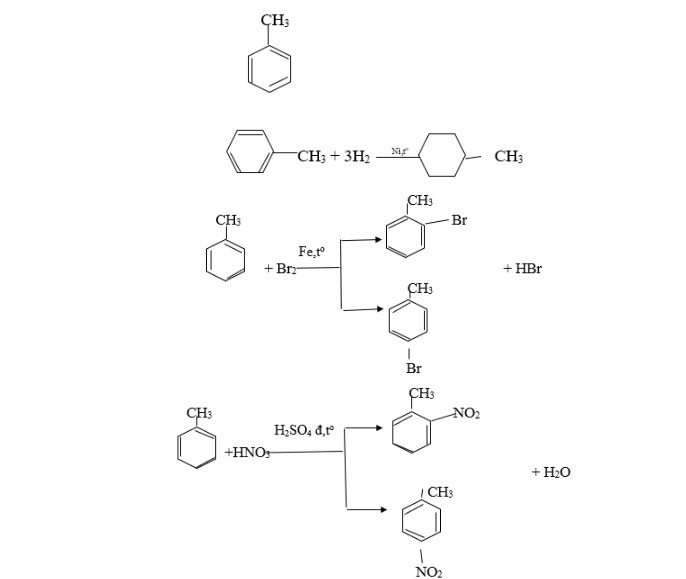 bài tập benzen – benzen
bài tập benzen – benzen
Bài tập 2: Thực hiện phản ứng tách hidro của 66,25 kg etylbenzen thu được 52,00 kg stiren. Trùng hợp toàn bộ lượng stiren này được hỗn hợp A gồm polistiren và stiren chưa tham gia phản ứng. 5,20 gam hỗn hợp A vừa đủ làm mất màu 60,00 ml dung dịch brom 0,15M.
a. Tính hiệu suất phản ứng tách hidro của etylbenzen.
b. Tính khối lượng stiren được trùng hợp.
c. Phân tử khối trung bình của polistiren bằng 3,12.105. Tính hệ số trùng hợp trung bình của polime.
Đáp án:
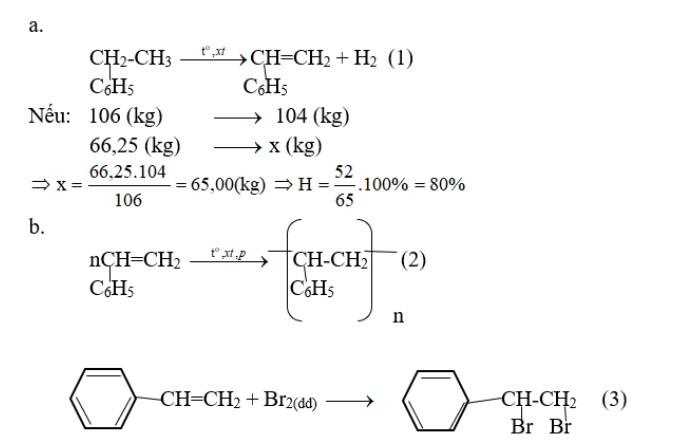 bài tập benzen – benzen
bài tập benzen – benzen
nBr2 = 0,06.0,15 = 0,009(mol)
Theo định luật bảo toàn khối lượng: mA = mstiren = 52,00 (kg) = 52.103 (g)
5,2 g hỗn hợp A tác dụng vừa đủ với 0,009 mol Br2 → 52.103g hỗn hợp A tác dụng vừa đủ với 90 mol Br2
Theo (3): nstiren = nBr2 = 90(mol)
mstiren = 90.104 = 9360(g) = 9,36(kg)
Khối lượng stiren đã tham gia phản ứng trùng hợp = mA – mstiren = 52 – 9,36 = 42,64 (kg)
c. Hệ số trùng hợp là: n = 312000/104 = 3000
Bài tập 3: Trình bày những đặc điểm giống và khác nhau giữa tính chất hóa học của stiren và etylbenzen. Viết phương trình hóa học minh họa.
Đáp án:
Tính chất hóa học của etylbenzen và stiren có những điểm giống và khác nhau:
Giống nhau:
-
Cả etylbenzen và stiren đều xảy ra phản ứng thế:
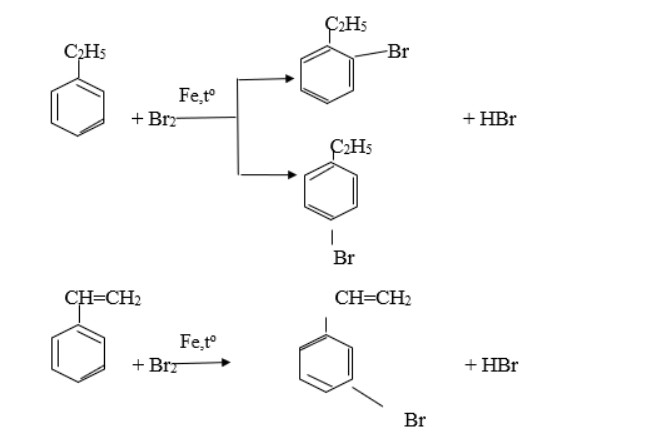 so sánh etylbenzen và stiren – benzen
so sánh etylbenzen và stiren – benzen
Khác nhau:
-
Etylbenzen có tính chất giống ankan:
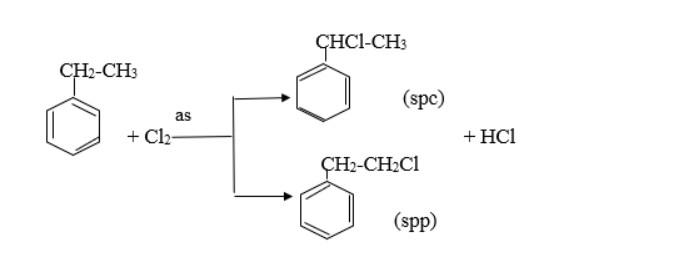 so sánh etylbenzen và stiren – benzen
so sánh etylbenzen và stiren – benzen -
Stiren có tính chất giống anken:
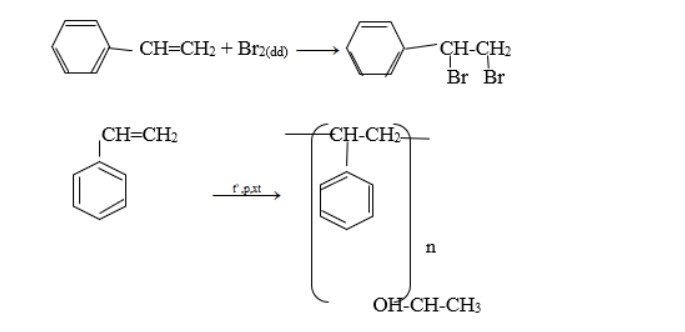 so sánh etylbenzen và stiren – benzen
so sánh etylbenzen và stiren – benzen
7. FAQ – Các Câu Hỏi Thường Gặp Về Benzen
-
Công thức cấu tạo của benzen là gì?
- Công thức cấu tạo của benzen là một vòng lục giác đều với một vòng tròn bên trong, biểu thị sự phân bố đều của các electron pi.
-
Benzen có tan trong nước không?
- Benzen không tan trong nước, nhưng tan tốt trong các dung môi hữu cơ.
-
Benzen có độc hại không?
- Có, benzen là một chất độc hại và có thể gây hại cho sức khỏe con người nếu tiếp xúc lâu dài.
-
Ứng dụng chính của benzen là gì?
- Benzen được sử dụng chủ yếu làm nguyên liệu để sản xuất các hợp chất hữu cơ khác, như polime, nhựa, dược phẩm và thuốc trừ sâu.
-
Benzen được điều chế như thế nào?
- Benzen thường được điều chế bằng cách chưng cất từ dầu mỏ hoặc nhựa than đá.
-
Đồng đẳng của benzen là gì?
- Đồng đẳng của benzen là các hidrocacbon thơm có công thức chung CnH2n-6, ví dụ như toluen (C7H8) và xylen (C8H10).
-
Phản ứng đặc trưng của benzen là gì?
- Phản ứng đặc trưng của benzen là phản ứng thế, trong đó nguyên tử hydro trên vòng benzen được thay thế bởi một nhóm thế khác.
-
Benzen có làm mất màu dung dịch brom không?
- Benzen không phản ứng với dung dịch brom ở điều kiện thường, trừ khi có xúc tác.
-
Tại sao benzen được gọi là hidrocacbon thơm?
- Benzen được gọi là hidrocacbon thơm vì nó có cấu trúc vòng đặc biệt và mùi thơm đặc trưng.
-
Làm thế nào để nhận biết benzen?
- Benzen có thể được nhận biết thông qua các phản ứng hóa học đặc trưng, như phản ứng thế và phản ứng oxi hóa (dù benzen khó bị oxi hóa hơn các hidrocacbon khác).
8. Bạn Muốn Tìm Hiểu Thêm Về Xe Tải Ở Mỹ Đình?
Bạn đang tìm kiếm thông tin chi tiết và đáng tin cậy về xe tải ở khu vực Mỹ Đình, Hà Nội? Bạn muốn so sánh giá cả, thông số kỹ thuật và tìm địa chỉ mua bán xe tải uy tín? Đừng lo lắng, XETAIMYDINH.EDU.VN sẽ giúp bạn giải quyết mọi thắc mắc!
Chúng tôi cung cấp:
- Thông tin chi tiết và cập nhật về các loại xe tải có sẵn ở Mỹ Đình.
- So sánh giá cả và thông số kỹ thuật giữa các dòng xe.
- Tư vấn lựa chọn xe phù hợp với nhu cầu và ngân sách của bạn.
- Giải đáp các thắc mắc liên quan đến thủ tục mua bán, đăng ký và bảo dưỡng xe tải.
- Thông tin về các dịch vụ sửa chữa xe tải uy tín trong khu vực.
Hãy truy cập ngay XETAIMYDINH.EDU.VN để được tư vấn và giải đáp mọi thắc mắc về xe tải ở Mỹ Đình!
Địa chỉ: Số 18 đường Mỹ Đình, phường Mỹ Đình 2, quận Nam Từ Liêm, Hà Nội
Hotline: 0247 309 9988
Trang web: XETAIMYDINH.EDU.VN
Hy vọng bài viết này đã cung cấp cho bạn những thông tin hữu ích về công thức của benzen và các ứng dụng của nó. Đừng quên theo dõi XETAIMYDINH.EDU.VN để cập nhật thêm nhiều kiến thức thú vị khác!