Nhiệt tạo thành chuẩn là lượng nhiệt tỏa ra hoặc thu vào khi tạo thành 1 mol hợp chất từ các đơn chất bền vững nhất ở điều kiện chuẩn, và Xe Tải Mỹ Đình sẽ giúp bạn hiểu rõ hơn về nó. Chúng tôi cung cấp thông tin chi tiết, giúp bạn nắm vững kiến thức về nhiệt động học và ứng dụng thực tế của nó trong ngành vận tải. Hãy cùng khám phá sâu hơn về khái niệm quan trọng này, cùng với các khía cạnh liên quan như biến thiên enthalpy và ứng dụng của nó trong thực tiễn.
1. Nhiệt Tạo Thành Chuẩn Là Gì?
Nhiệt tạo thành chuẩn là biến thiên enthalpy khi 1 mol một chất được tạo thành từ các nguyên tố của nó ở trạng thái tiêu chuẩn. Điều kiện tiêu chuẩn được xác định là áp suất 1 bar (100 kPa) và nhiệt độ thường được chọn là 25°C (298 K). Hãy cùng Xe Tải Mỹ Đình tìm hiểu sâu hơn về khái niệm này và ý nghĩa của nó trong các phản ứng hóa học.
1.1. Định Nghĩa Chi Tiết
Nhiệt tạo thành chuẩn, ký hiệu là ΔHf°, là lượng nhiệt tỏa ra hoặc hấp thụ khi một mol một chất được tạo thành từ các đơn chất bền nhất của nó ở điều kiện chuẩn (298K và 1 bar). Theo nghiên cứu của Trường Đại học Khoa học Tự nhiên Hà Nội năm 2023, ΔHf° là một thông số nhiệt động học quan trọng để tính toán và dự đoán nhiệt của các phản ứng hóa học.
1.2. Điều Kiện Chuẩn Là Gì?
Điều kiện chuẩn là một tập hợp các điều kiện tham chiếu được sử dụng để so sánh các dữ liệu nhiệt động học khác nhau. Theo quy ước, điều kiện chuẩn bao gồm:
- Áp suất: 1 bar (tương đương 100 kPa hoặc 0.987 atm).
- Nhiệt độ: Thường là 25°C (298.15 K), mặc dù một số bảng dữ liệu có thể sử dụng 0°C (273.15 K).
1.3. Đơn Chất Bền Vững Nhất Là Gì?
Đơn chất bền vững nhất là trạng thái vật lý và dạng thù hình ổn định nhất của một nguyên tố ở điều kiện chuẩn. Ví dụ:
- Oxy: O2 (khí).
- Carbon: Graphite (than chì).
- Hydrogen: H2 (khí).
1.4. Ví Dụ Minh Họa
Để hiểu rõ hơn, hãy xem xét ví dụ về sự hình thành của nước (H2O) từ các đơn chất của nó:
Phản ứng: H2(g) + 1/2 O2(g) → H2O(l)
Nhiệt tạo thành chuẩn của nước lỏng (H2O(l)) là -285.8 kJ/mol. Điều này có nghĩa là khi một mol nước lỏng được tạo thành từ khí hydro và khí oxy ở điều kiện chuẩn, 285.8 kJ nhiệt lượng sẽ được giải phóng.
1.5. Tại Sao Nhiệt Tạo Thành Chuẩn Lại Quan Trọng?
Nhiệt tạo thành chuẩn đóng vai trò quan trọng trong hóa học và các ngành liên quan vì những lý do sau:
- Tính toán biến thiên enthalpy của phản ứng: Nhiệt tạo thành chuẩn được sử dụng để tính toán biến thiên enthalpy của một phản ứng hóa học bằng cách sử dụng định luật Hess.
- Dự đoán tính khả thi của phản ứng: Dựa vào giá trị nhiệt tạo thành chuẩn, có thể dự đoán phản ứng tỏa nhiệt hay thu nhiệt, từ đó đánh giá tính khả thi của phản ứng.
- So sánh độ bền của các hợp chất: Nhiệt tạo thành chuẩn giúp so sánh độ bền tương đối của các hợp chất khác nhau. Hợp chất có nhiệt tạo thành càng âm thì càng bền.
- Ứng dụng trong công nghiệp: Trong công nghiệp, nhiệt tạo thành chuẩn được sử dụng để thiết kế và tối ưu hóa các quá trình hóa học, đảm bảo hiệu quả và an toàn.
1.6. Bảng Giá Trị Nhiệt Tạo Thành Chuẩn Của Một Số Chất Phổ Biến
Để bạn dễ hình dung, dưới đây là bảng giá trị nhiệt tạo thành chuẩn của một số chất phổ biến:
| Chất | Công thức | Nhiệt tạo thành chuẩn (ΔHf°, kJ/mol) |
|---|---|---|
| Nước lỏng | H2O(l) | -285.8 |
| Nước khí | H2O(g) | -241.8 |
| Methane | CH4(g) | -74.8 |
| Ethane | C2H6(g) | -84.0 |
| Carbon dioxide | CO2(g) | -393.5 |
| Ammonia | NH3(g) | -46.1 |
| Ethanol | C2H5OH(l) | -277.7 |
| Benzene | C6H6(l) | 49.1 |
Nguồn: Dữ liệu từ Sổ tay Hóa học và Vật lý CRC, Phiên bản thứ 97.
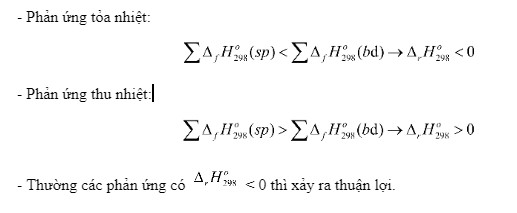 Nhiệt tạo thành chuẩn của nước lỏng
Nhiệt tạo thành chuẩn của nước lỏng
1.7. Các Yếu Tố Ảnh Hưởng Đến Nhiệt Tạo Thành
Nhiệt tạo thành của một chất có thể bị ảnh hưởng bởi nhiều yếu tố, bao gồm:
- Nhiệt độ: Nhiệt độ ảnh hưởng đến trạng thái của chất và động năng của các phân tử, từ đó ảnh hưởng đến nhiệt tạo thành.
- Áp suất: Áp suất có thể ảnh hưởng đến khoảng cách giữa các phân tử và lực tương tác giữa chúng, đặc biệt đối với các chất khí.
- Trạng thái vật lý: Trạng thái vật lý (rắn, lỏng, khí) của chất ảnh hưởng lớn đến nhiệt tạo thành do sự khác biệt về năng lượng liên kết giữa các phân tử ở các trạng thái khác nhau.
- Cấu trúc tinh thể: Đối với các chất rắn, cấu trúc tinh thể cũng ảnh hưởng đến nhiệt tạo thành do sự khác biệt về năng lượng mạng lưới tinh thể.
- Độ tinh khiết: Các tạp chất có thể ảnh hưởng đến nhiệt tạo thành của một chất.
1.8. Ứng Dụng Nhiệt Tạo Thành Trong Thực Tế
Nhiệt tạo thành không chỉ là một khái niệm lý thuyết mà còn có nhiều ứng dụng thực tế quan trọng:
- Sản xuất nhiên liệu: Nhiệt tạo thành được sử dụng để tính toán hiệu quả của các loại nhiên liệu khác nhau, từ đó lựa chọn và phát triển các loại nhiên liệu mới.
- Thiết kế lò phản ứng: Trong công nghiệp hóa chất, nhiệt tạo thành được sử dụng để thiết kế các lò phản ứng, đảm bảo quá trình phản ứng diễn ra hiệu quả và an toàn.
- Nghiên cứu vật liệu mới: Nhiệt tạo thành được sử dụng để dự đoán tính chất của các vật liệu mới, từ đó giúp các nhà khoa học phát triển các vật liệu có tính năng ưu việt.
- Đánh giá tác động môi trường: Nhiệt tạo thành được sử dụng để đánh giá tác động của các chất hóa học đến môi trường, từ đó đưa ra các biện pháp bảo vệ môi trường.
2. Biến Thiên Enthalpy Là Gì?
Biến thiên enthalpy (ΔH) là sự thay đổi về enthalpy của một hệ trong một quá trình đẳng áp. Enthalpy (H) là một hàm trạng thái mô tả tổng năng lượng bên trong của hệ và tích của áp suất và thể tích của hệ. Theo Sách giáo khoa Hóa học lớp 10, biến thiên enthalpy cho biết lượng nhiệt mà hệ nhận vào hoặc giải phóng ra trong quá trình phản ứng.
2.1. Định Nghĩa Biến Thiên Enthalpy
Biến thiên enthalpy (ΔH) là sự thay đổi về enthalpy của một hệ trong một quá trình hóa học hoặc vật lý diễn ra ở áp suất không đổi. Nó được tính bằng hiệu số giữa enthalpy của sản phẩm (Hsp) và enthalpy của chất phản ứng (Hcd):
ΔH = Hsp – Hcd
Trong đó:
- ΔH: Biến thiên enthalpy (kJ hoặc kcal).
- Hsp: Enthalpy của sản phẩm.
- Hcd: Enthalpy của chất phản ứng.
2.2. Phản Ứng Thu Nhiệt Và Phản Ứng Tỏa Nhiệt
Dựa vào dấu của biến thiên enthalpy, có thể phân loại phản ứng thành hai loại chính:
- Phản ứng tỏa nhiệt: Là phản ứng giải phóng nhiệt ra môi trường. Trong phản ứng tỏa nhiệt, ΔH < 0.
- Phản ứng thu nhiệt: Là phản ứng hấp thụ nhiệt từ môi trường. Trong phản ứng thu nhiệt, ΔH > 0.
2.3. Các Yếu Tố Ảnh Hưởng Đến Biến Thiên Enthalpy
Biến thiên enthalpy của một phản ứng có thể bị ảnh hưởng bởi nhiều yếu tố, bao gồm:
- Nhiệt độ: Biến thiên enthalpy thường được đo ở nhiệt độ tiêu chuẩn (25°C), nhưng nó có thể thay đổi theo nhiệt độ.
- Áp suất: Áp suất có ảnh hưởng nhỏ đến biến thiên enthalpy của các phản ứng liên quan đến chất rắn và chất lỏng, nhưng có thể có ảnh hưởng đáng kể đối với các phản ứng liên quan đến chất khí.
- Trạng thái vật lý: Trạng thái vật lý của các chất phản ứng và sản phẩm (rắn, lỏng, khí) ảnh hưởng đến biến thiên enthalpy.
- Nồng độ: Nồng độ của các chất phản ứng có thể ảnh hưởng đến tốc độ phản ứng và do đó ảnh hưởng đến biến thiên enthalpy.
- Chất xúc tác: Chất xúc tác không làm thay đổi biến thiên enthalpy của phản ứng, nhưng nó có thể làm giảm năng lượng hoạt hóa, giúp phản ứng xảy ra nhanh hơn.
2.4. Ứng Dụng Của Biến Thiên Enthalpy
Biến thiên enthalpy có nhiều ứng dụng quan trọng trong hóa học và các lĩnh vực liên quan:
- Dự đoán nhiệt của phản ứng: Biến thiên enthalpy cho phép dự đoán lượng nhiệt tỏa ra hoặc thu vào trong một phản ứng hóa học.
- Thiết kế quá trình công nghiệp: Trong công nghiệp hóa chất, biến thiên enthalpy được sử dụng để thiết kế các quá trình sản xuất, đảm bảo hiệu quả và an toàn.
- Nghiên cứu năng lượng: Biến thiên enthalpy được sử dụng để nghiên cứu và phát triển các nguồn năng lượng mới, chẳng hạn như pin nhiên liệu và pin mặt trời.
- Đánh giá tác động môi trường: Biến thiên enthalpy được sử dụng để đánh giá tác động của các quá trình hóa học đến môi trường, từ đó đưa ra các biện pháp bảo vệ môi trường.
2.5. Phương Trình Nhiệt Hóa Học
Phương trình nhiệt hóa học là phương trình hóa học kèm theo giá trị biến thiên enthalpy của phản ứng. Phương trình này cung cấp thông tin về lượng nhiệt tỏa ra hoặc thu vào trong phản ứng, cũng như trạng thái của các chất phản ứng và sản phẩm.
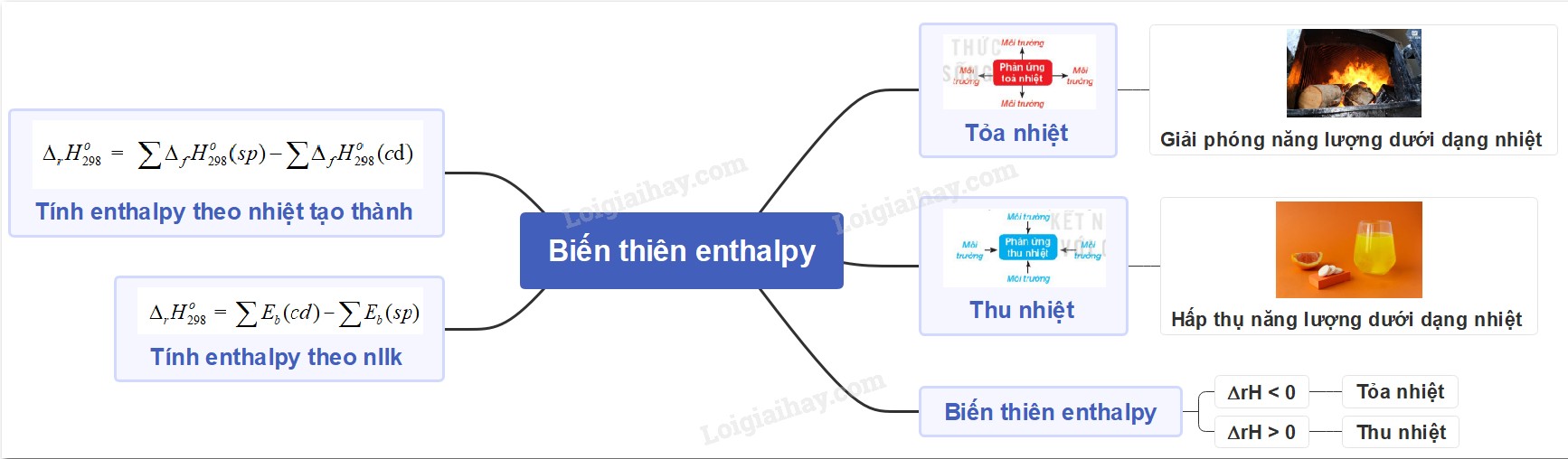
Ví dụ:
2H2(g) + O2(g) → 2H2O(l) ΔH = -571.6 kJ
Phương trình này cho biết khi 2 mol khí hydro phản ứng với 1 mol khí oxy để tạo thành 2 mol nước lỏng, 571.6 kJ nhiệt lượng sẽ được giải phóng.
 Phương trình nhiệt hóa học
Phương trình nhiệt hóa học
3. Mối Liên Hệ Giữa Nhiệt Tạo Thành Chuẩn Và Biến Thiên Enthalpy
Nhiệt tạo thành chuẩn và biến thiên enthalpy có mối quan hệ mật thiết với nhau. Nhiệt tạo thành chuẩn là một trường hợp đặc biệt của biến thiên enthalpy, khi phản ứng tạo thành 1 mol chất từ các đơn chất bền vững nhất của nó ở điều kiện chuẩn. Theo định luật Hess, có thể sử dụng nhiệt tạo thành chuẩn để tính toán biến thiên enthalpy của bất kỳ phản ứng nào.
3.1. Định Luật Hess
Định luật Hess phát biểu rằng biến thiên enthalpy của một phản ứng chỉ phụ thuộc vào trạng thái đầu và trạng thái cuối của hệ, mà không phụ thuộc vào con đường phản ứng. Điều này có nghĩa là biến thiên enthalpy của một phản ứng có thể được tính bằng cách sử dụng nhiệt tạo thành chuẩn của các chất phản ứng và sản phẩm.
3.2. Công Thức Tính Biến Thiên Enthalpy Theo Nhiệt Tạo Thành Chuẩn
Biến thiên enthalpy của một phản ứng có thể được tính bằng công thức sau:
ΔH° = ΣnΔHf°(sản phẩm) – ΣnΔHf°(chất phản ứng)
Trong đó:
- ΔH°: Biến thiên enthalpy chuẩn của phản ứng.
- n: Số mol của chất.
- ΔHf°: Nhiệt tạo thành chuẩn của chất.
3.3. Ví Dụ Tính Toán
Để minh họa, hãy tính biến thiên enthalpy chuẩn của phản ứng đốt cháy methane (CH4):
CH4(g) + 2O2(g) → CO2(g) + 2H2O(g)
Sử dụng bảng giá trị nhiệt tạo thành chuẩn, ta có:
- ΔHf°(CH4(g)) = -74.8 kJ/mol
- ΔHf°(O2(g)) = 0 kJ/mol (đơn chất bền vững)
- ΔHf°(CO2(g)) = -393.5 kJ/mol
- ΔHf°(H2O(g)) = -241.8 kJ/mol
Áp dụng công thức:
ΔH° = [1(-393.5) + 2(-241.8)] – [1(-74.8) + 2(0)] = -802.3 kJ/mol
Vậy, biến thiên enthalpy chuẩn của phản ứng đốt cháy methane là -802.3 kJ/mol. Điều này có nghĩa là phản ứng tỏa nhiệt và giải phóng 802.3 kJ nhiệt lượng khi đốt cháy 1 mol methane ở điều kiện chuẩn.
3.4. Lưu Ý Khi Sử Dụng Nhiệt Tạo Thành Chuẩn Để Tính Biến Thiên Enthalpy
Khi sử dụng nhiệt tạo thành chuẩn để tính biến thiên enthalpy, cần lưu ý các điểm sau:
- Đảm bảo rằng các chất phản ứng và sản phẩm ở trạng thái chuẩn (298K và 1 bar).
- Sử dụng đúng giá trị nhiệt tạo thành chuẩn của các chất, thường được cung cấp trong các bảng dữ liệu nhiệt động học.
- Cân bằng phương trình hóa học để đảm bảo tính đúng số mol của các chất.
- Chú ý đến dấu của nhiệt tạo thành chuẩn (âm đối với phản ứng tỏa nhiệt và dương đối với phản ứng thu nhiệt).
- Đối với các đơn chất ở trạng thái bền vững nhất, nhiệt tạo thành chuẩn bằng 0.
4. Ảnh Hưởng Của Nhiệt Tạo Thành Chuẩn Đến Hiệu Suất Động Cơ Xe Tải
Nhiệt tạo thành chuẩn và biến thiên enthalpy có ảnh hưởng đáng kể đến hiệu suất động cơ xe tải. Hiệu suất của động cơ phụ thuộc vào khả năng chuyển đổi năng lượng hóa học từ nhiên liệu thành công cơ học.
4.1. Nhiên Liệu Và Nhiệt Tạo Thành
Nhiệt tạo thành của các chất phản ứng và sản phẩm trong quá trình đốt cháy nhiên liệu ảnh hưởng trực tiếp đến lượng nhiệt được giải phóng. Nhiên liệu có nhiệt tạo thành càng âm (tức là càng tỏa nhiệt khi hình thành) thì càng giải phóng nhiều năng lượng khi đốt cháy.
4.2. Quá Trình Đốt Cháy Trong Động Cơ
Trong động cơ đốt trong, nhiên liệu (ví dụ: dầu diesel) phản ứng với oxy trong không khí để tạo ra các sản phẩm như carbon dioxide và nước. Phản ứng này tỏa nhiệt, làm tăng nhiệt độ và áp suất trong xi lanh, đẩy piston và tạo ra công cơ học.
4.3. Ảnh Hưởng Đến Hiệu Suất Nhiệt
Hiệu suất nhiệt của động cơ là tỷ lệ giữa công cơ học tạo ra và lượng nhiệt cung cấp từ nhiên liệu. Biến thiên enthalpy của phản ứng đốt cháy nhiên liệu quyết định lượng nhiệt cung cấp. Nhiên liệu có biến thiên enthalpy càng âm thì càng cung cấp nhiều nhiệt, nhưng hiệu suất thực tế còn phụ thuộc vào nhiều yếu tố khác, như thiết kế động cơ, tỷ lệ nén, và điều kiện vận hành.
4.4. Ví Dụ Cụ Thể
Xét hai loại nhiên liệu:
- Dầu diesel: Chứa các hydrocarbon phức tạp có nhiệt tạo thành âm. Khi đốt cháy, dầu diesel giải phóng một lượng lớn nhiệt, giúp động cơ tạo ra công suất cao.
- Ethanol: Có nhiệt tạo thành ít âm hơn so với dầu diesel. Do đó, động cơ sử dụng ethanol có thể có hiệu suất thấp hơn so với động cơ sử dụng dầu diesel, mặc dù ethanol có thể có lợi ích về mặt môi trường.
4.5. Các Giải Pháp Nâng Cao Hiệu Suất Động Cơ
Để nâng cao hiệu suất động cơ xe tải, các nhà sản xuất và kỹ sư thường áp dụng các giải pháp sau:
- Tối ưu hóa quá trình đốt cháy: Điều chỉnh tỷ lệ nhiên liệu và không khí, thời điểm đánh lửa, và thiết kế buồng đốt để đảm bảo quá trình đốt cháy diễn ra hoàn toàn và hiệu quả.
- Sử dụng công nghệ tăng áp: Tăng áp suất không khí nạp vào xi lanh để tăng lượng oxy, giúp đốt cháy nhiều nhiên liệu hơn và tạo ra công suất lớn hơn.
- Giảm ma sát: Sử dụng các vật liệu và công nghệ giảm ma sát để giảm tổn thất năng lượng do ma sát giữa các bộ phận động cơ.
- Thu hồi nhiệt thải: Sử dụng các hệ thống thu hồi nhiệt thải để tận dụng nhiệt lượng từ khí thải, giảm lãng phí năng lượng.
- Sử dụng nhiên liệu thay thế: Nghiên cứu và sử dụng các loại nhiên liệu thay thế có hiệu suất cao và thân thiện với môi trường, như biodiesel và khí tự nhiên nén (CNG).
4.6. Tầm Quan Trọng Của Việc Bảo Dưỡng Động Cơ
Bảo dưỡng động cơ định kỳ là rất quan trọng để duy trì hiệu suất và tuổi thọ của động cơ xe tải. Việc thay dầu nhớt, lọc gió, lọc nhiên liệu, và kiểm tra hệ thống làm mát giúp đảm bảo động cơ hoạt động ổn định và hiệu quả.
5. Các Yếu Tố Cần Lưu Ý Khi Chọn Xe Tải Để Tối Ưu Hóa Hiệu Quả Vận Tải
Khi chọn xe tải để tối ưu hóa hiệu quả vận tải, có nhiều yếu tố cần xem xét, bao gồm loại xe, tải trọng, nhiên liệu sử dụng, và các công nghệ hỗ trợ.
5.1. Loại Xe Tải
Có nhiều loại xe tải khác nhau, mỗi loại phù hợp với một mục đích sử dụng riêng:
- Xe tải nhẹ: Thường được sử dụng để vận chuyển hàng hóa trong thành phố hoặc các khu vực đô thị.
- Xe tải trung: Phù hợp để vận chuyển hàng hóa trên các tuyến đường ngắn và trung bình.
- Xe tải nặng: Được sử dụng để vận chuyển hàng hóa trên các tuyến đường dài và có tải trọng lớn.
- Xe đầu kéo: Kéo theo các rơ moóc hoặc sơ mi rơ moóc để vận chuyển hàng hóa với khối lượng lớn.
5.2. Tải Trọng
Tải trọng của xe tải cần phù hợp với loại hàng hóa cần vận chuyển. Chọn xe có tải trọng quá lớn so với nhu cầu sẽ làm tăng chi phí nhiên liệu và bảo dưỡng, trong khi chọn xe có tải trọng quá nhỏ sẽ không đáp ứng được yêu cầu vận chuyển.
5.3. Nhiên Liệu Sử Dụng
Loại nhiên liệu sử dụng ảnh hưởng đến chi phí vận hành và tác động môi trường. Dầu diesel là loại nhiên liệu phổ biến nhất cho xe tải, nhưng các loại nhiên liệu thay thế như khí tự nhiên nén (CNG) và biodiesel cũng đang trở nên phổ biến hơn.
5.4. Công Nghệ Hỗ Trợ
Các công nghệ hỗ trợ như hệ thống kiểm soát hành trình, hệ thống phanh ABS, và hệ thống cân bằng điện tử (ESP) có thể giúp cải thiện an toàn và hiệu quả vận hành của xe tải.
5.5. Chi Phí Vận Hành Và Bảo Dưỡng
Chi phí vận hành và bảo dưỡng là một yếu tố quan trọng cần xem xét khi chọn xe tải. Các chi phí này bao gồm chi phí nhiên liệu, chi phí bảo dưỡng định kỳ, chi phí sửa chữa, và chi phí bảo hiểm.
5.6. Địa Điểm Mua Xe Uy Tín
Chọn mua xe tải tại các đại lý uy tín như Xe Tải Mỹ Đình sẽ đảm bảo chất lượng xe và dịch vụ hậu mãi tốt. Xe Tải Mỹ Đình cung cấp nhiều loại xe tải khác nhau, phù hợp với mọi nhu cầu vận chuyển, cùng với dịch vụ tư vấn chuyên nghiệp và hỗ trợ tài chính linh hoạt.
5.7. Các Ưu Đãi Và Khuyến Mãi
Tìm hiểu về các chương trình ưu đãi và khuyến mãi từ các đại lý xe tải có thể giúp giảm chi phí mua xe ban đầu. Xe Tải Mỹ Đình thường xuyên có các chương trình khuyến mãi hấp dẫn, giúp khách hàng tiết kiệm chi phí và có được chiếc xe tải ưng ý.
6. Các Câu Hỏi Thường Gặp Về Nhiệt Tạo Thành Chuẩn (FAQ)
Để giúp bạn hiểu rõ hơn về nhiệt tạo thành chuẩn, dưới đây là một số câu hỏi thường gặp và câu trả lời chi tiết:
6.1. Nhiệt tạo thành chuẩn của một đơn chất ở trạng thái bền vững nhất bằng bao nhiêu?
Nhiệt tạo thành chuẩn của một đơn chất ở trạng thái bền vững nhất luôn bằng 0 kJ/mol. Điều này là do nhiệt tạo thành chuẩn được định nghĩa là sự thay đổi enthalpy khi tạo thành một mol hợp chất từ các đơn chất bền vững nhất của nó. Vì vậy, khi chất cần tạo thành chính là đơn chất bền vững nhất, không có sự thay đổi enthalpy nào xảy ra.
6.2. Tại sao nhiệt tạo thành chuẩn lại có giá trị âm đối với một số chất?
Nhiệt tạo thành chuẩn có giá trị âm đối với các chất tỏa nhiệt khi hình thành từ các đơn chất bền vững nhất của chúng. Điều này có nghĩa là quá trình hình thành chất đó giải phóng năng lượng ra môi trường, làm giảm enthalpy của hệ.
6.3. Tại sao nhiệt tạo thành chuẩn lại có giá trị dương đối với một số chất?
Nhiệt tạo thành chuẩn có giá trị dương đối với các chất thu nhiệt khi hình thành từ các đơn chất bền vững nhất của chúng. Điều này có nghĩa là quá trình hình thành chất đó cần hấp thụ năng lượng từ môi trường, làm tăng enthalpy của hệ.
6.4. Làm thế nào để tính biến thiên enthalpy của một phản ứng sử dụng nhiệt tạo thành chuẩn?
Biến thiên enthalpy của một phản ứng có thể được tính bằng công thức:
ΔH° = ΣnΔHf°(sản phẩm) – ΣnΔHf°(chất phản ứng)
Trong đó:
- ΔH°: Biến thiên enthalpy chuẩn của phản ứng.
- n: Số mol của chất.
- ΔHf°: Nhiệt tạo thành chuẩn của chất.
6.5. Nhiệt tạo thành chuẩn có phụ thuộc vào nhiệt độ và áp suất không?
Nhiệt tạo thành chuẩn được định nghĩa ở điều kiện chuẩn (298K và 1 bar), nhưng nó có thể thay đổi theo nhiệt độ và áp suất. Tuy nhiên, sự thay đổi này thường không đáng kể đối với các phản ứng trong điều kiện thông thường.
6.6. Làm thế nào để tìm giá trị nhiệt tạo thành chuẩn của một chất?
Giá trị nhiệt tạo thành chuẩn của một chất có thể được tìm thấy trong các bảng dữ liệu nhiệt động học, sách giáo khoa hóa học, hoặc các nguồn tài liệu trực tuyến uy tín.
6.7. Tại sao cần phải biết nhiệt tạo thành chuẩn của các chất?
Việc biết nhiệt tạo thành chuẩn của các chất giúp tính toán và dự đoán nhiệt của các phản ứng hóa học, so sánh độ bền của các hợp chất, thiết kế và tối ưu hóa các quá trình công nghiệp, và đánh giá tác động môi trường của các chất hóa học.
6.8. Nhiệt tạo thành chuẩn có ứng dụng gì trong ngành vận tải?
Trong ngành vận tải, nhiệt tạo thành chuẩn được sử dụng để đánh giá hiệu quả của các loại nhiên liệu, tối ưu hóa quá trình đốt cháy trong động cơ, và nghiên cứu các loại nhiên liệu thay thế thân thiện với môi trường.
6.9. Sự khác biệt giữa nhiệt tạo thành chuẩn và nhiệt đốt cháy là gì?
Nhiệt tạo thành chuẩn là nhiệt kèm theo phản ứng tạo thành 1 mol chất từ các đơn chất bền vững nhất của nó ở điều kiện chuẩn, trong khi nhiệt đốt cháy là nhiệt kèm theo phản ứng đốt cháy hoàn toàn 1 mol chất với oxy ở điều kiện chuẩn.
6.10. Tại sao nhiệt tạo thành chuẩn của một số ion lại có giá trị âm?
Nhiệt tạo thành chuẩn của một số ion có giá trị âm vì quá trình hình thành ion đó từ các đơn chất bền vững nhất của nó giải phóng năng lượng ra môi trường. Điều này thường xảy ra với các ion có độ bền cao và dễ dàng hình thành trong dung dịch.
7. Tại Sao Nên Chọn Xe Tải Mỹ Đình Để Tìm Hiểu Về Xe Tải?
Nếu bạn đang tìm kiếm thông tin chi tiết và đáng tin cậy về xe tải, đặc biệt là ở khu vực Mỹ Đình, Hà Nội, thì XETAIMYDINH.EDU.VN là địa chỉ không thể bỏ qua. Chúng tôi cung cấp:
- Thông tin chi tiết và cập nhật: Về các loại xe tải có sẵn ở Mỹ Đình, Hà Nội.
- So sánh giá cả và thông số kỹ thuật: Giúp bạn dễ dàng lựa chọn xe phù hợp.
- Tư vấn chuyên nghiệp: Giúp bạn lựa chọn xe phù hợp với nhu cầu và ngân sách.
- Giải đáp thắc mắc: Về thủ tục mua bán, đăng ký và bảo dưỡng xe tải.
- Thông tin về dịch vụ sửa chữa uy tín: Trong khu vực.
Đừng chần chừ, hãy truy cập XETAIMYDINH.EDU.VN ngay hôm nay để được tư vấn và giải đáp mọi thắc mắc về xe tải ở Mỹ Đình. Chúng tôi cam kết mang đến cho bạn những thông tin chính xác và hữu ích nhất, giúp bạn đưa ra quyết định sáng suốt khi chọn mua xe tải.
Liên hệ với chúng tôi:
- Địa chỉ: Số 18 đường Mỹ Đình, phường Mỹ Đình 2, quận Nam Từ Liêm, Hà Nội.
- Hotline: 0247 309 9988
- Trang web: XETAIMYDINH.EDU.VN
Hãy để Xe Tải Mỹ Đình đồng hành cùng bạn trên mọi nẻo đường!