Công thức electron (công thức E) của HClO là cách biểu diễn sự phân bố electron trong phân tử axit hipoclorơ, giúp ta hiểu rõ hơn về cấu trúc và tính chất của nó. Bài viết này của Xe Tải Mỹ Đình sẽ đi sâu vào Công Thức E Của Hclo, cùng với các ví dụ minh họa và bài tập luyện tập, giúp bạn nắm vững kiến thức và ứng dụng hiệu quả. Chúng tôi sẽ cung cấp thông tin chi tiết, dễ hiểu và đáng tin cậy, giúp bạn tự tin hơn trong học tập và công việc. Hãy cùng khám phá những thông tin hữu ích về xe tải và nhiều hơn nữa tại XETAIMYDINH.EDU.VN, nơi kiến thức và kinh nghiệm được chia sẻ một cách tận tâm và chuyên nghiệp.
1. Tổng Quan Về Công Thức Cấu Tạo Phân Tử
1.1. Khái Niệm Và Lý Thuyết Cơ Bản
Công thức cấu tạo phân tử là một phương pháp biểu diễn trực quan cách các nguyên tử liên kết với nhau trong một phân tử. Nó cho thấy rõ trật tự và kiểu liên kết giữa các nguyên tử, giúp ta hiểu rõ hơn về cấu trúc và tính chất của phân tử đó. Để viết công thức cấu tạo của một phân tử, bạn có thể tuân theo các bước sau đây:
- Xác định số lượng và loại nguyên tử: Liệt kê tất cả các nguyên tố có mặt trong phân tử và số lượng của chúng.
- Viết công thức Lewis (công thức electron):
- Tính tổng số electron hóa trị của tất cả các nguyên tử trong phân tử.
- Xác định nguyên tử trung tâm (thường là nguyên tử ít âm điện hơn).
- Vẽ các liên kết đơn giữa nguyên tử trung tâm và các nguyên tử xung quanh.
- Phân phối các electron còn lại thành các cặp electron tự do xung quanh các nguyên tử sao cho mỗi nguyên tử (trừ hydro) có 8 electron (tuân theo quy tắc octet).
- Chuyển đổi công thức Lewis thành công thức cấu tạo: Thay mỗi cặp electron liên kết bằng một gạch nối (-). Các cặp electron tự do có thể được giữ lại hoặc bỏ đi tùy theo mục đích hiển thị.
Lưu ý quan trọng:
- Liên kết cho – nhận (phối trí): Khi một nguyên tử đã đạt cấu hình bền vững nhưng vẫn còn cặp electron tự do, nó có thể chia sẻ cặp electron này với một nguyên tử khác chưa đạt cấu hình bền vững, tạo thành liên kết cho – nhận. Liên kết này thường được biểu diễn bằng mũi tên (→) hướng từ nguyên tử cho sang nguyên tử nhận.
- Độ âm điện: Khi có nhiều nguyên tử có khả năng cho cặp electron, ưu tiên nguyên tử có độ âm điện nhỏ hơn.
1.2. Ví Dụ Minh Họa Cụ Thể
Để hiểu rõ hơn về cách viết công thức cấu tạo, chúng ta sẽ xem xét một số ví dụ cụ thể:
Ví dụ 1: Phân tử H3O+
 Công thức cấu tạo phân tử H3O+
Công thức cấu tạo phân tử H3O+
Trong phân tử H3O+, nguyên tử oxy đã liên kết với ba nguyên tử hydro. Oxy còn một cặp electron tự do, cặp electron này có thể được sử dụng để tạo liên kết với một proton (H+), tạo thành ion hydronium (H3O+).
Ví dụ 2: Phân tử HNO3
 Công thức cấu tạo phân tử HNO3
Công thức cấu tạo phân tử HNO3
Trong phân tử HNO3, nguyên tử nitơ liên kết với một nguyên tử hydro và ba nguyên tử oxy. Một trong số các liên kết N-O là liên kết đôi, và một liên kết N-O khác là liên kết cho – nhận, trong đó nitơ chia sẻ cặp electron của mình với oxy.
Ví dụ 3: Phân tử H2SO4 và HClO4
 Công thức cấu tạo của phân tử H2SO4 và HClO4
Công thức cấu tạo của phân tử H2SO4 và HClO4
Các phân tử này cho thấy rằng quy tắc octet không phải lúc nào cũng đúng, đặc biệt với các nguyên tử trung tâm có khả năng mở rộng lớp vỏ hóa trị của chúng (như S và Cl).
2. Áp Dụng Viết Công Thức Cấu Tạo Cho Các Phân Tử Khác Nhau
2.1. Bài Tập Cơ Bản Và Nâng Cao
Để củng cố kiến thức về công thức cấu tạo, chúng ta sẽ cùng nhau giải một số bài tập từ cơ bản đến nâng cao.
Câu 1: Viết công thức electron và công thức cấu tạo của các phân tử sau: PH3, SO2.
Giải:
| Phân tử | Công thức electron | Công thức cấu tạo |
|---|---|---|
| PH3 | ||
| SO2 |
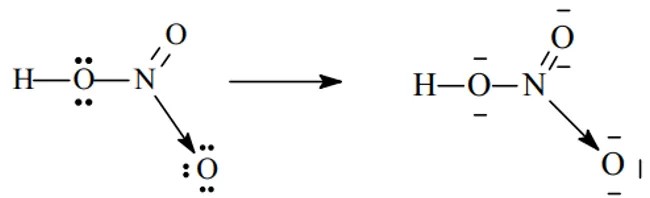
Câu 2: Viết công thức electron và công thức cấu tạo của các chất: HClO, HCN, HNO2.
Giải:
-
HClO:
-
Công thức electron:
-
Công thức cấu tạo: H-O-Cl
-
-
HCN:
-
Công thức electron:
-
Công thức cấu tạo:
-
-
HNO2:
-
Công thức electron:
-
Công thức cấu tạo: H-O-N=O
-
Câu 3: Viết công thức electron và công thức cấu tạo của các chất sau: NH3, C2H2, C2H4, CH4, Cl2, HCl, H2O.
Giải:
| Phân tử | Công thức electron | Công thức cấu tạo |
|---|---|---|
| NH3 | ||
| C2H2 | ||
| C2H4 | ||
| CH4 | ||
| Cl2 | ||
| HCl | ||
| H2O |
Câu 4: Viết công thức cấu tạo của các chất sau: Cl2O, HClO, Cl2O3, HClO2, Cl2O5, HClO3, Cl2O7.
Giải:
-
Cl2O: Cl-O-Cl
-
HClO: H-O-Cl (Axit hipoclorơ)
-
HClO2: H-O-Cl→O hay H-O-Cl=O (Axit clorơ)
-
Cl2O5:
-
HClO3:
-
Cl2O7:
 Công thức cấu tạo của Cl2O7
Công thức cấu tạo của Cl2O7
Câu 5: A là một nguyên tố phi kim. Tổng đại số giữa số oxi hóa dương cao nhất với 2 lần số oxi hóa âm thấp nhất của nguyên tố A là +2. Tổng số proton và neutron của A nhỏ hơn 34.
a) Xác định A.
b) B là một hợp chất khí của A với H, C là oxit của A mà trong đó có chứa 50% oxi về khối lượng. Xác định công thức phân tử của hợp chất B và C.
c) Viết công thức cấu tạo của các phân tử AO2; AO3; H2AO4.
Giải:
a) Gọi số oxi hóa dương cao nhất và số oxi hóa âm thấp nhất của A lần lượt là +m và -n.
Số oxi hóa cao nhất của A trong oxit là +m nên ở lớp ngoài cùng nguyên tử A sẽ có m electron.
Số oxi hóa trong hợp chất của A với H là -n nên để đạt được cấu hình với 8 electron bão hòa của khí hiếm thì lớp ngoài cùng của nguyên tử A cần phải nhận thêm n electron nữa.
Theo đề bài ta có: m + n = 8. Mặt khác: +m + 2(-n) = +2 => m – 2n = 2.
Từ đây suy ra được: m = 6 và n = 2. Vậy A là một phi kim thuộc nhóm VI.
Số khối của A < 34 – số proton => 2 số proton < 34 => số proton < 17.
Vậy A là S (lưu huỳnh)
b) Trong hợp chất B, S có số oxi hóa thấp nhất nên B phải có công thức là H2S.
Gọi công thức oxit C là SOn.
Do %S = 50% nên ta có: 32/16n = 50/50 => n = 2
Vậy công thức của C sẽ là SO2
c) Ta có công thức cấu tạo của các chất SO2; SO3; H2SO4 lần lượt là:
Câu 6: Để khử hoàn toàn 16g oxit của một kim loại thành kim loại thì cần dùng đến 6,72l H2. Hòa tan toàn bộ lượng kim loại thu được vào trong dung dịch HCl loãng thì thấy thoát ra ngoài 4,48l khí H2. Biết các khí đều được đo ở điều kiện tiêu chuẩn. Hãy xác định công thức của oxit đó. Từ đó cho biết số oxi hóa và hóa trị của kim loại trong oxit.
Giải:
Gọi công thức của oxit là AxOy = b mol.
AxOy + yH2 → xA + yH2O
(mol): b by bx
Ta có: a(Mx + 16y) = 16 và lại có: ay = 0,3. Vì thế suy ra: Max = 11,2
2A + 2nHCl → 2ACln + nH2
(mol): ax 0,5nax
Ta lại có: 0,5nax = 0,2 nên suy ra nax = 0,4.
Ta có tỉ lệ sau: M/n = Max/nax = 11,2/0,4 . Vậy suy ra M = 28n.
Ta lập bảng sau:
| n | 1 | 2 | 3 |
|---|---|---|---|
| M | 28 (loại) | 56 (thỏa mãn) | 84 (loại) |
Vậy kim loại M chính là Fe.
Lập tỉ lệ: x/y = ax/ay = 2/3. Vậy công thức oxit đó là Fe2O3.
Số oxi hóa của sắt trong oxit là +3, sắt có hóa trị là III.
Câu 7: Viết công thức cấu tạo của các ion và phân tử sau: NH4+, Cl2O7, Fe3O4, KMnO4.
Giải:
-
CTCT của NH4+:
 Công thức cấu tạo của NH4+
Công thức cấu tạo của NH4+ -
CTCT của Fe3O4:
-
CTCT của KMnO4:
 Công thức cấu tạo của KMnO4
Công thức cấu tạo của KMnO4 -
CTCT của Cl2O7:
 Công thức cấu tạo của Cl2O7
Công thức cấu tạo của Cl2O7
Câu 8: Tại sao lại nói nitơ là một khí tương đối trơ khi ở nhiệt độ thường?
Giải:
Phân tử N2 có tới 3 liên kết. Trong đó có 1 liên kết σ và 2 liên kết π. Với các liên kết như thế thì mỗi nguyên tử N đều có đủ 8 electron ở lớp electron ngoài cùng giống với nguyên tử neon (có $2s^2 2p^6$). Lớp vỏ hóa trị có đủ 8 electron rất bền vững vì vậy mà phân tử N2 khá trơ khi ở điều kiện nhiệt độ thường.
Câu 9: Viết công thức cấu tạo của các chất có công thức phân tử sau: CH2Cl2 (một chất), C2H4Cl2 (hai chất), C2H4O2 (ba chất).
Giải:
-
CTCT của CH2Cl2:
-
CTCT của C2H4O2:
- CH3COOH
- HCOOCH3
- CHO-CH2-OH
-
CTCT của C2H4Cl2:
- CH3-CHCl2
- Cl-CH2-CH2-Cl
Câu 10: Viết công thức cấu tạo của các chất sau: Cl2O, Cl2O5, HClO3.
Giải:
-
CTCT của Cl2O:
-
CTCT
